miR-196a/LRIG3在结直肠癌组织中的表达及对HCT116细胞增殖、侵袭的影响
任 松,刘雯菲,尚锦秀
全球每年有超过60万人死于结直肠癌(CRC),CRC的高病死率与肿瘤转移特别是肝转移密切相关。据报道,近25%的CRC患者初诊时存在转移,其中约50%最终会发生转移[1]。为改善CRC患者的总体生存期,迫切需要在转移性CRC中寻找新的生物学标志物并及时给予干预措施。微小RNA(miRNA)通过与信使RNA(mRNA)的3-URT区结合,诱导mRNA降解或抑制转录后翻译,其表达改变或功能障碍在肿瘤发生和转移过程中发挥关键作用[2]。miR-4775是CRC转移的危险因素,通过激活转化生长因子-β1(TGF-β1)/Smad7信号级联反应促进CRC细胞的侵袭和转移[3]。值得注意的是,CRC组织中miR-196a水平显著高于邻近正常结直肠黏膜,与CRC患者淋巴结转移和不良预后有关[4]。同时,miR-196a可以促进结肠癌细胞的增殖、迁移和侵袭[5]。上述研究表明,miR-196a参与了CRC的病理过程,但其在CRC中的调控机制还有待进一步阐明。富含亮氨酸重复序列和免疫球蛋白样结构域3(LRIG3)的染色体位于12q13.2区域,该区域是许多肿瘤最常见的基因缺失位点。研究表明,LRIG3基因在多种恶性肿瘤中低表达,但在CRC中的研究较少[6]。本研究通过检测miR-196a在CRC组织中的表达,评估其对HCT116细胞增殖和侵袭的影响。
1 材料与方法
1.1主要试剂与仪器 HCT116细胞(中国科学院典型培养物保藏委员会细胞库);RPMI-1640培养基和胎牛血清(浙江天杭生物科技有限公司);Lipofectamine2000转染试剂盒、miR-196a inhibitor和miRNA阴性对照(miR-NC)(上海吉凯生物公司);Trizol试剂盒(美国Qiagen公司);mRNA逆转录试剂盒和荧光定量PCR试剂盒(美国Promega公司);四噻唑蓝(MTT,美国Amresco公司);细胞蛋白抽提试剂盒(碧云天生物技术研究所);LRIG3、E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)和β-actin抗体(美国Santa Cruz公司);HRP标记山羊抗小鼠IgG二抗(武汉艾美捷科技有限公司)。
1.2组织来源 选取2019年1月—2020年12月在我院结直肠外科手术切除的原发性CRC患者42例,取癌组织和癌旁正常组织标本。
1.3实时荧光定量RT-PCR检测组织中miR-196a和LRIG3 mRNA的表达 取CRC组织,研碎后加入Trizol提取总RNA,将提取的总RNA逆转录为cDNA后在CFX-96 PCR扩增仪中扩增,反应体系20 μl,反应条件为预变性95 ℃ 30 s、95 ℃ 5 s,扩增60 ℃ 44 s、40个循环,以U6作为内参,采用2-ΔΔCt法计算miR-196a和LRIG3 mRNA的相对表达量。
1.4细胞培养及转染 用含10%胎牛血清的RPMI-1640培养基培养HCT116细胞,选取对数生长期细胞进行转染。实验分为空白对照组、miR-196a inhibitor组和miR-NC组。空白对照组在铺板后48 h收获细胞,miR-196a inhibitor组和miR-NC组分别按Lipofectamine2000说明书将miR-196a inhibitor和miR-NC转染到HCT116细胞,48 h后行相关检测。
1.5MTT法检测HCT116细胞增殖率 按照“1.4”方法转染后接种于96孔板中,44 h后加入MTT(50 μl/孔)继续培养4 h,加入二甲基亚砜(200 μl/孔)振荡,测定吸光度(OD)值,计算细胞增殖率。细胞增殖率=(miR-196a inhibitor组OD值-miR-NC组OD值)/空白对照组。
1.6Transwell法检测HCT116细胞侵袭能力 按照“1.4”方法转染后接种于Transwell小室中,下室加入含10%胎牛血清的RPMI-1640培养基,48 h后取出小室,去除上室内细胞,4%甲醛固定10 min后用结晶紫染液染色30 min,冲洗干净后在显微镜下计数紫色染色的穿膜细胞。
1.7Western blot法检测HCT116细胞中LRIG3、E-cadherin和N-cadherin蛋白表达 按照“1.4”方法转染后接种于6孔板中,48 h后收获细胞,加入细胞蛋白抽提液提取蛋白,采用BIO-RAD系统进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,切胶、转膜、封膜后将膜与LRIG3(1︰300)、E-cadherin(1︰200)、N-cadherin(1︰200)和β-actin抗体(1︰500)进行孵育,4 ℃过夜,用HRP标记山羊抗小鼠IgG二抗(1︰5000)在室温下孵育30 min,显色,采集图像分析。
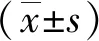
2 结果
2.1miR-196a和LRIG3 mRNA在CRC组织中的表达及相关性 癌组织miR-196a mRNA的相对表达量高于癌旁正常组织[(1.05±0.27)vs(0.64±0.09)](P<0.05);癌组织LRIG3 mRNA的相对表达量低于癌旁正常组织[(0.88±0.13)vs(1.37±0.20)](P<0.05)。癌组织中miR-196a和LRIG3 mRNA水平与TNM分期、肿瘤分化程度、肿瘤浸润深度和肿瘤转移相关(P<0.05,P<0.01)。见表1。Pearson相关分析显示,miR-196a和LRIG3 mRNA在CRC组织中的表达呈负相关(r=-0.442,P=0.013)。见图1。
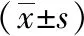
表1 miR-196a和LRIG3 mRNA在不同临床病理特征结直肠癌组织中的表达

图1 42例结直肠癌组织中miR-196a和LRIG3 mRNA表达的相关性
2.2miR-196a靶向结合LRIG3 mRNA情况 为预测miR-196a的潜在靶点,本研究通过生物信息学网站(www.Targetscan.org)寻找miR-196a的潜在作用靶点,发现miR-196a与LRIG3有潜在的结合位点。见图2。

图2 Targetscan软件预测miR-196a与LRIG3 mRNA的互补配对系列
2.3miR-196a对HCT116细胞增殖和侵袭的影响 与空白对照组比较,miR-196a inhibitor组HCT116细胞增殖率和侵袭细胞数降低;与miR-196a inhibitor组比较,miR-NC组HCT116细胞增殖率和侵袭细胞数增加(P<0.05)。见表2、图3~4。
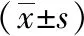
表2 miR-196a对HCT116细胞增殖和侵袭的影响

图3 miR-196a对HCT116细胞增殖的影响(MTT染色×100)A.空白对照组,B.miR-196a inhibitor组,C.miR-NC组
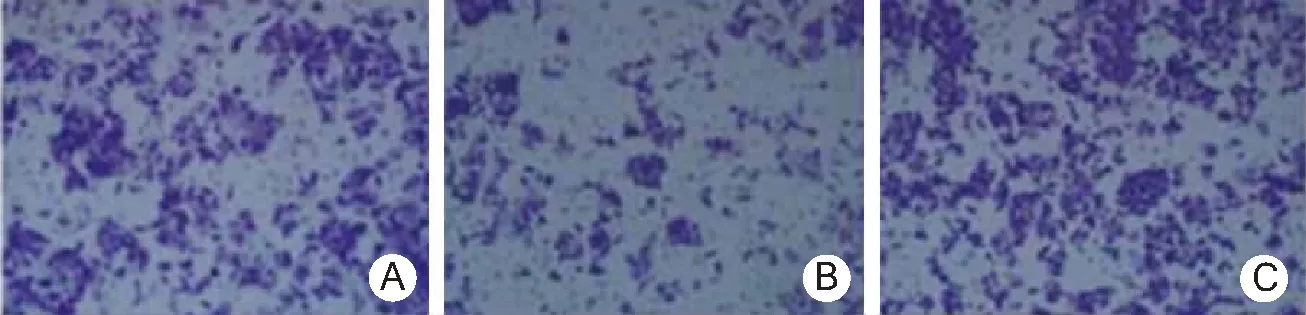
图4 miR-196a对HCT116细胞侵袭的影响(结晶紫染色×100)A.空白对照组,B.miR-196a inhibitor组,C.miR-NC组
2.4miR-196a对HCT116细胞中LRIG3、E-cadherin和N-cadherin蛋白表达的影响 与空白对照组比较,miR-196a inhibitor组HCT116细胞中LRIG3和N-cadherin蛋白表达增加,E-cadherin蛋白表达降低(P<0.05);与miR-196a inhibitor组比较,miR-NC组HCT116细胞中LRIG3和N-cadherin蛋白表达降低,E-cadherin蛋白表达增加(P<0.05)。见表3、图5。
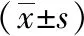
表3 miR-196a对HCT116细胞中LRIG3、E-cadherin和N-cadherin蛋白表达的影响

图5 miR-196a对HCT116细胞中LRIG3、E-cadherin和N-cadherin蛋白表达的影响A.空白对照组,B.miR-196a inhibitor组,C.miR-NC组;E-cadherin为E-钙黏蛋白,N-cadherin为N-钙黏蛋白
3 讨论
研究显示,超过50%的miRNA位于肿瘤相关基因组区域或易碎部位,对癌症的发生和发展发挥重要调控作用[7]。miR-196a最初被鉴定为一种直接靶向膜联蛋白A1,是可促进食管癌细胞增殖和抑制细胞凋亡的致癌miRNA[8]。进一步研究发现,miR-196a在口腔癌、宫颈癌、非小细胞肺癌等多种癌症组织中均有异常表达,其表达水平与癌症进展相关[9]。一项临床研究表明,miR-196a在CRC细胞中表达上调,并且通过增强CRC细胞的侵袭及对铂衍生物的敏感性而发挥促癌作用,同时其过表达加大了体内CRC的肺转移风险[10]。上皮间质转化(EMT)是一个可逆过程,在包括CRC在内的多种癌症转移过程中起重要作用。在此过程中,细胞会促进E-cadherin蛋白表达并抑制间质蛋白表达,使细胞间失去黏附性,获得迁移和侵袭能力[11]。但miR-196a在CRC转移过程中的明确调控机制尚不清楚。本研究结果显示,miR-196a在CRC组织中表达上调,且与TNM分期、肿瘤分化程度、肿瘤浸润深度和肿瘤转移相关,同时通过基因转染技术降低miR-196a表达后,靶向LRIG3调控EMT过程,最终抑制HCT116细胞增殖和侵袭。表明miR-196a参与了CRC的发生发展过程。
miRNA的关键作用是通过与靶基因3-URT的互补,对mRNA分解和(或)抑制翻译来调节靶基因表达[12]。本研究显示,miR-196a与LRIG3有潜在的结合位点。有研究通过双荧光素酶实验发现,miR-196a显著降低野生型LRIG3质粒荧光素酶活性,具有直接靶向作用[13]。同时,miR-196a过表达后可显著降低宫颈癌Hela细胞中LRIG3蛋白表达,并当miR-196a抑制剂组细胞再次转染si-LRIG3时,发现LRIG3阻断了miR-196a对宫颈癌细胞的促进作用[14]。本研究结果也显示,CRC组织中miR-196a和LRIG3 mRNA表达呈负相关。这些研究进一步证实了LRIG3是miR-196a的作用靶点。LRIG3在多种肿瘤中低表达,并与神经胶质瘤、膀胱癌和宫颈癌转移有关[15]。更重要的是,靶向LRIG3小分子抑制剂已显示出较好的抗肿瘤活性[16]。
综上,CRC组织中miR-196a表达升高,LRIG3表达降低,miR-196a表达下调导致其靶标LRIG3表达上调,进而抑制HCT116细胞增殖和侵袭。

