增强CT纹理参数评估肝细胞肝癌患者新辅助化疗预后的价值
祝令武
(商丘市长征人民医院 CT室,河南 商丘 476000)
肝细胞肝癌(hepatic cell carcinoma,HCC)是临床常见恶性肿瘤,病情隐匿性强,病死率高,需采取有效措施进行治疗。当前,新辅助化疗在HCC患者中应用广泛,可有效缩小肿块、杀灭转移细胞,利于后续手术方案的实施,可有效延长患者的生存期[1]。但是,在临床治疗过程中,仍有部分患者接受新辅助化疗后达不到预期的治疗效果,病变增大或体质下降而失去根治肿瘤的机会,预后较差。因此,采取相应措施评估HCC患者新辅助化疗后的预后情况,并采取有效措施进行干预,对改善患者预后而言具有重要意义。有研究指出,增强计算机断层扫描(computed tomography,CT)是常用的影像学检查方法,在肝脏疾病评估中已经得到广泛应用,且增强CT图像纹理分析可提供客观、定量的图像特征,可定性诊断HCC及评估HCC预后情况[2-3]。鉴于此,本研究分析增强CT纹理参数评估HCC患者新辅助化疗预后的价值。
1 资料与方法
1.1 一般资料经商丘市长征人民医院医学伦理委员会批准,选取2018年1月至2021年7月商丘市长征人民医院收治的70例HCC患者作为研究对象。纳入标准:HCC诊断符合《临床疾病诊断与疗效判断标准》[4]中诊断标准;经影像学检查以及组织病理学检查确诊;患者和(或)家属知情同意且配合研究;卡氏功能状态(Karnofsky performance status,KPS)[5]评分≥70分。排除标准:合并其他原发性恶性肿瘤或转移癌;合并心、肝、肾等器质性疾病;入组前接受相应抗肿瘤治疗;预计生存期<6个月;过敏体质。共纳入男36例,女34例;年龄40~65岁,平均(55.03±2.56)岁;肿瘤直径3~6 cm,平均(4.13±0.20)cm;体质量指数(body mass index,BMI)23~28 kg·m-2,平均(24.13±0.20)kg·m-2;16例有吸烟史,54例无吸烟史。
1.2 增强CT纹理分析患者入院后先实施CT平扫,使用飞利浦(PHILIPS)256层CT设备进行扫描,患者取仰卧位,以先足后头的方式进床,让患者深吸气后屏气直至扫描结束,扫描范围为肺底部至胸廓入口处。首先进行常规CT平扫,参数设置:管电流为280 mA,管电压为120 kV,螺距0.993,层间距为5 mm,层厚0.625 mm,矩阵为512×512,采用标准算法重建。增强扫描前使用高压注射器经肘静脉以3.0~3.5 mL·s-1速率弹丸式注射1.0 mL·kg-1碘海醇对比剂(扬子江药业集团有限公司,国药准字H20103635,规格20 mL∶6 g),在肘静脉注射对比剂后25~30 s开始增强动脉期扫描,于60~65 s开始门静脉期扫描,于3~5 min开始延迟期扫描,将所获得的图像以DICOM格式导入至3D Slicer 4.8.1软件,由经验丰富的影像科医生阅片,选择病灶的最佳层面手动勾勒出感兴趣区(regions of interest,ROI)。勾画ROI时在轴位图像上沿距离病灶内缘1~2 mm进行操作,ROI勾画面积要大于病灶的2/3,且要最大程度涵盖所有病灶,并尽量避开周围正常组织和血管,每期增强图像ROI选取的层面要对应生成ROI中所有纹理参数,采用灰度直方图和灰度共生矩阵纹理分析法,提取ROI中的偏度、能量、熵值、峰度、平均值等纹理特征参数。
1.3 新辅助化疗方案静脉注射紫杉醇注射液(Bristol-Myers Squibb S.R.L.,国药准字HJ20171227,规格5 mL∶30 mg)75 mg·m-2;静脉注射盐酸表柔比星注射液(Ebewe Pharma Ges.m.b.H.Nfg.KG,国药准字H20181178,规格5 mL∶10 mg)75 mg·m-2。每3周为1个周期,共化疗3个周期。
1.4 预后评估及分组方法在完成新辅助化疗后,依据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)[6]评估患者预后情况。完全缓解:所有病灶消失且维持4周。部分缓解:肿瘤最大径之和减少30%以上且维持4周。疾病稳定:肿瘤最大径之和减少小于50%或增加小于25%。疾病进展:肿瘤最大径之和增加大于25%,或出现1个或多个新病灶。将完全缓解和部分缓解患者纳入预后良好组,将疾病稳定和疾病进展患者纳入预后不良组。

2 结果
2.1 新辅助化疗预后情况70例HCC患者经新辅助化疗后,15例(21.43%)预后不良,55例(78.57%)预后良好。
2.2 不同预后HCC患者一般资料及增强CT纹理参数比较预后不良组患者偏度、熵值、平均值高于预后良好组,能量低于预后良好组,差异有统计学意义(P<0.05)。两组其他指标差异无统计学意义(P>0.05)。见表1。
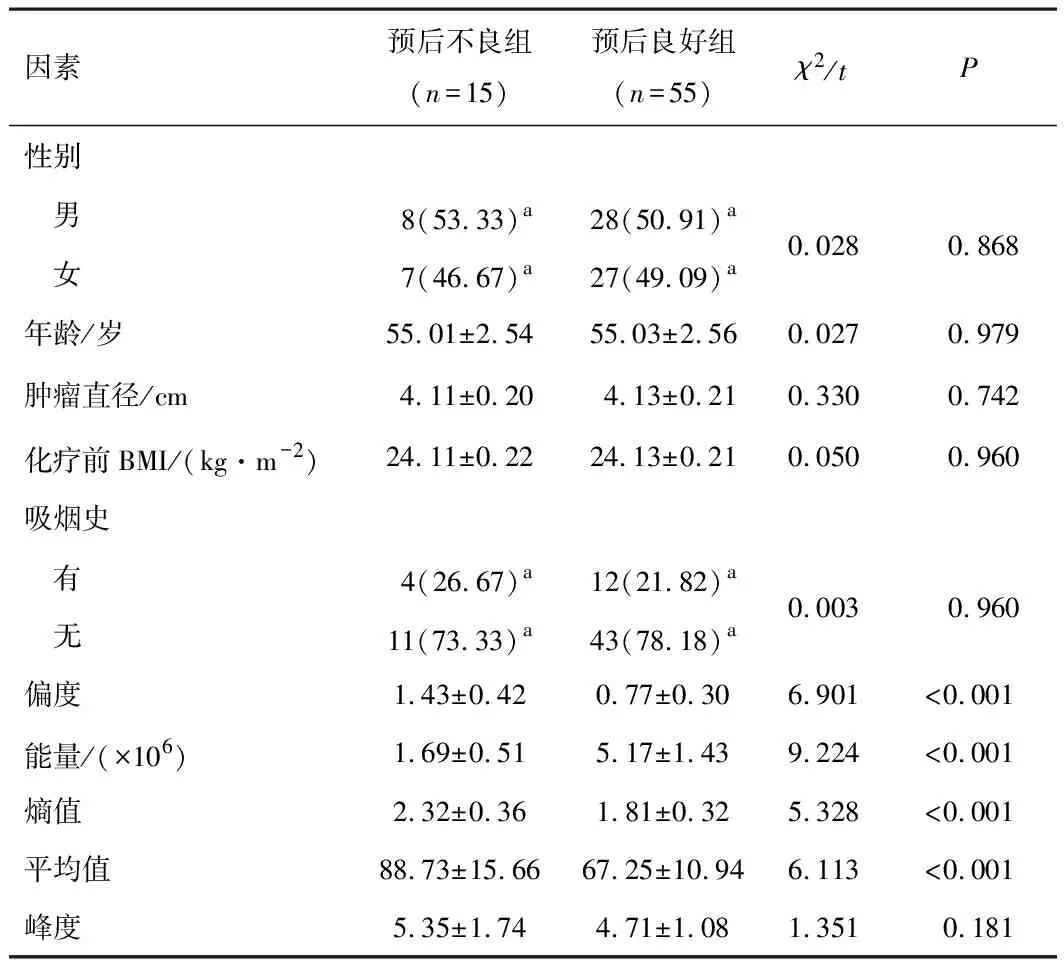
表1 不同预后HCC患者一般资料及增强CT纹理参数比较
2.3 增强CT纹理参数评估HCC患者新辅助化疗预后的效能分析将偏度、能量、熵值、平均值作为检验变量,将患者预后情况作为状态变量(预后不良=1,0=预后良好),绘制ROC曲线(见图1),结果显示,偏度、能量、熵值、平均值评估HCC患者新辅助化疗预后的AUC均>0.7,联合评估的AUC最大。见表2。

表2 增强CT纹理参数评估HCC患者新辅助化疗预后的效能分析
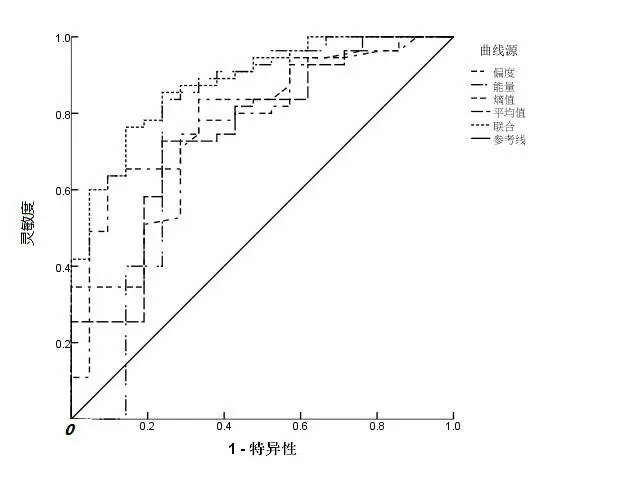
图1 各增强CT纹理参数评估HCC患者新辅助化疗
预后的ROC曲线图
3 讨论
早期HCC患者无需进行新辅助化疗,而晚期HCC患者由于失去根治肿瘤的最佳机会,临床也不建议进行新辅助化疗,处于早期与晚期肿瘤之间的HCC患者是新辅助化疗的适用人群。新辅助化疗可降低HCC患者临床分期,缩小原有病灶及灭活体内可能存在的微转移灶,有利于提高后期手术切除效果,提高患者的存活率和生活质量。但是,仍有部分HCC患者即使在接受新辅助化疗治疗后,预后也不甚理想。采取相应措施早期评估HCC患者预后情况,筛选出高危病例实施针对性干预,对改善患者预后有一定帮助。
图像纹理分析因不依赖于医生临床经验和主观因素,经定量分析图像像素灰度值空间分布及变化规律等,反映病灶内病理生理学不均质性,对判断多种肿瘤的治疗效果和患者生存状况等有一定帮助[7-8]。本研究结果显示,预后不良组患者偏度、熵值、平均值均高于预后良好患者,能量低于预后良好组患者,提示偏度、能量、熵值、平均值可作为评估HCC患者新辅助化疗预后的有效参数。有研究指出,偏度数值和病变的异质性呈正相关,而经新辅助化疗后预后良好的患者而言,预后不良的患者病灶成分仍较为复杂,肿瘤血管密度较大且血管基膜增厚较为明显,病灶的异质性更高,故偏度数值更高[9]。能量值反映的是图像灰度分布的均匀度和纹理粗细度,当图像灰度分布均匀,图像呈现出较粗的纹理,所对应的能量值越大,与恶性肿瘤病灶的异质性呈负相关[10]。化疗预后不良患者较预后良好患者而言,疾病短期进展风险大,异质性更强,故化疗预后不良患者能量纹理参数低。熵值能有效反映图像纹理的规则程度及灰度分布的随机性,熵值越高,提示图像纹理信息越随机、越复杂,与恶性肿瘤病变的异质性呈正相关[11]。新辅助化疗后预后不良的HCC患者疾病可处于短期进展状态,病灶更易出现纤维化及钙化,内部常有物质沉积,纹理分析时纹理复杂程度更高,影像学图像上主要表现为密度分布不均,因而熵值较预后良好患者大。平均值可直观反映数据离散程度,HCC新辅助化疗预后不良的患者病变组织生长快、血供相对不足,容易出现坏死、出血及脂肪变性,且病灶成分更为复杂,数据离散程度更大,因而预后不良的患者纹理参数中的平均值较预后良好者高[12]。本研究中ROC曲线显示,偏度、能量、熵值、平均值诊断HCC患者新辅助化疗预后的AUC均>0.7,表示均有一定的评估价值,且联合评估效能最好。
综上所述,偏度、能量、熵值、平均值等增强CT纹理参数均能用于有效评估HCC患者新辅助化疗预后情况,且联合评估的效能更好。

