林丹暴露诱导肝脏HepG2细胞的毒性效应研究*
段珊珊,王苑郦,杨建正,丁文军†,贺军辉
(1 中国科学院理化技术研究所 功能纳米材料实验室 微纳材料与技术研究中心, 北京 100190; 2 中国科学院大学生命科学 学院环境与健康实验室, 北京 100049; 3 中国科学院大学, 北京 100049)
中国是世界最大的农药生产国和消费国之一,有机氯农药具有高毒性、亲脂性、化学稳定性和生物富集性,曾被广泛应用于农业生产中[1]。环境与健康研究发现,有机氯农药的使用对空气、水、土壤造成了极大的污染,严重威胁生态环境和生物安全[2],现已被列入持久性有机污染物。林丹作为最常见的有机氯农药,是具有杀虫活性的六氯环己烷的γ异构体[3]。尽管林丹现已被世界各国禁用,但在环境中残留的林丹可以通过食物链富集到生物体内[4],对哺乳类动物的肝脏、生殖和发育等产生毒性效应,严重危害人类健康[5]。肝脏是哺乳动物参与外来化合物代谢的重要器官,易受到有机氯农药等环境污染物的影响,损伤线粒体功能,导致肝功能损伤[6-7]。研究发现,持续高剂量的林丹暴露引起恶心、呕吐、腹泻和抽搐等中毒症状,并导致肝脏肿大、病理损伤等毒性效应[8]。因此,阐明林丹对肝脏的毒性作用机制具有重要的生物学意义。
氧化应激是体内氧化与抗氧化作用失衡的一种生理状态,也是导致疾病的一个重要因素[9]。氧化应激在急性和慢性肝脏疾病的发生发展中发挥着重要作用[6]。在氧化应激条件下,生成的活性氧簇(reactive oxygen species,ROS)可作为功能性分子信号,参与调节细胞内各种应激信号通路,与细胞功能受损密切相关,如诱导细胞炎症反应和细胞自噬等[10]。但是,有关林丹诱导的氧化应激、炎症反应和细胞自噬的研究报道甚少。本研究旨在检测林丹诱导的肝脏HepG2细胞ROS生成、肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞1β(IL-1β)和自噬相关蛋白的表达,进一步揭示林丹诱导的细胞毒性效应。
1 材料与方法
1.1 材料
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、2′,7′-二乙酸二氯荧光素(DCFH-DA)、二氢乙啶(DHE)、二甲基亚砜(DMSO)购于Sigma-Aldrich(美国);青霉素-链霉素双抗、高糖DMEM培养基购于Gibco(美国);胎牛血清购于PAN(德国);蛋白酶抑制剂、磷酸酶抑制剂购于Bimake(美国);蛋白提取液、二喹啉甲酸(BCA)法蛋白检测试剂盒、HRP标记山羊抗小鼠IgG(H+L)、HRP标记山羊抗兔IgG(H+L)、4%多聚甲醛固定液、抗荧光淬灭封片液(含DAPI)购于碧云天(中国);乳酸脱氢酶和过氧化氢酶试剂盒购买于百奥曼(中国);Trizol试剂购于Invitrogen(美国);Alexa Fluor®594标记山羊抗小鼠IgG(H+L)购于宝亿如(中国);实时定量PCR(RT-PCR)试剂盒购于TaKaRa(日本);Triton试剂购于鼎国生物(中国);纯度为99.5%的γ-六六六购于赛普锐思(中国);人肝上皮HepG2细胞购于中国科学院上海生命科学研究院细胞资源中心。
1.2 细胞培养和暴露
HepG2细胞来源于人的肝脏组织,具有人肝细胞特有的酶活性[11],以此作为本文的研究对象。HepG2细胞(2.5×105cell/mL)培养于含有10%胎牛血清和1%青霉素-链霉素双抗的高糖DMEM培养基中,在37 ℃,5% CO2恒温培养箱(Thermo,MA,美国)中培养24 h;林丹溶解在DMSO中,实验前用DMEM稀释为1、2、5、10、20、50、100 mg/L,DMSO最终浓度低于0.25%。
1.3 细胞活力的测定
将不同浓度的林丹(1、2、5、10、20、50、100 mg/L)暴露处理HepG2细胞24 h后,每孔加入100 μL MTT(0.5 g/L),37 ℃,5% CO2恒温培养箱中再孵育2 h,弃上清液后加入100 μL DMSO溶解蓝紫色结晶甲瓒,再摇床避光孵育5 min。使用多功能酶标仪(Bio Tek,美国)在492 nm处检测各孔的吸光度。
1.4 活性氧含量的测定
采用活性氧探针荧光染料DCFH-DA/超氧阴离子探针荧光染料DHE测定细胞内活性氧/超氧阴离子的水平。HepG2细胞分别用DCFH-DA(25 μmol/L)、DHE(10 μmol/L)于37 ℃,5% CO2恒温培养箱避光培养30 min后,用PBS洗3次,各取100 μL细胞液于96孔板中,用多功能酶标仪检测荧光强度(488/525 nm)。剩余样品置-80 ℃冰箱裂解过夜,次日直接取20 μL,用BAC蛋白试剂盒检测蛋白浓度。同样的染色方法对细胞进行荧光染色,直接用荧光倒置显微镜(Olympus,日本)检测细胞的荧光强度。
1.5 RNA的提取和实时荧光定量PCR(RT-PCR)检测
使用Trizol试剂提取HepG2细胞的RNA后,再用Nano-drop(Thermo Fisher Scientific,美国)检测RNA的纯度和浓度。逆转录体系为20 μL:16 μL RNA,4 μL逆转录酶。应用PCR扩增仪(Eppendorf,德国)将RNA(4 μg)扩增为cDNA。RT-PCR仪(Stratagene,美国)检测细胞的IL-6、IL-8、IL-1β、TNF-α、NF-κB、Beclin1、ULK1mRNA表达量。RT-PCR体系为:TBGreen 10 μL,ROX 0.4 μL,上游和下游引物各0.8 μL,无核酸水6 μL,cDNA模板2 μL。PCR反应条件为:变性95 ℃、35 min;退火55 ℃、30 min;延伸72 ℃、30 min;终延伸95 ℃、15 min;循环40次。从NCBI数据库中在线搜索获得IL-6、IL-8、IL-1β、TNF-α、NF-κB、Beclin1、ULK1的mRNA序列,设计RT-PCR引物,由北京博迈德基因技术有限公司合成。IL-6、IL-8、IL-1β、TNF-α、NF-κB、Beclin1、ULK1等引物见表1。
1.6 蛋白质印迹分析(Western blot)
在蛋白提取液中加入100∶1的蛋白酶抑制剂、磷酸酶抑制剂和苯甲基磺酰氟。BCA蛋白检测试剂盒定量测定总蛋白浓度,调整样品蛋白浓度为26 μg,使用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白,将蛋白转移到聚偏氟乙烯(PVDF)膜上。用5%的Skim milk脱脂牛奶(BD,NJ,美国)封闭PVDF膜1 h,4 ℃孵育一抗(1∶1 000稀释)过夜,再用1% Tween-20,pH7.4的Tris-HCl(TBST)缓冲液反复冲洗PVDF膜3次,每次10 min。最后,用HRP标记的山羊抗小鼠IgG(H+L)和山羊抗兔IgG(H+L)(用5%脱脂牛奶1∶2 000稀释)室温孵育1 h,再用TBST缓冲液冲洗3次,每次10 min。使用增强化学发光法(ECL)检测试剂盒检测各蛋白条带强弱,全自动化学发光成像分析系统拍摄照片后,用Image J灰度分析P-p65、IL-1β、P62、LC3蛋白质的表达水平,以β-actin为内参,检测目的蛋白的表达情况。

表1 用于荧光实时定量PCR分析的引物序列Table 1 Sets of forward (F) and reverse (R) primers used in real time PCR
1.7 乳酸脱氢酶(LDH)和过氧化氢酶(CAT)的测定
按照乳酸脱氢酶和过氧化氢酶试剂盒说明书进行操作,使用紫外-可见分光光度计(Thermo,M A,美国)和多功能酶标仪(MK3, Thermo,美国)分别检测过氧化酶和乳酸脱氢酶的活性。
1.8 免疫荧光检测NF-κB在细胞中的分布情况
林丹处理细胞24 h后,弃培养基,用0.1 mol/L,pH7.2磷酸盐缓冲液(PBS)清洗3次。4%预冷多聚甲醛固定液处理细胞,常温孵育10 min,PBS清洗3次;0.1% Triton再常温孵育10 min,PBS清洗3次;3% BSA常温封闭1 h,PBS清洗3次;NF-κB抗体(1%牛血清蛋白稀释50倍)4 ℃过夜孵育细胞,PBS清洗3次;Alexa Fluor® 594标记山羊抗小鼠IgG(H+L)(3%牛血清蛋白稀释100倍)常温避光孵育1 h后,PBS清洗3次;DAPI室温避光孵育10 min,PBS清洗3次。用激光共聚焦显微镜(Zeiss,Jena,Germany)进行荧光观察。
1.9 统计学分析
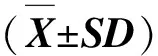
2 结果与讨论
2.1 林丹对HepG2细胞活力和LDH释放水平的影响
HepG2细胞经不同浓度的林丹暴露处理24 h后,使用MTT法检测细胞的活力。如图1(a)所示,林丹暴露质量浓度为20、50和100 mg/L时,HepG2细胞的细胞活力分别为96%、85%和49.7%,IC50值为84 mg/L。这些结果表明,随着林丹暴露浓度增加,细胞活力逐渐降低,呈浓度依赖性关系。结合现有林丹的细胞毒性和相关文献报道的实验结果[12],选择林丹质量浓度50 mg/L开展后续研究工作。此外,乳酸脱氢酶(LDH)的活性可以作为肝功能损伤的生物标志物[13],当林丹暴露处理HepG2细胞后,细胞的LDH活性增加,是对照组细胞的1.2倍,如图1(b)所示。以上结果表明,林丹暴露可以诱导HepG2细胞毒性。

林丹暴露对细胞活力(a)和细胞内LDH活性(b)的影响。*表示P<0.05,**表示P<0.01。图1 林丹对HepG2细胞活力的影响Fig.1 Effects of lindane on the HepG2 cell viability
2.2 林丹诱导HepG2细胞内活性氧(ROS)的生成
ROS与细胞生长、免疫应答及信号传递密切相关[9]。正常生理条件下,体内的ROS生成和清除处于动态平衡[14]。为评价林丹暴露是否诱导细胞内ROS生成,分别使用活性氧荧光探针DCFH-DA和超氧阴离子荧光探针DHE进行检测。当DCFH-DA进入细胞后,其被非特异性脂酶胞内裂解成二氯荧光素(DCFH),细胞内的ROS可以快速氧化DCFH为高度绿色荧光的2,7-二氯荧光素(DCF)[15],其荧光强度与细胞内ROS水平呈正比。因此,可以将其作为反映ROS生成水平的指标。超氧阴离子作为活性氧的一种,我们也检测了其含量,红色荧光强度正比于超氧阴离子的含量。图2(a)和2(b)分别显示林丹处理显著增加HepG2细胞内ROS和超氧阴离子含量,其生成水平分别是对照组的4.7倍和1.4倍,如图2(c)、2(d)所示。该结果提示,林丹暴露诱导HepG2细胞内生成大量ROS。
2.3 林丹降低HepG2细胞的抗氧化酶活性
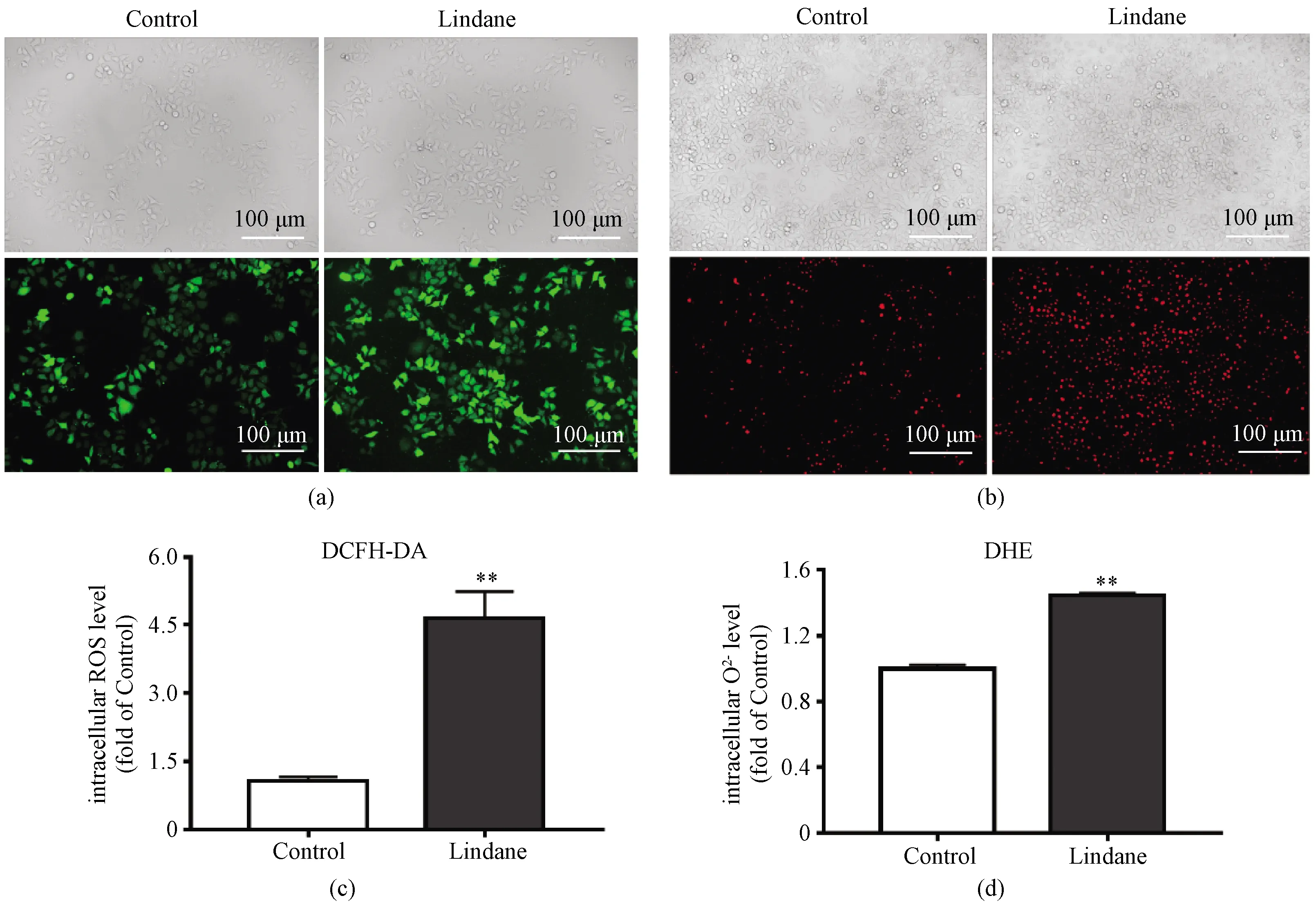
当机体受到外界环境刺激时,体内产生大量ROS,为维持生物体的正常功能,体内的氧化与抗氧化系统便会发挥作用[16]。机体依赖2类抗氧化系统清除体内过多的ROS:一类为抗氧化分子,包括维生素C、维生素E、谷胱甘肽等;另一类为抗氧化酶,包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等[17]。其中CAT是最主要的H2O2清除酶,在活性氧清除过程中具有重要的作用[18]。我们检测了林丹处理后细胞内过氧化氢酶的活性,结果表明,与对照组相比,林丹暴露组细胞的CAT活性下降27%(图3),表明HepG2细胞内抗氧化系统遭到破坏,机体的防御机制受损。过氧化氢酶活性的变化进一步证明林丹诱导HepG2细胞发生氧化应激反应。以上实验提示HepG2细胞暴露于林丹后,产生大量活性氧物种,引起氧化应激。
(a)DCFH-DA和(b)DHE染色HepG2细胞对照组和林丹暴露组的明场像(上)和荧光像(下);统计分析结果显示细胞内活性 氧水平(c)和超氧阴离子水平(d)。**表示P<0.01。图2 林丹诱导HepG2细胞的氧化应激反应Fig.2 Lindane triggers intracellular ROS generation in HepG2 cells
*表示P<0.05。图3 林丹对HepG2细胞内过氧化氢酶活性的影响Fig.3 Effect of lindane on the activity of catalase in HepG2 cells
2.4 林丹对HepG2细胞促炎细胞因子表达的影响
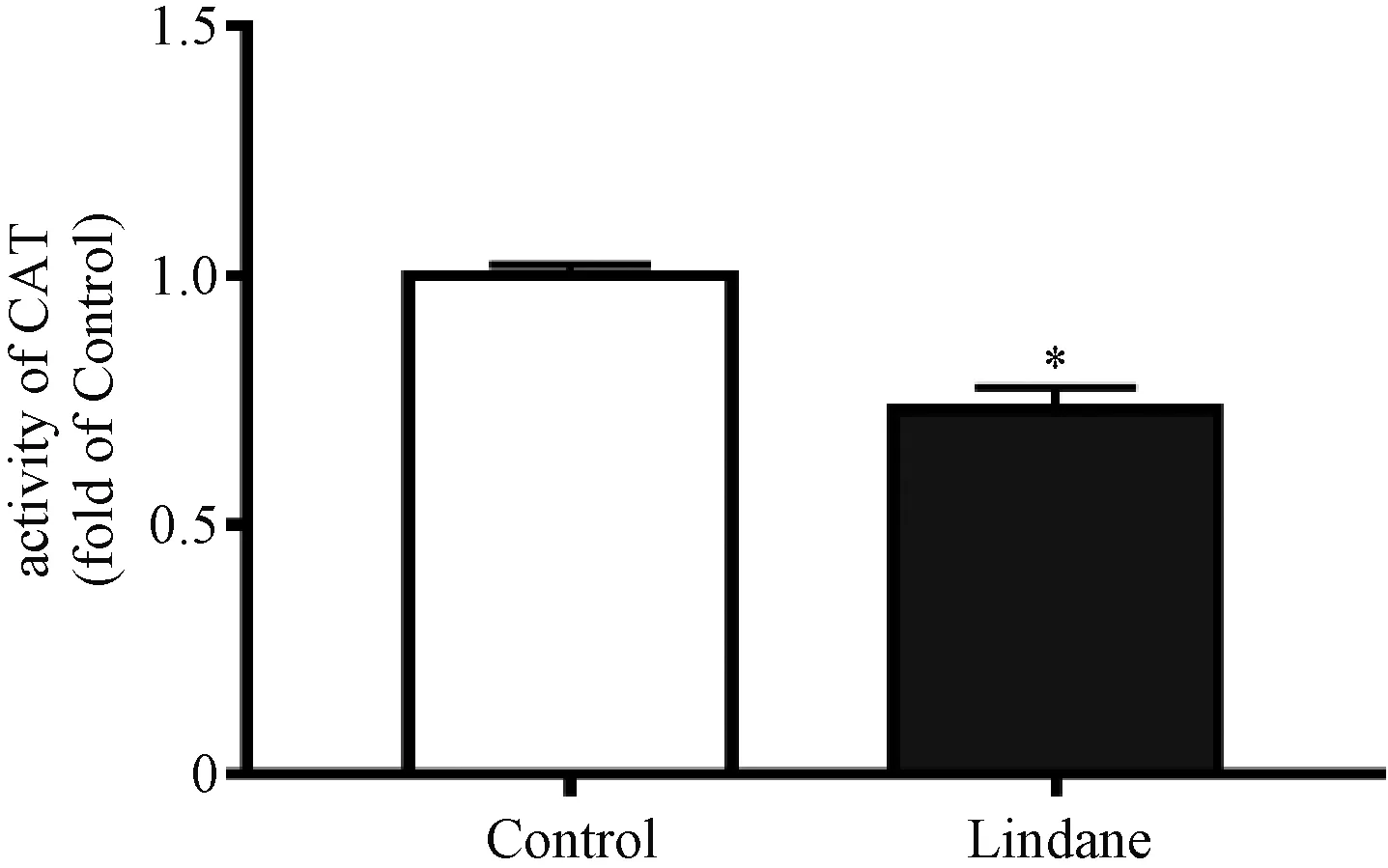
研究表明,氧化应激造成蛋白、DNA、细胞器等氧化损伤,诱导炎症反应[19]。因此,为进一步确定林丹对HepG2细胞炎症反应的影响,我们检测了相关促炎细胞因子TNF-α、IL-6、IL-1β、IL-8的表达。RT-PCR实验结果发现,林丹暴露24 h后均明显增加各促炎细胞因子表达量,其中TNF-α、IL-6、IL-1β、IL-8的mRNA表达水平分别为对照组的1.9、1.7、5.5和3.9倍(图4)。其中TNF-α作为平衡细胞稳态、存活、凋亡和坏死的调节因子,其表达量上调表明细胞稳态、存活等过程失调[20]。而IL-6作为促炎细胞因子之一,在慢性炎症中发挥关键作用,其表达量增加为慢性炎症的发展提供有利环境[21]。而这些促炎细胞因子的大量分泌,可能会导致炎症性疾病的患病风险。核因子κB(NF-κB)是一组二聚体转录因子,具有多向调节作用,在多个基因的转录与表达中发挥重要作用[22]。如图4所示,NF-κBmRNA表达量为对照组的1.5倍。表明林丹暴露后激活HepG2细胞的NF-κB,显著上调促炎细胞因子IL-6、TNF-α、IL-1β等的表达,改变细胞的促炎微环境,并诱发炎症反应[23]。
蛋白质印迹法的结果进一步验证了IL-1β蛋白的过表达,与对照组相比,林丹暴露上调IL-1β的蛋白表达量为对照组的1.9倍,如图5所示。

*表示P<0.05,**表示P<0.01。图4 林丹上调HepG2细胞的促炎细胞因子表达Fig.4 Effects of lindane on the expressions of related pro-inflammatory factors genes in HepG2 cells
*表示P<0.05。图5 林丹上调HepG2细胞炎症相关蛋白的表达Fig.5 Effects of lindane on the expressions of proteins related to inflammation in HepG2 cells
另外,实验结果表明,林丹上调了磷酸化p65(P-p65)的表达,显示林丹激活NF-κB信号通路。
2.5 林丹对HepG2细胞内NF-κB表达的影响
NF-κB被称为氧化应激敏感型转录因子,其入核后上调促炎介质表达,调节炎症反应,在维持肝脏稳态中发挥着重要作用[24]。NF-κB是P65和P50的二聚体,与IκB以三聚体非活化的状态存在于细胞质中。当细胞受到外来刺激处于氧化应激状态时,IκB蛋白磷酸化,NF-κB被激活并进入细胞核中,调控其下游蛋白的表达[22]。为探究NF-κB的表达情况,分别用红色和蓝色荧光标记NF-κB和细胞核,使用激光共聚焦显微镜进行观察。如图6结果所示,林丹暴露处理HepG2细胞24 h后,细胞核内的红色荧光强度显著增加,表明林丹诱导的NF-κB入核表达与其调控的下游促炎细胞因子表达相关,参与HepG2细胞炎症反应。

图6 林丹诱导HepG2细胞的NF-κB表达Fig.6 Lindane triggers the expression of NF-κB in HepG2 cells
2.6 林丹诱导HepG2细胞的自噬反应
ROS作为一种胞内信号分子参与细胞内的各种生化反应[25]。研究表明,氧化应激除诱导ROS生成外,还引起自噬反应,ROS作为信号分子介导细胞的自噬性死亡[26]。自噬是在各种代谢压力和外在因素刺激下的一种应激性反应,被认为是细胞自稳的保护机制。自噬发生过程中,磷脂双层膜结构可以包裹细胞内待降解的坏死细胞器等,形成自噬小体,随后与溶酶体融合形成自噬溶酶体,进一步降解包裹物用于细胞自身的代谢[27]。Beclin1、ULK1作为正向调节自噬的关键蛋白,其表达水平可作为自噬水平的指标[28]。如图7(a)所示,检测其mRNA表达水平,结果表明,与对照组相比,林丹显著上调Beclin1与ULK1的mRNA水平,分别为对照组的1.7和1.6倍。LC3蛋白作为自噬发生的特异性标志物,LC3前体蛋白在细胞内加工为可溶性LC3 Ⅰ蛋白,其被活化后,与自噬囊膜表面的磷脂酰乙醇胺结合,转化为LC3 Ⅱ,定位于前自噬体和自噬体上,因此LC3 Ⅱ的水平可以反映出自噬小体的数量[29]。图7(b)结果表明LC3 Ⅱ的表达量增加,为对照组的2.3倍。这表明林丹诱导细胞自噬小体数量增多,细胞发生自噬反应。P62作为反映自噬在溶酶体中降解活性的标志性蛋白[30]。但是,本实验的结果发现林丹升高P62的表达水平,如图7(a)和7(b)所示,提示自噬小体在溶酶体中的降解过程受到抑制。由此推测,在林丹暴露诱导HepG2细胞的自噬小体生成,但其没有与溶酶体结合。已有研究发现,细胞自噬与炎症反应二者之间存在双向的调节作用[31]。以上实验结果提示,林丹暴露诱导HepG2细胞的炎症反应和自噬生成。由此推测,在林丹暴露下自噬可以通过其细胞保护作用抑制炎症因子的释放和降低炎症反应,但其作用机制尚有待进一步的研究。

*表示P<0.05。图7 林丹上调HepG2细胞自噬相关基因及蛋白的表达Fig.7 Effects of lindane on the expressions of genes and proteins related to autophagy in HepG2 cells
3 结论
在本研究中,高浓度林丹暴露显著降低HepG2的细胞活力,诱导细胞的氧化应激、炎症反应和自噬,损伤肝细胞功能,导致细胞死亡。综上所述,林丹暴露诱导肝细胞氧化应激,增加细胞自噬水平,并激活NF-κB信号通路引起细胞的炎症反应。该结果提示林丹诱导的氧化应激在其细胞毒性中发挥着重要作用。

