β-内酰胺类药物对副猪嗜血杆菌流行病学临界值的建立及耐药性的测定
陈超群,陈佳莉,周萱仪,吴 雪,汪津丞,黄安雄,郝海红
(华中农业大学 国家兽药残留基准实验室,农业部兽药残留检测重点实验室,国家兽药安全评价实验室,农业部畜禽产品质量安全风险评估实验室(武汉),武汉 430070)
副猪嗜血杆菌病是由副猪嗜血杆菌(Haemophilusparasuis,HPS)引起猪的一种传染病,主要表现为猪的浆膜炎、关节炎和脑膜炎,也可表现为肺炎、败血症和猝死。目前该病已呈世界性分布,并严重危害养猪业。本菌具有明显的地方性,相同血清型菌株的遗传差异很大,故疫苗免疫效果并不理想,抗菌药则成了副猪嗜血杆菌病治疗的主要手段[1]。耐药性分析可为临床提供有效的抗生素治疗方案,这也是本试验制定折点判定耐药性的意义所在。
β-内酰胺类抗生素是一类广谱抗生素,分子结构中都含有β-内酰胺环,占全世界抗生素使用量的60%,是治疗传染病最有效的药物之一[2],根据它们的化学结构,β-内酰胺可分为3种类型:头孢菌素类、青霉素类和非典型β-内酰胺类。因其安全性高、成本低、抗菌效果好[3],是HPS感染的首选药物,临床上常用头孢菌素治疗,但随着广谱抗生素长期大量应用,耐药菌株和变异菌株日渐增多[4]。有研究显示,长期使用β-内酰胺类抗生素会损伤机体原有的免疫机制和菌群平衡,使患畜免疫力下降、耐药性升高,严重影响临床用药效果[5],故评价其抗菌活性,监测其耐药流行性对预防和治疗副猪嗜血杆菌病有重要意义。
传统的耐药判定标准主要分为微生物折点[6]、药效学折点和临床折点3种,用来进行耐药监测和预测药物临床治疗的有效性[7]。微生物折点的制定是通过抗菌药物的敏感性试验确定,是进行细菌耐药性监测的主要手段。而药效学折点主要是结合药物的药动学和药效学数据,科学的指导临床用药。临床折点则是根据临床上药物的治疗效果,来判断药物治疗的有效性。为了避免发生混淆,欧洲药敏试验联合委员会(EUCAST)用流行病学(或野生型)临界值代替了微生物学折点这个名词[8]。而药效学折点和临床折点也统一规范为药效学临界值和临床临界值。折点则是由这3种临界值共同决定,用于临床实验室的最终报告[9]。流行病学临界值(epidemiological cut-off values,ECOFFs)是用于区分野生型菌株和非野生型菌株的MIC值,CLSI将其定义为野生型折点(wild-type cutoff,COWT),ECOFFs更为常用,其不考虑临床效力,单纯考察细菌对药物的敏感性情况,主要目的是用于耐药性表型的流行病学监测[10]。并且由于不考虑临床因素,所以该值相对稳定,在一定时期内,通常不随样本来源及不同地区而异,即流行病学临界值在全世界范围内通用。
鉴于目前尚无确定的检测副猪嗜血杆菌抗药性的技术标准和判定标准[11],因此本课题参考CLSI中折点制作的方法,采用ECOFFinder程序分析流行病学折点,利用ScienceDirect、PubMed、NCBI、知网、百度学术等数据库汇总不同国家不同地区的副猪嗜血杆菌对β-内酰胺类药物的最低抑菌浓度(minimum inhibitory concentration,MIC),分析得到β-内酰胺类药物对副猪嗜血杆菌的流行病学临界值(ECOFF),用于指导临床合理用药。
1 材料与方法
1.1 MIC数据收集
CLSI规定:要确定COWT,需要采集与临床感染有关的各个种属的细菌,并且每个种属的细菌的数量不得少于500株。当要确定某个药物对单独一个细菌种属的 COWT时,如金黄色葡萄球菌或鲍曼氏不动杆菌等,收集的临床菌株满足100株以上就足够了。很多学者做过副猪嗜血杆菌对β-内酰胺类药物的药敏试验,但大部分试验菌株数少于CLSI规定的100株,也很少有人根据MIC结果来制定折点,且不同学者做出来的MIC结果有时相差较大。本文汇总文献里不同学者做出的MIC结果,汇总结果见表1。
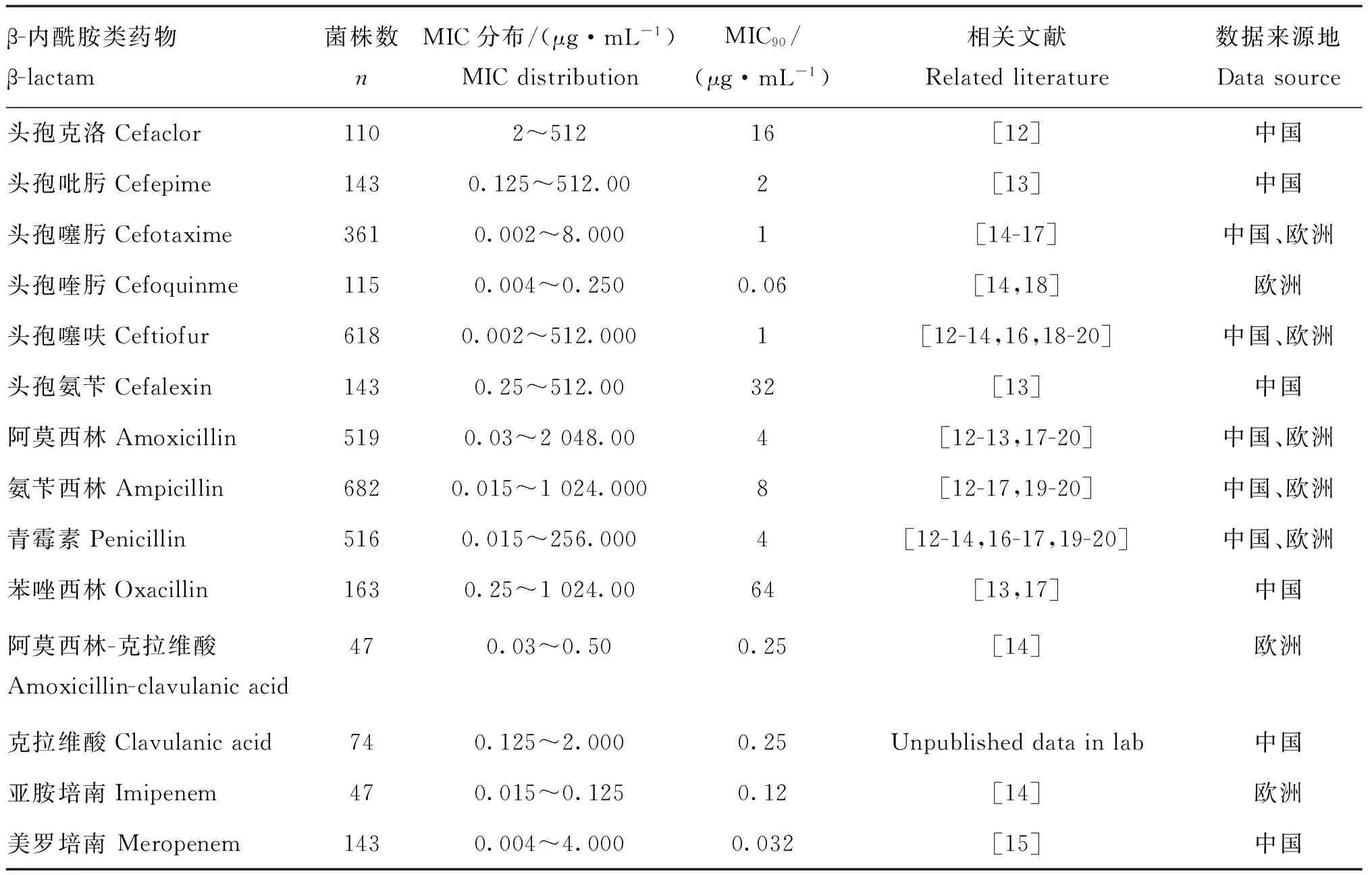
表1 副猪嗜血杆菌药敏结果汇总
1.2 绘制MIC分布图
典型的MIC分布应该是呈单峰分布或双峰分布的,左峰为野生型菌株的MIC分布范围,右峰则是非野生型菌株的MIC分布范围,若此时两峰的界限明显,那么野生型菌株的MIC分布上限值,即是其流行病学折点[21]。如Turnidge和Paterson[22]所做的金黄色葡萄球菌-万古霉素的MIC分布图,呈典型的单峰分布,大肠杆菌-氨苄西林的MIC分布图则呈双峰分布(图1)。而某些情况下,例如菌株MIC分布连续,双峰分布不明显或双峰重叠,由于肉眼观察法受主观因素的影响较大,就难以确定此时的流行病学折点,这种情况则需采用统计学方法分析。
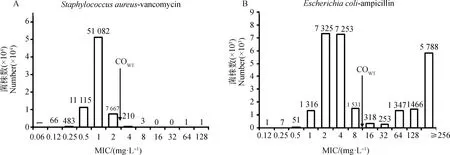
A.金黄色葡萄球菌-万古霉素的MIC分布图,呈典型的单峰分布;B.大肠杆菌-氨苄西林的MIC分布图,呈双峰分布。图片引用自:John Turnidge:Setting and revising antibacterial susceptibility breakpoints
1.3 ECOFFs的测定
Turnidge和Paterson[22]使用非线性回归分析的方法成功确定了多种药物对不同细菌的ECOFFs,并表示该方法能够较好地模拟菌株的MIC分布,有助于流行病学折点的建立,并利用Microsoft excel的宏功能,制作出了能够根据菌株的MIC分布,自动拟合并计算出菌株的流行病学折点的程序ECOFFinder。其原理也是根据菌株MIC分布,利用非线性回归分析的方法对累积分布进行拟合。与传统的统计学方法分析相比,该程序更为简单和实用。
1.4 耐药率的统计
根据ECOFFinder计算出的流行病学临界值来统计本篇汇总的菌株总数里出现耐药性的菌株所占的比例,可以初步反映副猪嗜血杆菌对β-内酰胺类药物的耐药情况,为日后的耐药监测和真正的敏感性折点的建立提供一定的数据基础和科学依据。
1.5 耐药机制的分析
HPS耐药性的机制近几年来不断被学者研究,新的耐药机制不断被报道,HPS耐药性产生的原因可能与药物作用靶位的改变有关[23]。青霉素结合蛋白(penicillin-binding proteins,PBPs)是β-内酰胺类抗生素的结合位点[24]。多种革兰阴性菌中PBPs发生改变将导致其对β-内酰胺类抗生素产生耐药性[25]。对92株HPS临床分离菌的青霉素结合蛋白PBPs进行基因克隆和测序,发现A类PBPsmrcA基因的3个突变位点和pbplB基因的5个突变位点可能改变了该蛋白与β-内酰胺类抗生素的结合能力,从而降低了HPS对β-内酰胺类抗生素的敏感性。推测B类PBPsftsI和ftsI-2基因的突变位点降低了肽基转移酶与β-内酰胺类抗生素的结合能力;prc基因存在14个突变位点,影响了蛋白酶的活性,间接影响了PBPs的合成,从而对β-内酰胺类抗生素不敏感。在低分子量PBPs中,dacA基因有4个突变位点,dacB基因有2个突变位点,发现这些突变位点可以降低PBPS与β-内酰胺类抗菌药的结合能力[26]。此外,生物被膜的形成也与耐药性的产生有关,Zhang等[27]对110株HPS进行研究发现,有73株菌有生物膜形成,对8种抗生素如青霉素、氨苄青霉素、阿莫西林等进行药敏试验证明了有生物膜比无生物膜菌株耐药率更高。Feng等[28]通过测定临床分离的HPS以及acrB/acrR突变体对多种抗菌药的药敏试验,发现acrB外排泵可以抵抗各种有毒化合物,包括抗菌药物。另外,耐药质粒介导的耐药基因在多重耐药菌株间传播转移可能是细菌多重耐药性产生的原因[29],Moleres等[30]发现了新型blaROB-1质粒,可以抵抗β-内酰胺类药物,并命名为pJMA-1,试验证明此耐药基因可以转移到其他细菌中。具有耐药性的菌株即为非野生型菌株,其MIC应当大于折点值,因此,将其他学者研究得出的耐药菌株的MIC与本文所制定的折点比较可以验证制定的折点是否合理真实。
2 结 果
2.1 MIC分布图和拟合图
将数据输入到ECOFFinder程序中,可绘制出MIC原始数据分布直方图及原始MIC分布数据趋势线(三角形),利用非线性回归分析的方法对累积分布进行拟合,得出一条拟合曲线(矩形),将14种β-内酰胺类药物分为青霉素类药物(图2)、头孢菌素类药物(图3)、碳青霉烯类和β-内酰胺酶抑制剂药物(图4)。通过绘制14种药物对副猪嗜血杆菌的MIC分布直方图,可以看出菌株的MIC分布范围较为广泛,除头孢氨苄和青霉素呈现较为典型的单峰分布外,其余都成双峰或多峰分布,以第一个峰为界,其余峰视为非野生型菌株。有些峰和峰之间的界限不明显或两峰有重叠部分,无法用肉眼判断临界值,可以用ECOFFinder软件计算得出ECOFFs。
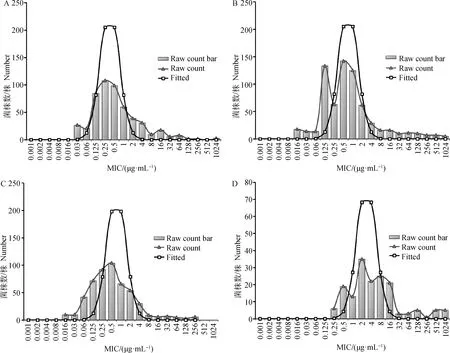
A.阿莫西林;B.氨苄西林;C.青霉素;D.苯唑西林。横坐标为最小抑菌浓度MIC,纵坐标为各MIC对应的菌株数量。柱状图为原始MIC分布峰,三角形代表的曲线为原始MIC分布数据趋势线;矩形代表的曲线为ECOFFinder软件统计分析后的拟合趋势线
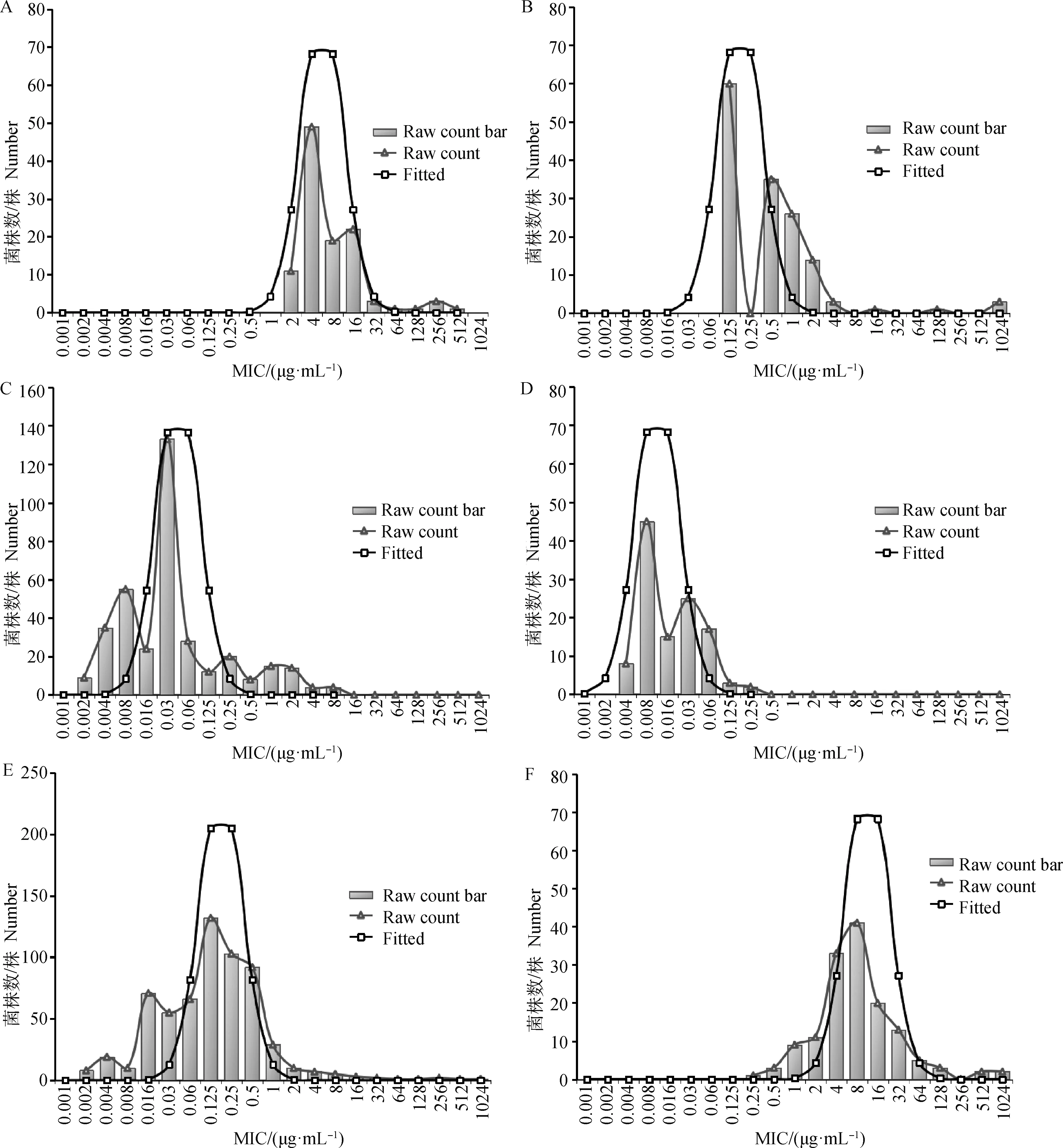
A.头孢克洛;B.头孢吡肟;C.头孢噻肟;D.头孢喹肟;E.头孢噻呋;F.头孢氨苄。横坐标为最小抑菌浓度MIC,纵坐标为各MIC对应的菌株数量。柱状图为原始MIC分布峰,三角形对应的曲线为原始MIC分布数据趋势线;矩形代表的曲线为ECOFFinder软件统计分析后的拟合趋势线
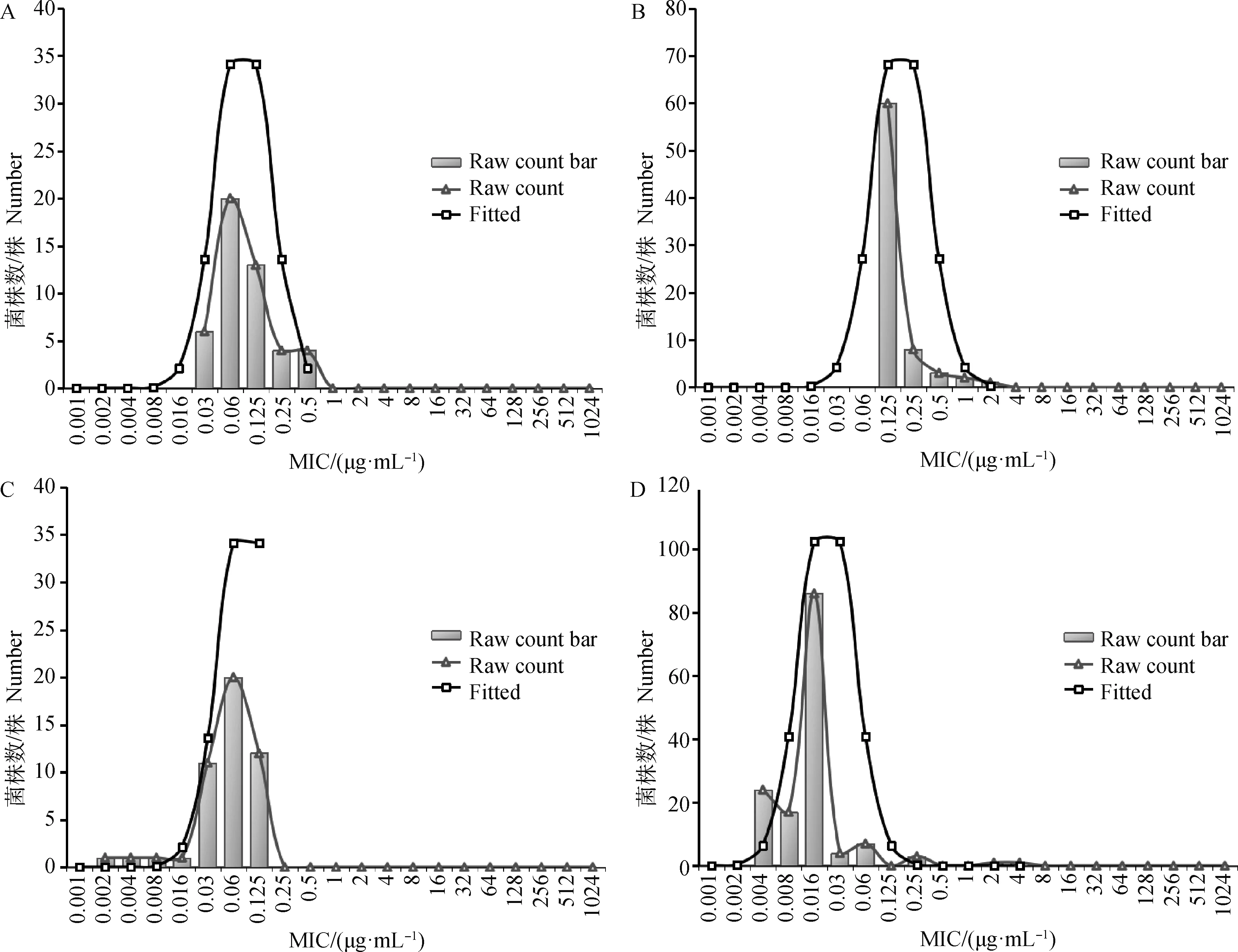
A.阿莫西林-克拉维酸;B.克拉维酸;C.亚胺培南;D.美罗培南。横坐标为最小抑菌浓度MIC,纵坐标为各MIC对应的菌株数量。柱状图为原始MIC分布峰,三角形代表的曲线为原始MIC分布数据趋势线;矩形代表的曲线为ECOFFinder软件统计分析后的拟合趋势线
根据分布拟合图可以看出氨苄西林和苯唑西林呈双峰和三峰分布,且峰与峰之间存在重叠,阿莫西林和青霉素呈不典型的单峰分布,根据软件拟合的分布曲线可估计ECOFF值分别为4和8 μg·mL-1。
HPS对头孢类药物的MIC分布图大多呈多峰分布,用肉眼观察法都比较难确定ECOFF值,需要用ECOFFinder确定。
阿莫西林-克拉维酸和亚胺培南呈比较好的单峰分布,而克拉维酸由于汇总菌株较少,使得原始MIC分布图不完整,肉眼无法判断临界值。
2.2 ECOFFs值
将数据输入到ECOFFinder程序中可计算出ECOFF值(表2)。
ECOFFinder软件可以根据菌株的MIC分布,自动计算出不同置信区间下的ECOFF值,表2的ECOFF数据可以快速地识别非野生型菌株的出现,头孢氨苄的ECOFF值最大,头孢喹肟的ECOFF值最小。
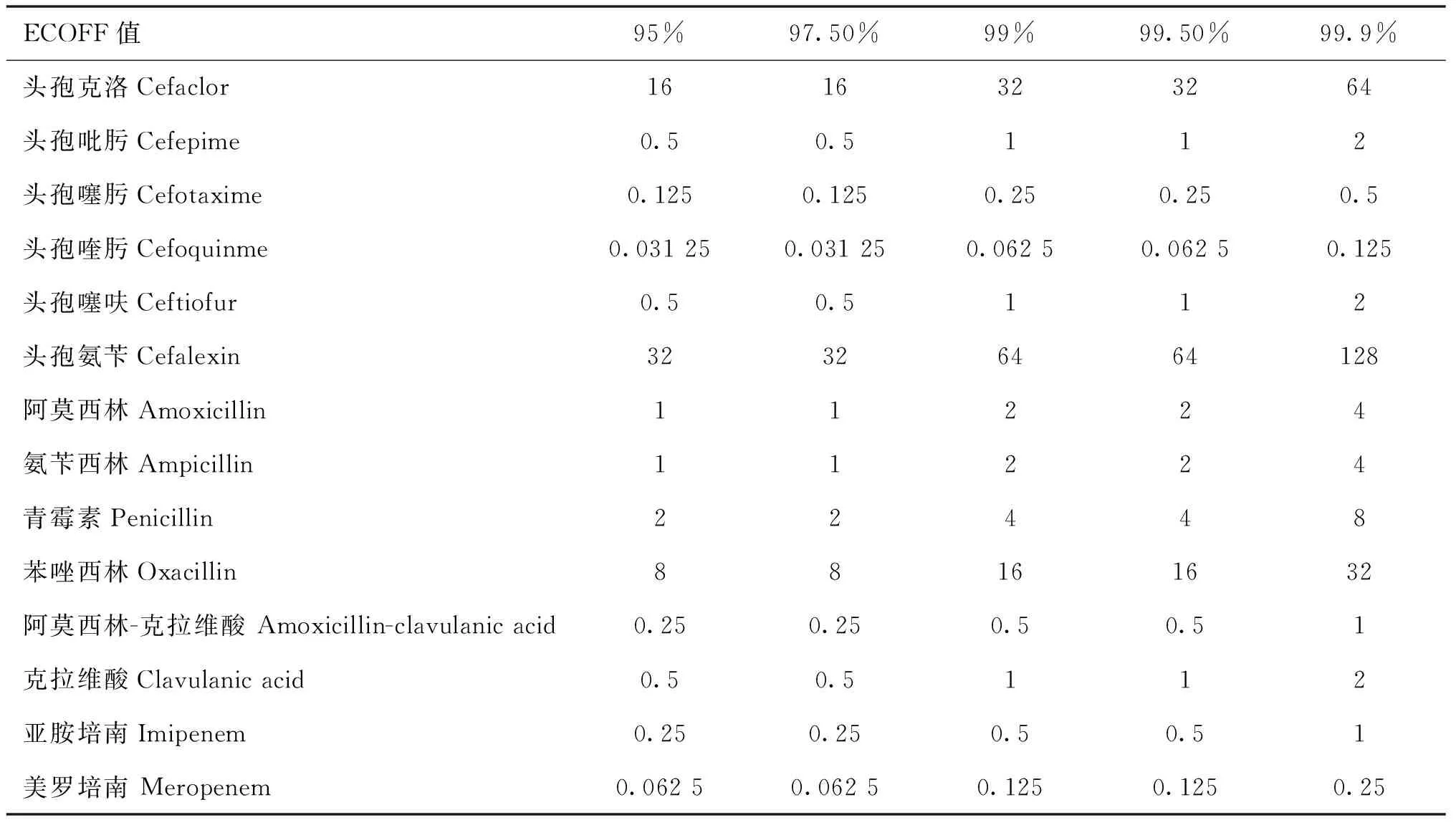
表2 14种药物对副猪嗜血杆菌的ECOFF值
2.3 耐药率的计算
根据ECOFFinder计算得出的以99%为置信度的ECOFF值作为判定菌株耐药的标准来计算汇总菌株中的耐药率,结果见表3。
表3可以直观地反映出国内外的HPS对β-内酰胺类药物的耐药情况,氨苄西林的耐药率最高,亚胺培南和阿莫西林-克拉维酸的耐药率最低,阿莫西林和青霉素的国内外差异较大,氨苄西林的国内外耐药率相近。
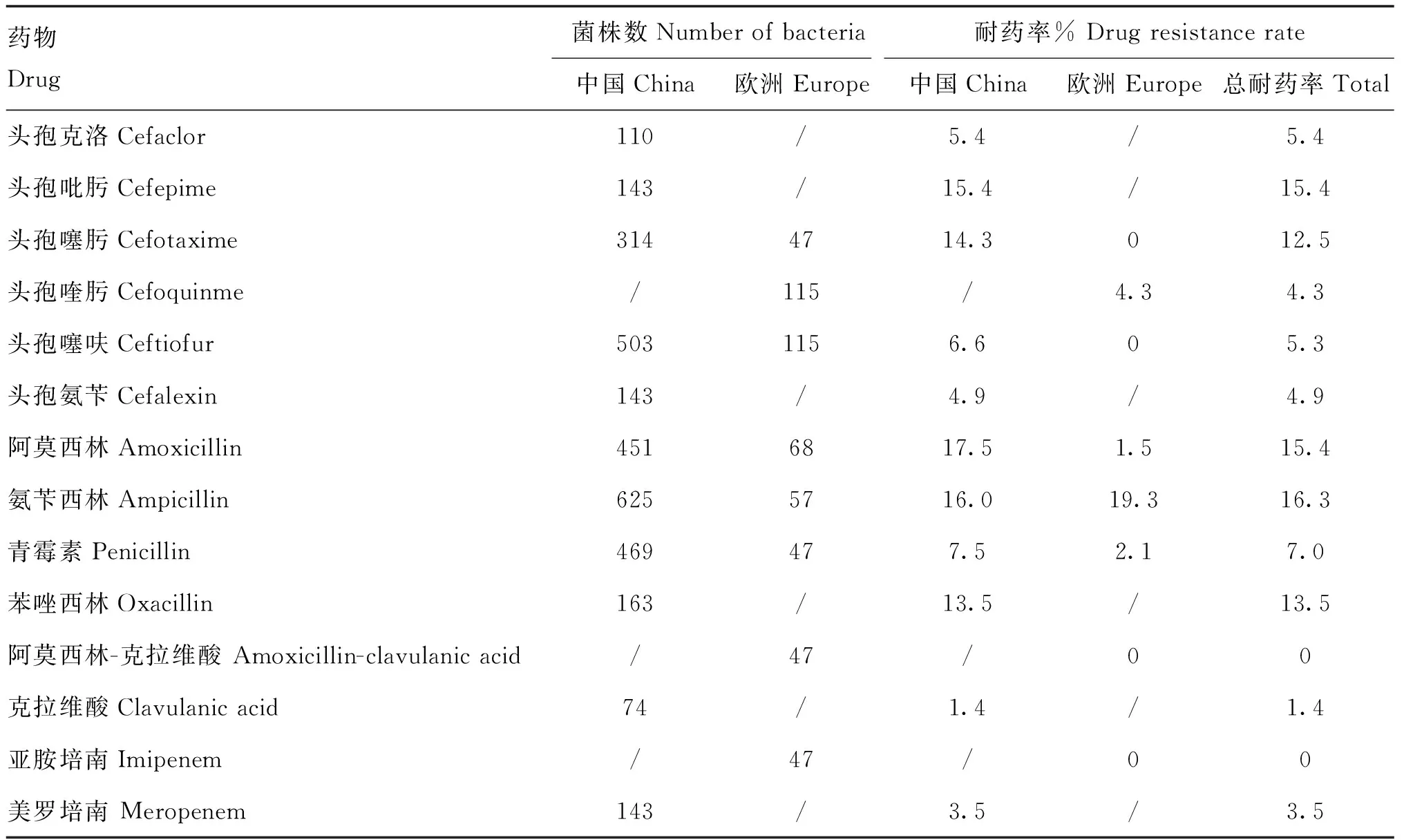
表3 副猪嗜血杆菌的耐药率(以99%ECOFF值为临界值)
3 讨 论
3.1 研究方法的可行性
根据CLSI推荐,用ECOFFinder程序分析得出了β-内酰胺类药物14种抗生素的流行病学折点。在国内,傅嘉莉[21]用函数统计学方法和ECOFFinder方法分别对363株鸡呼吸道源大肠杆菌的MIC进行分析,得出两种方法分析得到的流行病学折点一致,雷志鑫[31]在制定泰地罗新对副猪嗜血杆菌的ECOFFs时验证了ECOFFinder方法的可行性,表明该软件计算结果可靠,更加方便快捷,推荐使用。在国外,Baron等[32]用“Turnidge方法”和“Kronvall方法”(即ECOFFInder电子表格方法)计算了气单胞菌对14种抗菌药物的流行病学折点,结果完全一致或仅有一个稀释度的差异。Cantón等[33]分析发现,使用不同方法所制定的ECOFFs大致相同。说明Turnidge和Paterson[22]的统计学方法分析和ECOFFinder程序分析对于流行病学折点的建立都是可行的。
3.2 药敏试验结果比较
本研究计算得出的阿莫西林的MIC50和MIC90与Zhou等[12]获得的相同,与张悦[20]计算得出的结果也一致,MIC90较汪清峰[19]做的44株菌的结果相比偏高了1个稀释度,分析原因可能是因为汪清峰所做菌株数较少,所以有一定的偏差。对于青霉素,本研究汇总516株菌后计算得出的MIC50为0.5 μg·mL-1,MIC90为4 μg·mL-1,吴佳琪[16]和张悦[20]关于青霉素的结果一致,MIC50为0.5 μg·mL-1,MIC90为1 μg·mL-1,但是Zhao等[13]从中国各地区共分离143株菌后做出来的药敏结果显示MIC50为1 μg·mL-1,MIC90为256 μg·mL-1,分析原因是张悦分离的菌株是上海地区的,吴佳琪[16]分离的菌株是广州的,Zhao等[13]所用菌株是从中国东南西北中部各个地区分离得到的。不同地区分离株的药敏结果差异较大,这也说明了本研究汇总不同来源的菌株药敏试验结果的工作具有重要意义,制定的折点也更具有代表性和说服力,同时也反映了随着青霉素在临床上的持续应用,副猪嗜血杆菌的敏感性也随之降低。
3.3 ECOFFs值比较
由于CLSI和EUCAST并未对副猪嗜血杆菌的流行病学折点制定标准,在相关文献中也很少有研究β-内酰胺类药物对副猪嗜血杆菌的ECOFFs,因此在这里参考CLSI中对副流感嗜血杆菌制定的标准来对比本研究制定的折点值。EUCAST建议,不低于99.0%的ECOFF可能更准确,因为它更倾向于在野生型菌株的上端考虑临界值,将更多的野生型菌株包含在制定的野生型范围内。本研究制定的氨苄西林的99.9%ECOFF为4 μg·mL-1,与CLSI中制定的判定副流感嗜血杆菌耐药的标准值≥ 4 μg·mL-1结果一致。根据CLSI的解释,氨苄西林的药敏结果能用于预测阿莫西林的敏感性,所以制定的氨苄西林的99.9%ECOFF为4 μg·mL-1也符合标准。CLSI中对头孢克洛的耐药范围作出了规定,即≥32 μg·mL-1,与本研究制定的头孢克洛99.9%ECOFF相似,本研究制定的阿莫西林/克拉维酸的99.9%ECOFF为1 μg·mL-1,比CLSI中制定的耐药标准低2个稀释度,分析原因可能是本研究汇总的菌株数较少。在亚胺培南、克拉维酸和阿莫西林/克拉维酸的折点制定过程中,汇总的菌株数少于CLSI建议的100个分离株,但都多于建议的最少30个分离株形成高斯分布的建议数量,因此对亚胺培南、克拉维酸和阿莫西林/克拉维酸制定的ECOFFs可能会存在偏差,但是在CLSI未制定标准时也有一定的参考价值,头孢噻肟参考CLSI有关胸膜肺炎与睡眠嗜血杆菌的标准[34],即耐药菌株MIC≥4 μg·mL-1,而本文制定的99.9%ECOFF为0.5 μg·mL-1,相差了3个稀释度,推测原因可能是HPS与胸膜肺炎和睡眠嗜血杆菌存在一定的差异,耐药判定标准不能完全适用。其余的β-内酰胺类药物在CLSI中并未有标准可以参考。整体来看,本研究制定的流行病学折点是有科学依据和一定参考价值的。
3.4 耐药率比较
根据本研究得出的折点计算汇总菌株总的耐药率发现HPS对氨苄西林、阿莫西林以及头孢吡肟出现了较高的耐药性,分别为16.3%、15.4%、15.4%,而对亚胺培南、阿莫西林-克拉维酸以及克拉维酸的耐药率则处于较低水平。由于本研究汇总的国外菌株数较少,大多菌株都是来自国内不同地区(如上海、广州等地),因此国内外的耐药率存在较大偏差。近年来的研究发现,全国各地的副猪嗜血杆菌对大多数药物都产生了不同程度的耐药性,从2013—2019年,贵州分离株对头孢噻呋的耐药率提高了324.68%,对青霉素的耐药率上升了8.25%,对阿莫西林的耐药率上升了4.76%[35]。西班牙和英国分离菌株对头孢噻肟和头孢噻呋的敏感率均为90%以上[36];我国各地临床分离菌株对氨苄西林、头孢噻呋、头孢喹肟的耐药率分别为39.4%、5.8%和1.9%[37]。我国广东分离菌株对头孢噻呋和头孢噻肟均表现出较好的敏感性,对氨苄西林的耐药率为22.1%[38]。以上研究均表明副猪嗜血杆菌对β-内酰胺类抗生素较为敏感,但随着药物的不合理使用,使得β-内酰胺类药物已经出现不同程度的耐药性。
3.5 耐药机制的反馈验证
同时,耐药菌株的MIC值应当大于制定的折点值,万锈琳[39]对1株多重耐药副猪嗜血杆菌(HPS-1)与敏感菌株(HPS-2)进行比较发现,HPS-1由于含有blaROB-1特异耐药基因导致HPS-1对β-内酰胺类药物产生耐药性,而HPS-1对苯唑西林的MIC为256 μg·mL-1,大于本文制定的折点值8 μg·mL-1,HPS-2对苯唑西林的MIC为2 μg·mL-1,在野生型菌株的MIC范围内,符合本文制定的ECOFF。Zhao等[13]对生物被膜阳性和生物被膜阴性的HPS进行比较发现,生物被膜阳性的HPS对头孢氨苄、头孢吡肟、头孢噻夫和氨苄西林的MIC范围大于512 μg·mL-1,对阿莫西林的MIC为0.25~64.00 μg·mL-1,也基本符合本文制定的判定标准。制定的头孢克洛的折点为16 μg·mL-1,Millan等[40]发现所有耐β-内酰胺类药物的副猪嗜血杆菌对头孢克洛都有很高的抗性,MIC>16 μg·mL-1,也进一步说明了本文制定的耐药判定标准合理有效。
4 结 论
目前,CLSI和EUCAST都未对HPS制定耐药判定标准,本文汇总了前人的研究数据,采取了科学有效的折点制定方法,制定了14种β-内酰胺类药物的ECOFFs,并对比了CLSI中副流血嗜血杆菌的耐药判定标准来验证本研究制定折点的合理性。根据所制定的野生型折点计算所汇总菌株里的耐药率,可以识别非野生型菌株的出现,有利于耐药性监测工作的开展。本课题头孢吡肟、苯唑西林、氨苄西林以及阿莫西林的耐药率较高。有些单峰分布或双峰分布界限明显的MIC分布图可以较为直观地帮助肉眼判断非野生型菌株,如亚胺培南、青霉素。在这项研究中获得的折点值不应视为官方解释标准,复杂的环境变化和细菌的不断突变要求人们使用多种多样的分离株来提供更精确的估算值,不断更新ECOFFs来监测细菌的耐药性,指导临床合理用药。

