神经介素B及其受体NMBR参与抗A型流感病毒H1N1亚型感染的信号通路
唐梦瑶,马逸杰,田世茂,万乾晖,杨桂红
(福建农林大学动物科学学院(蜂学学院)闽台动物病原生物学重点实验室,福州 350002)
A型流感病毒(influenza A virus, IAV)属于正黏病毒科流感病毒属的单股负链RNA病毒,其可通过空气传播引起多种动物的急性上呼吸道感染和急性肺炎导致动物死亡[1-5]。IAV基因组含8个片段,共编码18种蛋白[6-8],这种分节段的形式使得A型流感病毒在传播过程中易受疫苗免疫或药物选择压力而产生基因重组或氨基酸位点突变,导致原有的疫苗免疫失败和新的耐药毒株的产生,使流感疫情防控形势日趋严峻,严重威胁着动物的生命和我国养殖业的健康发展[9-13]。相对于流感病毒的高度变异性,宿主的抗病毒因子比较保守,以禽流感病毒-宿主蛋白的相互作用为突破口,通过调控宿主因子的抗病毒作用达到阻止病毒入侵的目的[14-17],为筛选新型抗流感药物提供重要思路。
神经介素B(neuromedin B, NMB)是一种含有32个氨基酸的生物活性肽[18-24],可通过结合其特异性受体参与机体的多种生物学功能[25-30]。本课题组前期研究发现,IAV/H1N1/PR8亚型毒株感染宿主后会诱导NMB和NMBR表达出现显著上升,并且NMB/NMBR通过调节PR8感染诱导的IL-6和IFN-α表达而抑制PR8在小鼠体内的复制[31]。以上研究结果表明, NMB/NMBR是机体发挥抗IAV/H1N1感染的先天性免疫应答系统的重要组成部分,但关于其抗IAV/H1N1感染的作用机制尚不清楚。因此,本研究从体内和体外水平分别探索了介导NMB抗IAV感染的重要分子细节,以期揭露可能介导NMB发挥抗IAV/H1N1感染的信号途径,从而为临床研制新型的抗IAV药物提供更充足的理论基础。
1 材料与方法
1.1 主要试验材料
MLE-12传代细胞(小鼠肺泡上皮细胞)为本实验室保存;A型流感病毒株:A/PR/8/34(H1N1)和A/WSN/33(H1N1)均为本实验室保存经典模式毒株;SPF级野生型C57BL/6 J品系小鼠(18 g±2 g)购自上海吴氏实验动物;NucleoZol RNA提取试剂购自上海基因生物技术国际贸易有限公司;RNA反转录cDNA试剂盒(货号:E047)购自上海近岸科技有限公司;Anti-GAPDH(货号:HC301-01)购自TransGen biotech公司;Anti-NP 由本实验室制备并保存;Anti-NMBR(货号:ab134141)购自Abcam公司;Anti-NMB(货号:ER60923)购自杭州华安生物技术公司;Anti-IκBα(货号:sc-1643)购自Santa Cruz Biotechnology公司;Anti-P65(货号:D14E12)、Anti-p-P65(货号:93H1)购自Cell Signaling Technology公司;兔抗鼠、鼠抗兔二抗购自Jackson Immunoresearch公司,NF-κB抑制剂BAY11-7028(货号:SF0011-10 mM)购自上海碧云天生物技术有限公司; 普通PCR仪、电泳凝胶成像仪购自美国伯乐公司;荧光定量LightCycler 96 PCR仪购自罗氏公司;细胞恒温培养箱购自日本三洋公司;倒置显微镜购自上海尼康仪器有限公司;化学发光仪购自美国ProteinSimple公司。
1.2 方法
1.2.1 细胞复苏 细胞冻存管置于37 ℃水浴锅内快速解冻,取冻存管中的细胞至15 mL离心管中和2 mL完全培养基混匀,800 r·min-1离心5 min,弃上清,加入1 mL完全培养基重悬细胞沉淀,转移到含有7 mL完全培养基的培养皿中轻轻摇匀,置于37 ℃,5% CO2细胞培养箱中培养。
1.2.2 BAY11-7028处理PR8或WSN感染MLE-12细胞 为研究NMB发挥抗IAV感染的天然免疫反应是否与NF-κB信号通路关联,分别用10 μL PR8(PFU=6.5×106)或10 μL WSN(PFU=1.3×107)感染MLE-12细胞后,添加1 μL 10 μmol·L-1NF-κB抑制剂BAY11-7028,分析NF-κB信号通路是否影响NMB/NMBR对IAV/H1 N1感染的调节作用。试验分为4组:①对照组;②对照组+BAY11-7028;③攻毒组;④攻毒组+BAY11-7028,每组重复6个孔。攻毒15 h后收取RNA样和蛋白样,通过RT-PCR和qRT-PCR检测MLE-12细胞中NMB、NMBR、IL-6和IFN-α以及病毒NP基因表达变化,Western blot检测MLE-12细胞中NMB、NMBR、P65/p-P65、IκBα以及病毒NP蛋白表达水平变化。
1.2.3 NMB和BAY11-7028共处理PR8或WSN感染MLE-12细胞 为探究抑制NF-κB信号通路后是否影响NMB对PR8或WSN感染的MLE-12细胞中IL-6和IFN-α以及病毒NP基因表达的调控,分别用10 μL PR8(PFU=6.5×106)或10 μL WSN(PFU=1.3×107)感染MLE-12细胞后添加外源性1 μL 1 nmol·L-1NMB和1 μL 10 μmol·L-1NF-κB抑制剂BAY11-7028。试验分为5组:①对照组;②攻毒组;③攻毒+NMB组;④攻毒+BAY11-7028组;⑤攻毒+BAY11-7028+NMB组,每组重复6个孔。攻毒15 h后收取RNA样,通过qRT-PCR检测MLE-12细胞中IL-6、IFN-α和病毒NP基因表达变化。
1.2.4 NMB对PR8或WSN感染诱导小鼠体内NF-κB信号通路的影响 为进一步探究NMB对IAV感染小鼠体内NF-κB信号通路的影响,选取6~8周龄(18 g±2 g)SPF级野生型C57小鼠,分别用100 μL PR8(PFU=6.5×106)或100 μL WSN(PFU=1.3×107)滴鼻感染,12 h后腿部肌肉分别注射100 μL 1 nmol·L-1NMB或100 μL 1 nmol·L-1NMBRA。试验分为6组:①对照组;②对照组+NMB;③对照组+NMB+NMBR拮抗剂(NMBRA);④攻毒组;⑤攻毒组+NMB;⑥攻毒组+NMB+NMBRA,每组6只小鼠。攻毒96 h后取小鼠肺组织分别称50 mg提取RNA和蛋白,通过RT-PCR和qRT-PCR检测IL-6、IFN-α和病毒NP基因表达变化,Western blot分析P65/p-P65、IκBα和病毒NP蛋白表达水平变化。
1.2.5 RT-PCR和qRT-PCR 按照NucleoZol 总RNA提取试剂说明书提取各组样品总RNA,然后根据RNA反转录试剂盒说明书合成cDNA。使用NCBI数据库在线引物设计工具Primer-BLAST设计引物,具体引物序列见表1。RT-PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55~60 ℃ 30 s,72 ℃ 30 s,共25~35个循环;72 ℃ 10 min。反应结束后,取PCR扩增产物10 μL 经1.5%琼脂糖凝胶电泳分析目的条带。qRT-PCR反应条件:94 ℃ 30 s;94 ℃ 5 s,62 ℃ 15 s,72 ℃ 10 s,共40个循环;72 ℃ 30 s;反应结束后,对数据结果进行统计分析。

表1 RT-PCR 和qPCR引物
1.2.6 Western blot(WB) 提取MLE-12细胞和小鼠肺组织样品蛋白,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白后转移到硝酸纤维素(NC)膜上;将(NC)膜置于5%牛奶中封闭2 h,1×TBS中漂洗干净,一抗孵育2~3 h,再用1× TBS中漂洗30 min(每隔10 min换一次TBS),二抗孵育2 h,再次用1×TBS中漂洗30 min(每隔10 min换1次TBS),化学发光仪曝光。
1.3 统计学分析
以上相关试验均进行3次以上独立重复试验,运用T检验进行统计分析差异显著性。其中*.P<0.05 表示差异显著;**.P<0.01表示差异极显著。
2 结 果
2.1 BAY11-7028对PR8或WSN感染MLE-12细胞中相关基因转录水平的影响
通过RT-PCR和qRT-PCR检测各组细胞中NMB、NMBR、IL-6、IFN-α和NP基因转录水平的差异。结果显示,BAY11-7028可诱导PR8感染的MLE-12细胞中NMB、NMBR、IL-6和IFN-α 基因表达水平均有所下降,NP表达水平有所上升(图1),其中NMB显著下降(P<0.05),NMBR、IL-6和IFN-α极显著下降(P<0.01),NP极显著上升(P<0.01)。
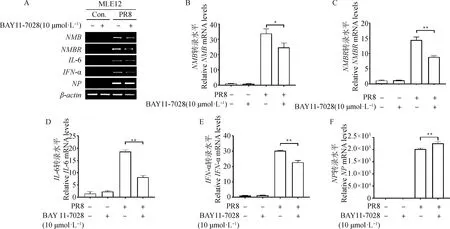
A.RT-PCR分析结果;B~F.qRT-PCR分析结果;*.P<0.05,**.P<0.01
BAY11-7028对WSN感染后这些基因的表达呈现相似的作用,其中NMB、IL-6 和IFN-α极显著下降(P<0.01),NMBR显著下降(P<0.05),NP极显著上升(P<0.01)(图2)。这些结果表明,BAY11-7028能有效抑制PR8和WSN感染诱导的NF-κB信号通路,暗示了PR8和WSN感染诱导MLE-12细胞中NMB和NMBR基因表达变化与NF-κB信号通路直接相关。
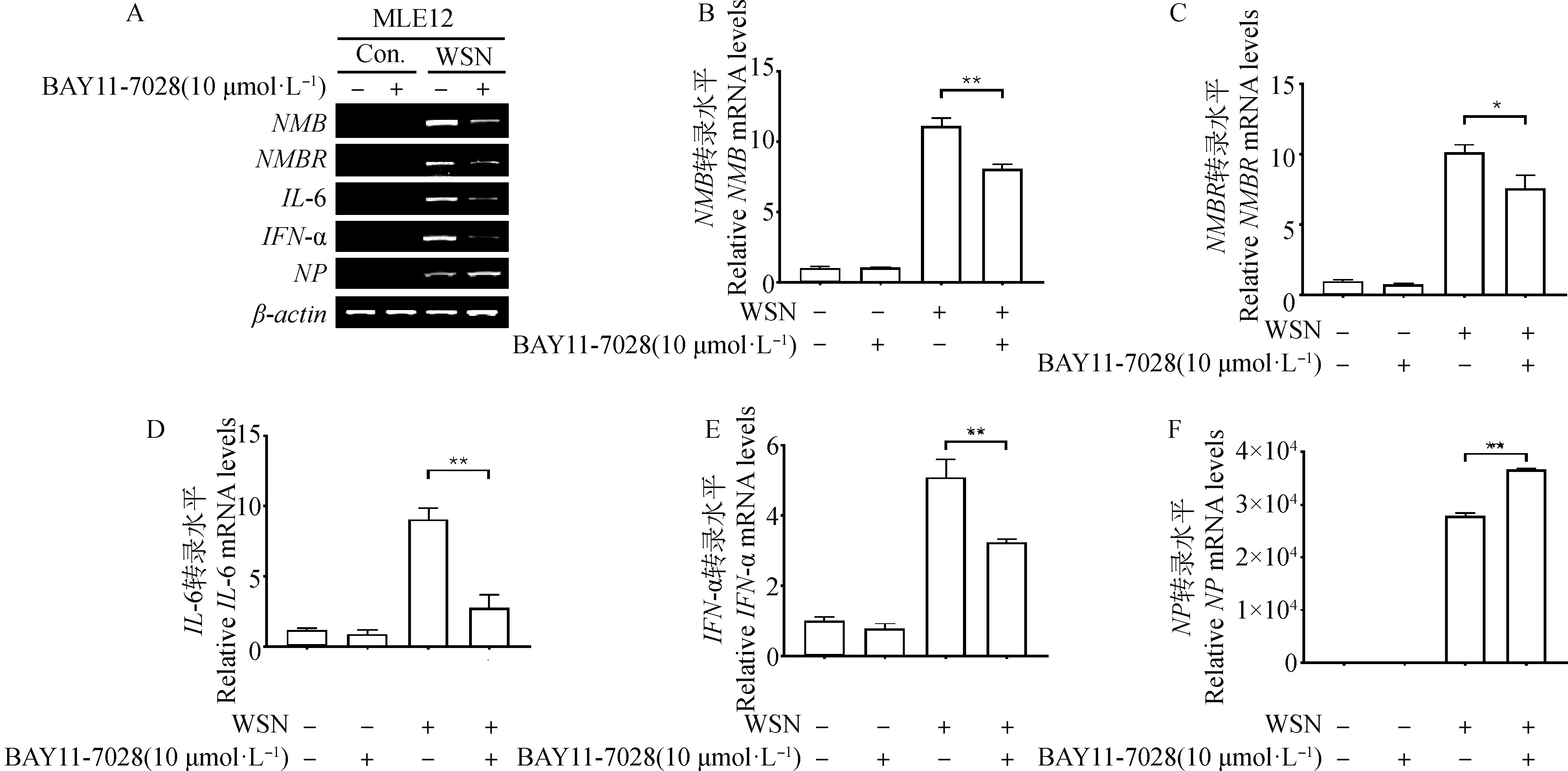
A.RT-PCR分析结果;B~F.qRT-PCR分析结果;*.P<0.05,**.P<0.01
2.2 BAY11-7028对PR8或WSN感染MLE-12细胞中相关蛋白表达水平的影响
收集并提取各组总蛋白,Western blot分析各组NMB、NMBR、p-P65、IκBα和NP蛋白表达变化。如图3所示,与PR8或WSN感染组相比,BAY11-7028可促使PR8或WSN感染后的MLE-12细胞中NMB、NMBR和p-P65蛋白表达水平明显降低,IκBα和NP蛋白表达水平上升。该结果表明,PR8和WSN感染诱导的MLE-12细胞中NMB和NMBR蛋白表达水平均与NF-κB信号通路有关。
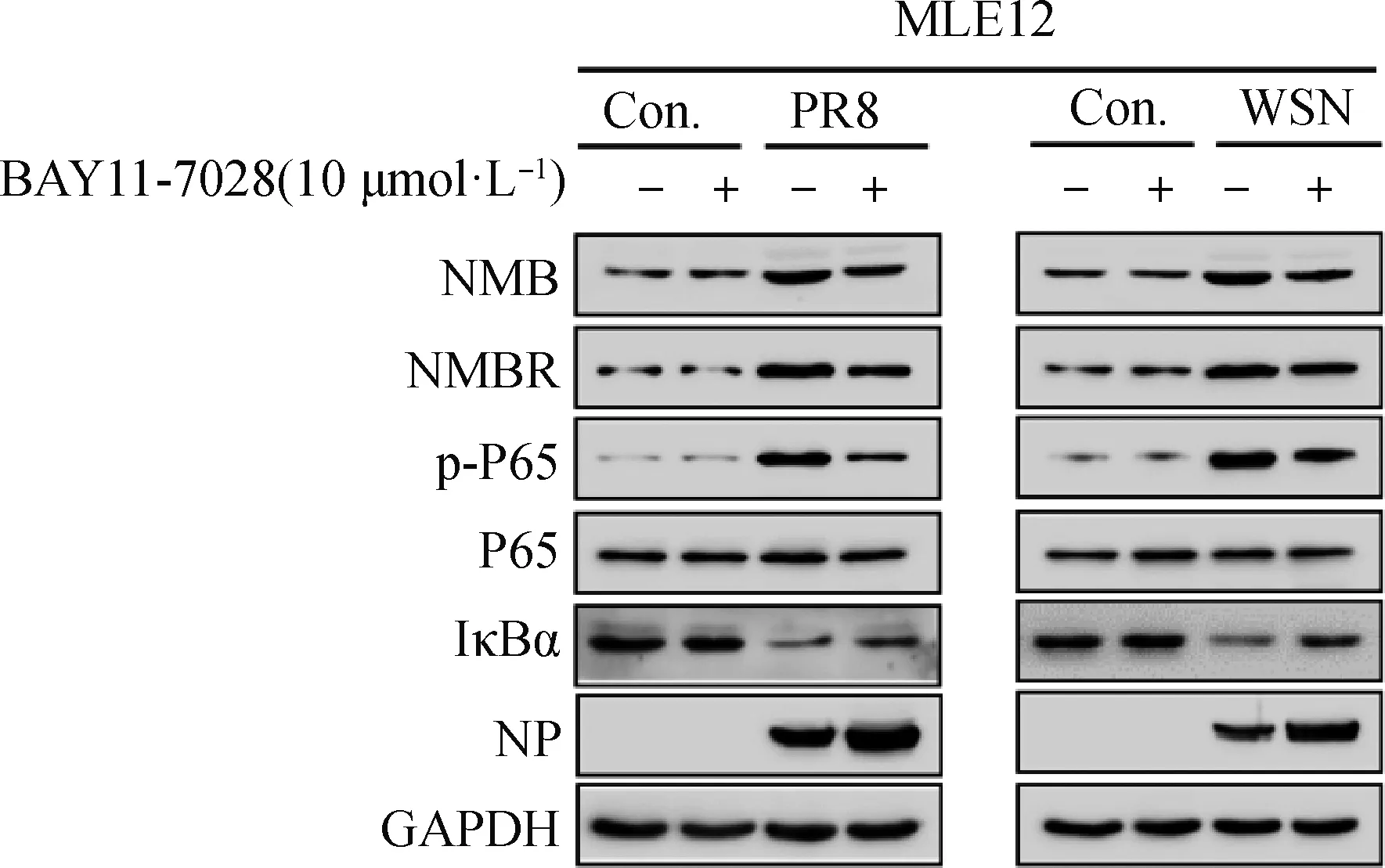
图3 WB分析BAY11-7028处理PR8或WSN感染MLE-12细胞后相关蛋白表达情况
2.3 NMB和BAY11-7028对PR8或WSN感染MLE-12细胞中相关基因转录水平的影响
qRT-PCR分析各组中IL-6、IFN-α和NP基因的转录水平的变化。结果显示,与PR8感染组相比,NMB和BAY11-7028可诱导PR8感染后的IL-6、IFN-α和NP基因的转录水平出现变化(图4),其中IL-6(P<0.01)和NP(P<0.01)出现极显著下降,IFN-α(P<0.01)显著上升。NMB和BAY 11-7028也可诱导WSN感染后的IL-6、IFN-α和NP基因的转录水平出现变化,其中IL-6(P<0.01)和NP(P<0.01)出现极显著下降,IFN-α(P<0.05)显著上升(图5)。这些结果表明,BAY11-7025可削弱外源性NMB对PR8或WSN感染诱导的MLE-12细胞中IL-6和IFN-α 基因转录水平的调节作用。

*.P<0.05, **.P<0.01
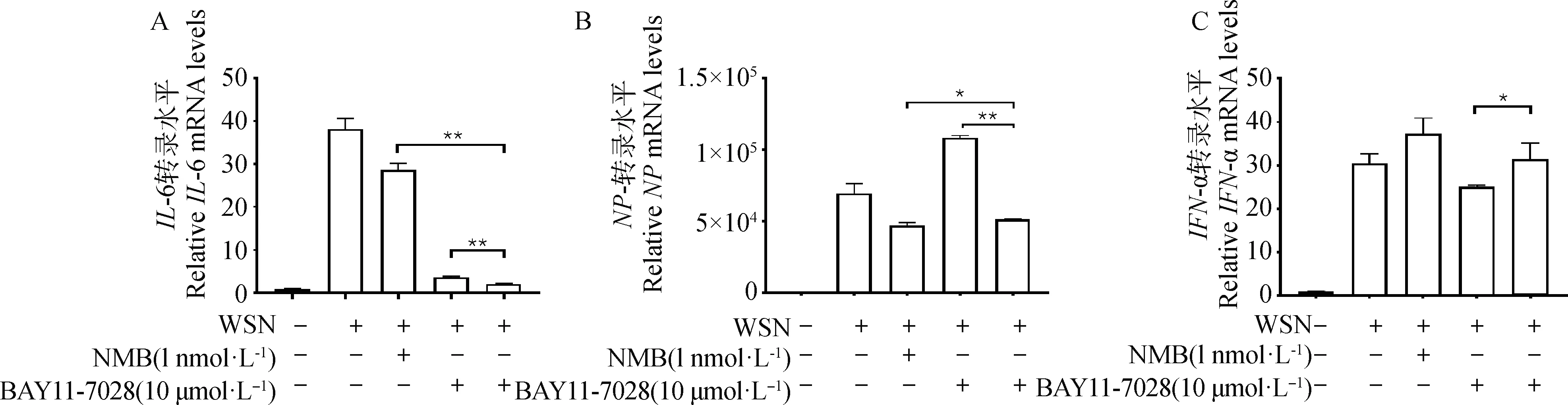
*.P<0.05, **.P<0.01
2.4 NMB和NMBRA对PR8或WSN感染诱导小鼠体内相关蛋白的影响
收集并提取各组总蛋白,通过Western blot分析p-P65、IκBα和NP蛋白的表达变化。结果显示,与阴性对照组相比,PR8感染诱导小鼠肺组织p-P65和NP蛋白表达水平上升,IκBα蛋白表达水平下降;与PR8感染组相比,外源性NMB可抑制小鼠肺组织内p-P65和NP蛋白表达水平,促进IκBα蛋白表达水平;WSN感染小鼠的结果与PR8感染的结果基本一致(图6)。NMBR抑制剂NMBRA联合NMB可抵消NMB对PR8或WSN感染后的这些蛋白表达的调节作用(图6),这反向证明了NMB的作用效果。这些结果表明,NMB可以调节NF-κB信号通路的p-P65和IκBα的表达而发挥抗IAV/H1N1的先天性免疫应答反应。
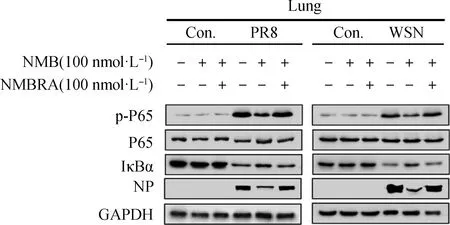
图6 Western blot分析NMB和NMBRA处理PR8或WSN感染小鼠后相关蛋白表达情况
3 讨 论
NMB通过特异性结合受体NMBR参与调节机体内的生物学功能。本课题组前期研究发现,外源性NMB可以调控PR8感染诱导的宿主细胞和动物体内的IL-6和IFN-α基因的表达而发挥抗PR8感染的先天性免疫应答反应[31],但其详细作用机制尚不清楚。研究表明,神经肽家族的成员可通过诱导NF-κB表达而调节天然免疫和获得性免疫[20-21]。NF-κB信号通路是体内抗病毒感染的信号通路,具有调控炎症因子、干扰素和多种抗病毒因子表达的功能[27-29,32-35],其活性能够被NF-κB抑制剂有效抑制,如:BAY11-7028[36-37]等。A型流感病毒感染激活NF-κB信号通路后,可诱导IκBα蛋白表达和P65蛋白磷酸化及核转移,从而影响下游细胞因子的表达[38-39]。这些研究暗示NMB参与宿主发挥抗IAV/H1N1感染可能与NF-κB信号通路密切相关。
为剖析NF-κB信号通路是否介导NMB发挥抗IAV/H1N1感染的先天性免疫应答反应,本研究发现BAY11-7028能够抑制PR8和WSN感染MLE-12细胞中IκBα表达,增强P65活性,降低NMB和NMBR表达水平,这表明NMB和NMBR表达变化与PR8和WSN感染激活的NF-κB信号通路直接相关。因此,NMB/NMBR是如何通过NF-κB信号通路参与抗IAV感染诱导的先天性免疫应答反应值得进行研究。进一步的体外试验结表明,外源性NMB可促使IAV/H1N1感染的MLE-12细胞中IL-6基因表达下降和IFN-α基因表达上升,这与前期的研究结果一致[31]。然而,外源性NMB和BAY11-7028共处理后诱导PR8和WSN感染MLE-12细胞中IL-6和IFN-α基因表达水平极显著下降,该结果表明外源性NMB可通过NF-κB信号通路参与IAV/H1N1感染诱导的炎症因子表达的调节作用。体内试验结果也表明,外源性NMB可抑制PR8或WSN感染小鼠诱导的肺组织p-P65和NP蛋白表达水平,促进IκBα蛋白表达水平。NMBR抑制剂NMBRA联合NMB可抵消NMB对PR8和WSN感染后的这些蛋白表达的调节作用,反向证实了上述NMB作用的可靠性。体内外试验结果一致表明,NMB可通过调节NF-κB信号通路上的p-P65和IκBα的表达而影响IAV感染诱导的IL-6和IFN-α的表达,从而发挥抗IAV/H1N1的先天性免疫应答反应。
4 结 论
本文分别从体内和体外水平研究发现NMB/NMBR与IAV/H1N1感染诱导的NF-κB信号通路存在直接关联,并且外源性NMB可通过调节IAV/H1N1感染诱导的p-P65和IκBα表达的作用,进而影响IAV/H1N1感染诱导的IL-6和IFN-α基因的表达水平。综合这些结果表明,IAV/H1N1感染诱导的NMB和NMBR表达可通过NF-κB信号通路参与机体发挥抗IAV感染的先天性免疫应答反应, 这为深入了解宿主抗IAV/H1N1感染的免疫反应机制和开发新型抗IAV/H1N1的药物提供更充足的理论依据。

