芒果叶提取液生物合成纳米TiO2工艺优化及其抗菌性能
许青莲,黄锐函,李宣林,2,邢亚阁,税玉儒,2,吴 林,于晋泽
•农产品加工工程•
芒果叶提取液生物合成纳米TiO2工艺优化及其抗菌性能
许青莲1,黄锐函1,李宣林1,2,邢亚阁1※,税玉儒1,2,吴 林1,于晋泽3
(1. 西华大学食品与生物工程学院,成都 610039;2. 西华大学宜宾研究院,宜宾 644004;3. 国家农产品保鲜工程技术研究中心(天津),农业农村部农产品贮藏保鲜重点实验室,天津市农产品采后生理与贮藏保鲜重点实验室,天津 300384)
为了将生物合成法制得的纳米粒子应用于果蔬保鲜中,该研究以芒果叶提取液和偏钛酸(TiO(OH)2)为原材料,采用生物合成法制备纳米二氧化钛(titanium dioxide,TiO2)粒子。以单因素试验为基础,通过响应曲面分析法优化了纳米TiO2生物合成工艺,研究了其抗菌性能。优化合成工艺为:TiO(OH)2添加量0.65 g,反应时间10.2 h,灼烧时间2 h,灼烧温度786 ℃。纳米TiO2的光诱导降解率为96.24%,与理论值标准偏差为0.6%。X射线衍射(X-ray Diffraction,XRD)结果显示,生物合成的纳米TiO2为锐钛矿型。扫描电镜(Scanning Electron Microscope,SEM)显示,生物合成后改性的纳米TiO2粒径分布在10~30 nm,无明显聚集体。紫外(Ultraviolet,UV)光诱导,生物合成改性的纳米TiO2(<0.05)对青霉菌表现出明显的抑制作用。该制备工艺可为光诱导抗菌性纳米TiO2的合成提供理论参考。
贮藏;品质控制;纳米二氧化钛;光诱导;生物合成;抗菌性
0 引 言
高腐烂率对果蔬的贮藏构成了重大挑战,导致其营养损失、微生物增长[1],每年都有因贮藏不当而造成新鲜农产品的巨大损失。可食性涂膜(Edible Coatings and Films,ECF)和气调包装等保鲜技术可以用于农产品储存和货架期间保证其产品质量[2-4]。作为光诱导抑菌剂[5],已有研究表明,纳米TiO2对细菌、真菌、霉菌都有抑制作用,将其添加到包装材料中,可使包装材料也具有抑菌性,从而减缓果蔬的腐败[6-8]。邢亚阁等[9]在壳聚糖载体中添加纳米TiO2,形成壳聚糖/纳米TiO2复合保鲜膜,有效地抑制了金黄色葡萄球菌的生长。Lin等[10]将淀粉和聚乙烯醇与纳米TiO2制成复合膜,该复合膜对大肠杆菌、李斯特菌均表现出抑制效果。但有关纳米TiO2对芒果青霉病主要致病菌青霉菌的抑制研究较少。
纳米TiO2的制备方法主要有液相法和气相法[11]。但近年来,随着可再生材料和无毒化学品需求的增长,纳米材料的生物合成方法越来越受到人们的关注。与细菌和真菌相比较,采用植物提取物制备出的纳米颗粒粒径更小并且合成速度更快。已经有不少研究表明,可以利用植物提取物合成纳米TiO2颗粒。Saravanan等[12]以蕨类植物提取物为原料,采用绿色合成方法制备TiO2,结果显示,通过控制试验条件可以较容易地制备出均匀性高,比表面积大,聚集度小的TiO2纳米颗粒,并可获得理想的锐钛矿型与金红石型比例。Abisharani等[13]以葫芦籽为原料,在三氯化钛(TiCl3)溶液中绿色合成纳米TiO2粒子,并观察到形成了正方体结构,傅立叶变换红外光谱仪(Fourier Transform Infrared Spectroscopy,FTIR)分析结果表明存在各种功能性生物分子作为还原剂和封端剂将TiO4转化为TiO2纳米粒子。但少有研究以芒果叶作为原料生物合成纳米TiO2。
中国每年产生大量的芒果叶废弃物,少有研究与芒果叶相关。已有研究表明,芒果叶含有多酚和黄酮类等生理活性物质,这些物质具有一定的还原作用[14-15]。本文利用芒果叶提取液作为还原剂,生物合成TiO2纳米,避免了芒果叶资源的浪费,提高了其利用率。采用生物合成法制备纳米TiO2,通过单因素和Box-Behnken响应面试验,以亚甲基蓝的光诱导降解率为响应值,分析TiO(OH)2添加量、反应时间、灼烧时间及灼烧温度4个因素对制备纳米TiO2亚甲基蓝光诱导降解率的影响,优化出制备纳米TiO2的较佳工艺条件,为TiO2纳米颗粒的制备和应用提供理论的依据。
1 材料与方法
1.1 主要材料与试剂
芒果叶,四川攀枝花农家果园;TiO(OH)2(分析纯),上海麦克林生化科技有限公司;市购纳米TiO2(纯度>99%),北京德科岛金科技有限公司;亚甲基蓝(分析纯),成都市科龙化工试剂厂;马铃薯葡萄糖琼脂(Potato Dextrose Agar,PDA),北京奥博星生物技术有限责任公司;青霉菌(P.)CICC 2478,中国工业微生物菌种保藏管理中心(China Center of In-dustrial Culture Collection,CICC)。
1.2 主要仪器与设备
DK-98-Ⅱ电热恒温水浴锅,天津市泰斯特仪器有限公司;RH digital数显加热控温型磁力搅拌器,广州市艾卡仪器设备有限公司;SHD-Ⅲ循环水式多用真空泵,郑州长盛实验仪器有限公司;BPG-9240A精密鼓风干燥箱,上海一恒科技有限公司;SX2-2.5-Ω箱式电阻炉,上海意丰电炉有限公司;YS-XCABLED光照柜,杭州屹石科技有限公司;UV3600紫外-可见分光光度计,日本岛津公司;KQ-100DE数控超声波清洗器,昆山市超声仪器有限公司;BSC-1300ⅡA2生物安全柜,苏州安泰空气技术有限公司;GI54DWS立式自动压力蒸汽灭菌器,致微(厦门)仪器有限公司;Gemini场发射扫描电子显微镜,德国卡尔·蔡司股份公司。
1.3 制备与测定方法
1.3.1 纳米TiO2的生物合成
参照Sundrarajan等[16]的方法,且稍作修改。将新鲜芒果叶25 ℃左右自然通风干燥一周(干燥至叶片变黄),(鲜芒果叶主要活性成分为总黄酮占比38.35%[17],干芒果叶主要活性成分芒果苷含量28 mg/g[18]),剪碎,称取5 g剪碎后的芒果叶浸泡于100 mL蒸馏水中,在80 ℃下浸提30 min(浸提30 min得到的芒果叶提取液还原能力较佳),提取液用快速滤纸粗滤一次,再用滤膜真空过滤两次,过滤后的提取液保存于4 ℃冰箱内,用于下一步试验。
将0.5 g TiO(OH)2粉末分散于50 mL提取液中,采用恒温磁力搅拌器在60 ℃下连续搅拌3 h后在室温下静置冷却10 h,使提取液与TiO(OH)2充分反应。反应结束后将沉积在反应瓶底部的沉淀物真空过滤,用蒸馏水洗涤3~4次,滤液置于80 ℃烘箱内干燥30 min,在800 ℃马弗炉中灼烧3 h,制得纳米TiO2。制备流程如图1。
1.3.2 单因素试验设计
固定条件为TiO(OH)2的添加量设定为0.50 g,反应时间为10 h,灼烧温度为800 ℃,灼烧时间为2 h为初始条件,分别考察TiO(OH)2的添加量(0.25、0.50、1.00、1.50、2.00、2.50、3.00 g)、反应时间(6、8、10、12、14 h)、灼烧温度(400、500、600、700、800、900 ℃)、灼烧时间(1、2、3、4、5、6 h)对亚甲基蓝光诱导降解率的影响。
1.3.3 响应曲面试验设计
在单因素试验结果的基础上,选取TiO(OH)2添加量、反应时间、灼烧温度、灼烧时间4个因素为考察因素,以亚甲基蓝光诱导降解率为响应值,进行优化试验,设计四因素三水平共29组的Box-Behnken响应曲面优化试验,确定生物合成纳米TiO2的较佳工艺条件,试验因素及水平如表1所示。

表1 响应面试验设计因素和水平
1.3.4 芒果叶提取液还原能力的测定
设定TiO(OH)2添加量为0.50 g,反应时间为10 h,灼烧时间为2 h,灼烧温度为800 ℃,芒果叶浸提时间分别为10、20、30、40和50 min,考察不同浸提时间对芒果叶提取液还原能力的影响。提取液还原能力通过纳米TiO2产率表示,产率的计算公式如下:
1.3.5 光诱导性能测试
参考崔国意等[19]的测定方法,稍作修改。在250 mL的烧杯中加入纳米TiO2样品0.20 g,再将80 mL 0.08 g/L的亚甲基蓝溶液加入其中,使用磁力搅拌器进行搅拌。黑暗条件下放置30 min后取样,后放于光照柜中,在波长365 nm的紫外灯下光照的同时进行搅拌,每隔30 min取一次样,通过紫外分光光度计测定664 nm处的吸光值。光诱导降解率计算公式如下:
1.3.6 X射线衍射(X-ray Diffraction,XRD)分析
用D8 advance X射线多晶粉末衍射仪对纳米TiO2粒子进行表征。使用Cu K射线,电压为35 kV,电流为30 mA,扫描范围为2=20°~90°,扫描步长0.026°,采样时间12.24 s。
1.3.7 扫描电镜(Scanning Electron Microscope,SEM)分析
利用Gemini场发射扫描电子显微镜观察生物合成与生物合成后改性的纳米TiO2粒子的表面形貌。用双面碳导电胶带将样品固定于不锈钢载物台上,进行溅射喷金,在1 kV电压下进行观察。
1.3.8 纳米二氧化钛抗菌试验
1)试验菌悬液的制备
通过平板接种、培养、活化后的青霉菌(P.),用无菌水洗脱,无菌纱布过滤滤去菌丝,加入无菌玻璃珠,使孢子充分分散,形成悬浮液,在显微镜下调整菌悬液浓度为106~107CFU/mL(菌悬液浓度测定使用血球计数板),置于4 ℃低温保存备用。
2)纳米TiO2的改性
参照Xing等[20]的方法。在70 mL去离子水中缓慢加入5.0 g纳米TiO2,用1.0 mol/L HCl(或1.0 mol/L NaOH)调节溶液pH值至5.5,加入0.75 g月硅酸钠(月桂酸钠能很好地分散TiO2纳米粒子的非极性基团),使用磁力搅拌器在40 ℃下搅拌30 min,随后转移溶液至离心管中,于4 000 r/min条件下离心10 min,保留沉淀物,使用去离子水离心洗涤沉淀物2~3次,在105 ℃下烘干至恒量,得到改性的纳米TiO2(TN-3),置于干燥器中保存备用。
3)CTS-TiO2-Ag复合涂膜液的制备
在100 mL容量瓶中加入甘油1.0 g、生物合成后改性的纳米TiO2(TN-3)(经过试验证明改性后的纳米TiO2抑菌效果更优)0.05 g,再添加1.5 mmol/L的纳米银溶液5 mL与冰乙酸1 mL,定容。定容完成后,转移溶液至烧杯中,一边搅拌一边加入纳米壳聚糖1.0 g,待壳聚糖(Chitosan,CTS)溶解完全后,超声(功率100W,频率20 kHz)脱气30 min,再搅拌、脱气,得到CTS-TiO2-Ag纳米复合涂膜液。
4)培养基的制备
马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA):称取PDA 38 g,与1 000 mL蒸馏水加热煮沸使PDA溶解,进行杀菌处理(121 ℃,20 min),杀菌后使其冷却倒平板。
纳米TiO2-PDA培养基:将市购纳米TiO2(TN-1)、生物合成纳米TiO2(TN-2)、生物合成后改性的纳米TiO2(TN-3)分别称取0.2 g,溶于50 mL去离子水中,进行30 min的超声波处理后得到3种纳米TiO2溶液。溶解的PDA每15 mL分装到试管中,加入2 mL纳米TiO2溶液,进行杀菌(121 ℃,20 min),杀菌后使其冷却倒平板。
纳米CTS-TiO2-Ag-PDA培养基:溶解的PDA每100 mL分装到锥形瓶中,每瓶中加入2 mL纳米CTS-TiO2-Ag复合涂膜液,进行杀菌(121 ℃,20 min),杀菌完成后冷却倒平板。
5)UV光诱导离体抗菌试验
采用3点接种法将P.(芒果青霉病主要致病菌)接种于PDA、纳米TiO2-PDA以及纳米CTS-TiO2-Ag-PDA培养基上,进行光照处理。将PDA、纳米TiO2-PDA与纳米CTS-TiO2-Ag-PDA三种培养基分成6组(每组3次重复),光照条件分别为:黑暗处理(对照组,KB)、日光灯光照30 min(RG)、UV光照30 min(ZG-30)、UV光照60 min(ZG-60)、UV光照90 min(ZG-90)和UV光照120 min(ZG-120)。光照结束后将培养基放入28 ℃恒温培养箱中倒置培养,每组试验重复3次。
使用游标卡尺分别测定霉菌培养72、96和120 h后的直径,以3个平皿测得的菌落直径的平均值作为测定结果。
1.4 数据处理
采用Origin 9作图,使用Design-Expert 8.0.6软件进行响应曲面试验设计优化及响应曲面数据处理;采用Excel 2019和SPSS 25.0进行数据统计和分析,所有试验重复3次,结果以平均值±标准差表示,显著性水平<0.05。
2 结果与分析
2.1 浸提时间对芒果叶提取液还原能力的影响
植物的各个部分被认为是生产纳米粒子潜在的还原剂[16],芒果叶的浸提时间对纳米TiO2粒子产率的影响,如图2所示。纳米TiO2的产率随着浸提时间的延长而增加,浸提时间为10 min时,产率仅为74.11%,当浸提时间增加至30 min时,纳米TiO2产率为86.74%,二者差异显著(<0.05)。浸提时间增加至40、50 min,纳米TiO2粒子的产率为87.62%、87.93%,与30 min处理组无显著性差异。综合考虑,芒果叶提取液的浸提时间选择30 min较为适宜。
2.2 单因素试验结果
2.2.1 TiO(OH)2添加量对亚甲基蓝光诱导降解率的影响
单因素试验结果见图3。TiO(OH)2的不同添加量对亚甲基蓝光诱导降解率的影响结果如图3a所示。光诱导反应210 min时,TiO(OH)2添加量分别为1.00、1.50、2.00、2.50、3.00 g,合成的纳米TiO2对亚甲基蓝光诱导降解率为80.40%、61.28%、49.12%、13.02%、9.74%,各处理组之间差异显著(<0.05)。而当TiO(OH)2的添加量为0.25 g时,纳米TiO2对亚甲基蓝光诱导降解率为89.17%,TiO(OH)2添加量为0. 50 g时,纳米TiO2光诱导降解率为88.92%,两个处理组之间差异不显著。随着TiO(OH)2添加量的增加,合成得到的纳米TiO2光诱导效果呈现逐渐降低的趋势。出现上述现象的原因可能是,TiO(OH)2添加量越大,与植物提取液完全反应所需时间越长,TiO(OH)2添加量增大使得与植物提取液的合成反应不充分,得到的纳米TiO2晶核形成尚不完全,不定形的TiO2比表面积小,光诱导效果较弱,TiO(OH)2添加量越大,与植物提取液完全反应所需的时间越长。综合考虑,在试验中设定TiO(OH)2添加量为0.50 g较合适。
2.2.2 反应时间对亚甲基蓝光诱导降解率的影响
不同反应时间对亚甲基蓝光诱导降解率的影响结果如图3b,纳米TiO2的光诱导降解率随着反应时间的增加呈现出先上升后下降的趋势。光诱导反应210 min,反应时间为10、12和14 h合成的纳米TiO2光诱导降解率分别为80.40%、63.86%和55.37%,各处理组之间存在显著性差异(<0.05)。与此同时,当反应时间分别为6、8 h时,合成的纳米TiO2对亚甲基蓝的光诱导降解率为71.91%、72.55%,二者之间的差异不显著。主要是因为纳米TiO2生成反应开始时,晶核形成过程中,反应的时间过短会致使形成的晶核不完全,导致不成型的纳米TiO2光诱导效果差。但反应时间太长会使得形成的晶核发生团聚现象,生成的纳米TiO2比表面积减小,从而导致光诱导降解率降低[21]。综上,在试验中选择10 h的反应时间较适宜。
2.2.3 灼烧温度对亚甲基蓝光诱导降解率的影响
灼烧温度对亚甲基蓝光诱导降解率的影响如图3c,光诱导反应210 min时,灼烧温度分别为400、500、600、700、800 ℃,生成的纳米TiO2对亚甲基蓝的降解率为32.65%、52.53%、80.40%、81.26%、90.13%,各处理组之间存在显著性差异(<0.05)。400~800 ℃范围内,随着灼烧温度的升高,纳米TiO2光诱导剂的光诱导性能呈现上升的趋势。当灼烧温度增至900 ℃时,降解率为73.34%,与其他处理组之间差异显著(<0.05)。这可能是因为,随着灼烧温度的升高,纳米TiO2的晶型从无定形转为锐钛矿型,锐钛矿型纳米TiO2的光诱导效果更好,其可以在800 ℃的高温条件下保持稳定,但温度的升高使得一部分锐钛矿型纳米TiO2开始向金红石型转变,同时高温降低了比表面积,从而导致了光诱导性能的降低[22-23]。综合考虑,试验中选择800 ℃的灼烧温度较合适。
2.2.4 灼烧时间对亚甲基蓝光诱导降解率的影响
不同灼烧时间对纳米TiO2光诱导降解率的影响如图 3d所示。由图3d可知,在光诱导反应210 min时,纳米TiO2对亚甲基蓝的光诱导降解率呈现先升高后降低的趋势,灼烧时间为1 h合成的纳米TiO2对亚甲基蓝的光诱导降解率为78.86%。灼烧时间为2 h合成的纳米TiO2光诱导降解率为83.28%,与1 h处理组之间存在着显著差异(<0.05)。同时,当灼烧时间为3、4、5、6 h时,纳米TiO2对亚甲基蓝的光诱导降解率分别为80.40%、69.25%、65.47%、62.47%,各处理组之间也存在显著性差异(<0.05)。灼烧时间过短,杂质可能无法得到彻底的清除,并且晶相的转变也不完全,而当灼烧时间太长,大于2 h后,合成的纳米TiO2晶相不断增长,TiO2纳米粒子开始团聚,致使纳米TiO2的光诱导比表面积减小,对亚甲基蓝的光诱导降解率降低[23]。综合考虑,选择灼烧时间为2 h较适宜。
2.3 响应曲面试验结果
2.3.1 响应曲面试验设计及结果
采用Box-Behnken试验设计,以TiO(OH)2添加量()、反应时间()、灼烧温度()和灼烧时间()为自变量,以亚甲基蓝光诱导降解率为响应值,进行响应曲面优化分析,试验设计及结果见表2。
利用Design Expert 8.0.6 数据分析软件对表2中的试验数据进行分析,建立模型,经回归拟合得出光诱导降解率(%)为目标函数的(g)、(h)、(℃)和(h) 4因素的二次多项回归模型如下:
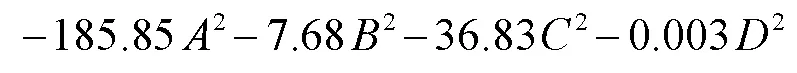
2.3.2 回归方程方差分析
根据表3亚甲基蓝光诱导降解率方差分析得出,模型检验<0.000 1,方差模型达到极显著,具有统计学意义,失拟项=0.329 7>0.05,失拟项不显著,表明该回归模型与实际试验具有较高的拟合度,进一步说明该模型可信度高,因此可以用该回归方程预测生物合成纳米TiO2的最佳工艺参数。
该回归模型决定系数2= 0.958 7,调整决定系数2Adj= 0.917 3,说明该模型可以解释91.73%响应值的变化,回归模型较可靠,可用于纳米TiO2的生物合成工艺优化试验的理论推测。
在光诱导降解率模型中,一次项TiO(OH)2添加量()、灼烧时间(),二次项2、2、2、2及交互项对亚甲基蓝光诱导降解率影响极显著(<0.01);而交互项和影响显著(<0.05),其他交互项影响不显著。各因素显著程度从大到小依次为TiO(OH)2添加量()、灼烧时间()、灼烧温度()、反应时间()。
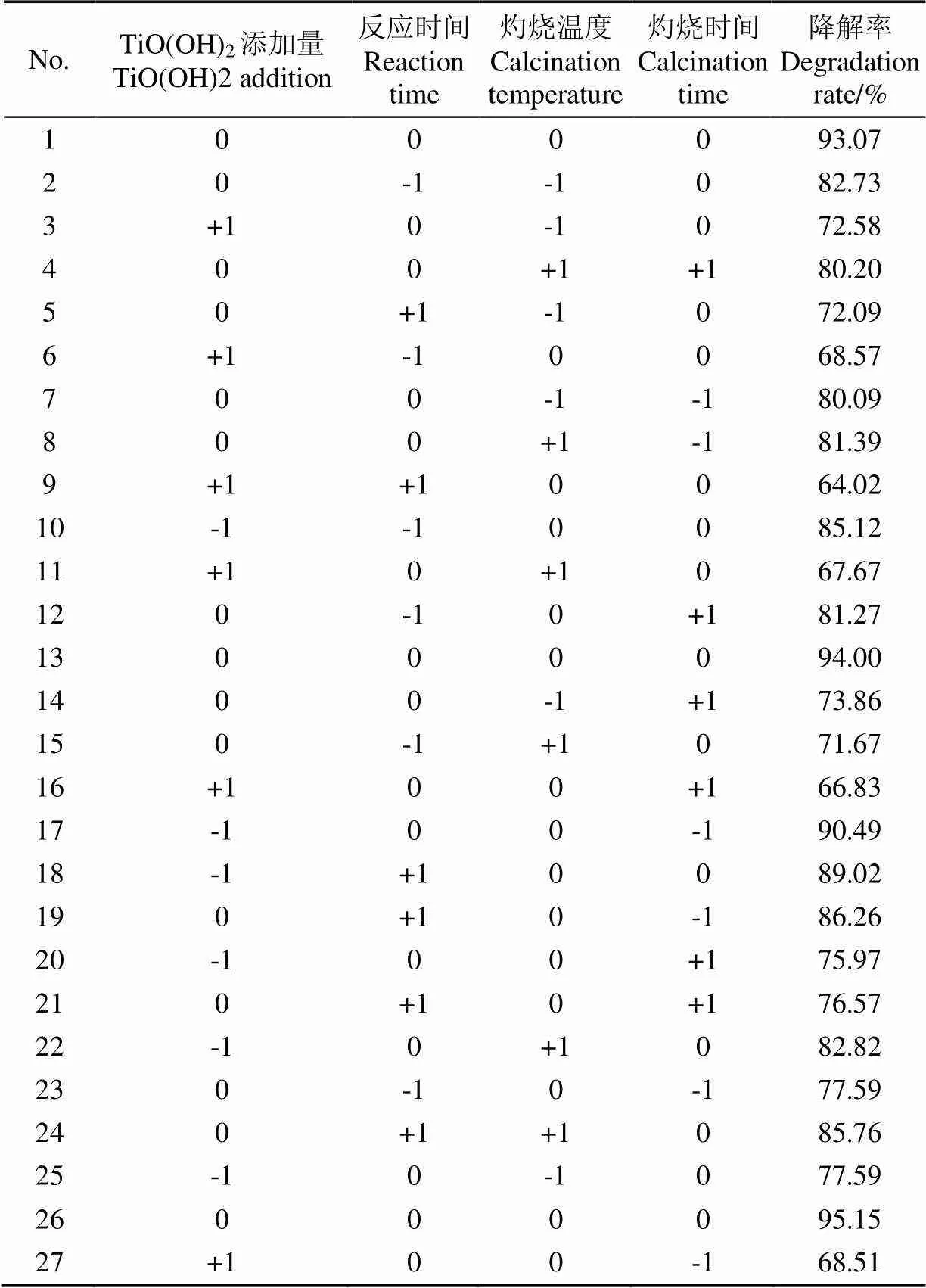
表2 Box-Behnken试验设计及结果
2.4 验证试验
通过Box-Behnken试验结果,综合考虑亚甲基蓝光诱导降解率,确定模型优化得到纳米TiO2生物合成较佳工艺条件为TiO(OH)2添加量0.65 g,反应时间10.21 h,灼烧时间2.08 h,灼烧温度786.41 ℃,在此工艺条件下预测最高降解率为97.68%,考虑到实际操作的可行性,所以选定经过调整的工艺参数为TiO(OH)2添加量0.65 g,反应时间10.2 h,灼烧时间2 h,灼烧温度786 ℃,以此工艺条件重复3次试验,合成得到的纳米TiO2对亚甲基蓝光诱导的降解率达到96.24%,预测值和实际值标准偏差为0.6%,说明采用响应面法对生物合成纳米TiO2工艺参数的优化结果准确可靠。
2.5 X射线衍射(X-ray Diffraction,XRD)分析结果
用XRD谱仪对生物合成的纳米粒子进行结构和矿相性质分析,图谱如图4所示。从XRD图谱中发现,纳米TiO2粒子为单一的锐钛矿相,且没有任何其他二次衍射峰,表明所获得的纳米粒子是高纯度的,没有任何杂质。衍射角2为25.2°、37.7°、47.9°、53.8°、54.7°、62.7°、69.8°和75.1°时,分别对应锐钛矿相的(101)、(004)、(200)、(105)、(211)、(204)和(116)晶面[24-25]。

表3 回归模型方差分析
注:“**”表示差异极显著(<0.01);“*”表示差异显著(<0.05);“-”为差异不显著。
Note: “**” indicating extremely significant difference (<0.01); “*” indicating significant difference (<0.05); “-” indicating no significant difference.
2.6 扫描电镜(Scanning Electron Microscope,SEM)分析结果
用扫描电镜(Scanning Electron Microscope,SEM)分析了TN-2(生物合成)与TN-3(生物合成改性)的纳米TiO2粒子的形态特征和粒径大小,如图5所示。从图5中分析可知,TN-2的TiO2纳米颗粒呈现为准球形,粒径较小,分布在20~40 nm范围内;TN-3也呈现为准球形,且粒径分布于10~30 nm,比TN-2的粒径更小。SEM图像中纳米颗粒的形状和尺寸明确,TN-2聚集体较少,TN-3无明显聚集体,这是由于芒果叶提取液(充当稳定/封盖剂)在合成过程中所起的重要作用将TiO(OH)2还原为纳米级[26]。制备的纳米颗粒粒径减小与表面体积比的增加成反比,这有助于纳米粒子穿透细胞壁快速杀死微生物,这是绿色合成的TiO2纳米粒子抗菌活性增强的主要原因[27]。改性后的纳米TiO2平均粒径更小,聚集体更少,分散性更好,因此选用生物合成改性的纳米TiO2进行复合涂膜液的制备。
2.7 光诱导合成的纳米二氧化钛抗菌性能
2.7.1 单独UV光照处理对P.的抑制作用
不同光照处理对P.菌落生长的影响如图6a。由图可知,培养72 h,UV光照30、60、90和120 min处理组的P.菌落直径分别为7.37、7.43、7.27和7.43 mm,与黑暗处理、日光处理组的7.55、7.35 mm之间差异不明显。此外,培养96和120 h时各处理组之间差异也不明显,说明只进行UV光照处理对P.的抑制效果不显著。
2.7.2 纳米TiO2单体UV光诱导对P.的抑制作用
市购纳米TiO2(TN-1)、生物合成纳米TiO2(TN-2)及生物合成后改性的纳米TiO2(TN-3)样品UV光诱导处理对P.菌落生长的影响分别见图6。由图 6b~d数据可以得知,纳米TiO2经过紫外光诱导抗P.的效果显著优于单独紫外光照处理组(<0.05)。
由图6b~d可看出,不同光照处理条件下,对培养120 h的P.的菌落直径进行测量,TN-1样品的KB组和RG组的菌落直径分别为11.78和11.71 mm,二者之间差异不显著,说明黑暗处理和日光灯诱导处理对P.并没有明显的抑制效果。TN-2和TN-3的黑暗处理和日光灯诱导处理抑菌效果与TN-1样品相同。图6b,随着UV光照时间的延长,经过照射处理的菌落直径呈现减小的趋势,培养120 h,经UV光诱导30、60、90和120 min的P.菌落直径分别为9.89、9.57、9.16和7.99 mm(<0.05),这说明UV光诱导时间越长,P.菌落直径越小,UV光诱导对P.的抑制效果就越明显。在UV光诱导下,经过TN-2和TN-3样品处理的P.菌落直径随着时间的增加而减小,这与TN-1相同。经UV光诱导120 min,培养120 h后,TN-1、TN-2和TN-3三个样品处理组的菌落直径分别为7.99、7.80和6.86 mm,TN-3组与其他两组之间有显著性差异(<0.05),表明生物合成的纳米TiO2对P.的抑制效果优于市购纳米TiO2,且改性后的纳米TiO2对P.具有更好的抑菌效果,更适用于纳米复合涂膜的制备。
2.7.3 CTS-TiO2-Ag纳米复合涂膜液UV光诱导对P.的抑制作用
纳米CTS-TiO2-Ag复合涂膜液经过UV光诱导对P.的抑制效果如图6e所示。由图6可知,UV光照30 min后培养72 h,纳米CTS-TiO2-Ag复合涂膜液UV光诱导的菌落直径为4.00 mm(图6e),与单独的UV光诱导处理的7.37 mm(图6a),纳米TiO2单体的UV光诱导处理的6.27(图6b)、5.93(图6c)、5.79(图 6d)mm存在显著差异(<0.05),这表明在UV光照时间与培养时间相同的条件下,纳米CTS-TiO2-Ag复合涂膜液UV光诱导对P.的抑制效果更好。UV光照时间由30增加至120 min,培养96 h,P.的菌落直径差异不明显,由4.32减少至3.76 mm,但仍与黑暗处理组KB的5.59 mm、日光诱导处理组的5.43 mm存在显著差异(<0.05),说明UV光诱导时间越长,纳米TiO2对P.的抑制效果越好。
3 结 论
采用生物合成法,以芒果叶提取液为还原剂,TiO(OH)2为钛源,制备纳米二氧化钛粒子。
1)通过单因素和响应面试验,以纳米TiO2粒子对亚甲基蓝的光诱导降解率为考察指标,进行工艺优化,得到的优化制备工艺条件为:TiO(OH)2添加量0.65 g,反应时间10.2 h,灼烧温度786 ℃和灼烧时间2 h。在该条件下测得合成的纳米TiO2对亚甲基蓝的降解率为96.24%。
2)扫描电镜显示,采用生物合成法制备出的TN-2和生物合成后改性的TN-3样品形状为球形,颗粒尺寸小,且改性后的颗粒粒径最小。X射线衍射得到生物纳米TiO2粒子为锐钛矿型且具有高纯度。
3)生物合成的纳米TiO2光诱导抗菌能力强,且UV光诱导生物合成的纳米TiO2对P.的抑制效果优于市购纳米TiO2,生物合成改性的纳米TiO2对P.具有更好的抑菌效果。
4)将改性后的纳米TiO2应用于复合涂膜中,对P.的抑制效果更明显,为纳米TiO2粒子应用到涂膜中提供理论依据。有关生物合成纳米TiO2对其他微生物的抑制作用及其生物相容性,在涂膜中的稳定性仍需要进一步研究。
[1] Xing Y, Xu Q, Yang S, et al. Preservation mechanism of chitosan-based coating with cinnamon oil for fruits storage based on sensor data[J]. Sensors, 2016, 16(7): 1111.
[2] Yinzhe R, Shaoying Z. Effect of carboxymethyl cellulose and alginate coating combined with brewer yeast on postharvest grape preservation[J]. Isrn Agronomy, 2014, 2013: 1-7.
[3] Hosseinnejad M, Jafari S M. Evaluation of different factors affecting antimicrobial properties of chitosan[J]. International Journal of Biological Macromolecules, 2016, 85: 467-475.
[4] Xing Y, Xu Q, Li X, et al. Chitosan-based coating with antimicrobial agents: Preparation, property, mechanism, and application effectiveness on fruits and vegetables[J]. International Journal of Ploymer Science, 2016, 2016: 1-24.
[5] Joost U, Juganson K, Visnapuu M, et al. Photocatalytic antibacterial activity of nano-TiO2 (anatase)-based thin films: effects on Escherichia coli cells and fatty acids[J]. Journal of Photochemistry & Photobiology B Biology, 2015, 142: 178-185.
[6] Qiao G, Xiao Z, Ding W, et al. Effect of chitosan/nano-titanium dioxide/ thymol and tween films on ready-to-eat cantaloupe fruit quality[J]. Coatings, 2019, 9(12): 828-837.
[7] Cheng Y W, Chan R, Wong P K. Disinfection of Legionella pneumophila by photocatalytic oxidation[J]. Water Research, 2007, 41(4): 842-852.
[8] 扈莹莹,李其轩,刘昊天,等. 纳米二氧化钛光催化技术抑菌机制及其在食品包装中的应用研究进展[J]. 食品科学,2020,41(3):232-238.
Hu Yingying, Li Qixuan, Liu Haotian, et al. Bactericidal mechanism of nano-titanium dioxide photocatalysis technology and its application in food packaging: A literature review[J]. Food Science, 2020, 41(3): 232-238. (in Chinese with English abstract)
[9] 邢亚阁,刘茜,江雨若,等. 壳聚糖/纳米TiO2复合涂膜抗菌及物理性能分析[J]. 西华大学学报:自然科学版,2018,37(2):34-39.
Xing Yage, Liu Qian, Jiang Yuruo, et al. Antibacterial and physical properties of chitosan /Nano-TiO2 composite coatings[J]. Journal of Xihua University: Natural Science Edition, 2018, 37(2): 34-39. (in Chinese with English abstract)
[10] Lin D, Huang Y, Liu Y, et al. Physico-mechanical and structural characteristics of starch/polyvinyl alcohol/nano-titania photocatalytic antimicrobial composite films [J]. LWT-Food Sci Technol, 2018, 96: 704-712.
[11] 陈晶晶,许猛,徐丽亚,等. 纳米二氧化钛的制备、改性及光催化研究进展[J]. 浙江化工,2020,51(6):21-24.
Chen Jingjing, Xu Meng, Xu Liya, et al. Research progress on preparation, modification and photocatalysis of nano titanium dioxide[J]. Zhejiang Chemical Industry, 2020, 51(6): 21-24. (in Chinese with English abstract)
[12] Saravanan S, Balamurugan M, Lippitz A, et al. Xanes studies of titanium dioxide nanoparticles synthesized by using Peltophorumpterocarpum plant extract[J]. Physica B: Physics of Condensed Matter, 2016, 503: 86-92.
[13] Abisharani J M, Devikala S, Dinesh Kumar R, et al. Green synthesis of TiO2Nanoparticles using Cucurbita pepo seeds extract[J]. Materials Today, 2019, 14(2): 302-307.
[14] 张静,陶俊葓,刘银,等. 响应曲面法优化超声辅助提取芒果叶中多酚和黄酮工艺及抗氧化活性研究[J]. 云南民族大学学报:自然科学版,2020,29(6):527-534.
Zhang Jing, Tao Junhong, Liu Ying, et al. Optimization of ultrasound-assisted extraction technology of total polyphenols and flavonoids from Mango leaves with the response surface method and the antioxidant activity[J]. Journal of Yunnan University: Natural Science Edition, 2020, 29(6): 527-534. (in Chinese with English abstract)
[15] 杨宁,郝林,杨鹏. 芒果皮提取物合成纳米银及抑菌性研究[J]. 山西农业大学学报:自然科学版,2013,33(1):59-65.
Yang Ning, Hao Lin, Yang Peng. Mango peel extract mediated novel route for synthesis of silver nanoparticles and antibacterial application of silver nanoparticles[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2013, 33(1): 59-65. (in Chinese with English abstract)
[16] Sundrarajan M, Bama K, Bhavani M, et al. Obtaining titanium dioxide nanoparticles with spherical shape and antimicrobial properties using M. citrifolia leaves extract by hydrothermal method[J]. Journal of Photochemistry & Photobiology B Biology, 2017, 171: 117-124.
[17] 王晓波,刘冬英,邹志辉,等. 芒果叶总黄酮含量及抗氧化作用测定[J]. 中国公共卫生,2013,29(7):1016-1018.
Wang Xiaobo, Liu Dongying, Zhou Zhihui, et al. Anti-oxidant effect of total flavonoids from mango leaves in vitro[J]. Chinese Journal of Public Health, 2013, 29(7): 1016-1018.
[18] Kulkarni V M, Rathod V K. Utilization of waste dried Mangifera indica leaves for extraction of mangiferin by conventional batch extraction and advance three-phase partitioning[J]. Green Processing & Synthesis, 2016, 5(1): 79-85.
[19] 崔国意,李卓,王晨,等. 亚酞菁/二氧化钛纳米复合材料的制备及其光催化性能[J]. 西北大学报:自然科学版,2018,48(2):219-225.
Cui Guoyi, Li Zhuo, Wang Chen, et al. Preparation and photocatalytic performances of subphthalocyanine-TiO2 nanocomposites[J]. Journal of Northwest University: Natural Science Edition, 2018, 48(2): 219-225. (in Chinese with English abstract)
[20] Xing Y, Li X, Guo X, et al. Effects of different TiO2nanoparticles concentrations on the physical and antibacterial activities of chitosan-based coating Film[J]. Nanomaterials (Basel, Switzerland), 2020, 10(7): 1365.
[21] 李燚彤,李佳璐,李梦薇,等. 有机磁性纳米二氧化钛光催化剂的制备及光催化性能[J]. 化学与黏合,2019,41(2):108-112.
Li Yitong, Li Jialu, Li Mengwei, et al. Preparation and photocatalytic activity of organic magnetic nano-titanium dioxide photocatalyst[J]. Chemistryand Adhesion, 2019, 41(2): 108-112. (in Chinese with English abstract)
[22] 张春晓,赵娇娇,关淑瑜,等. 纳米二氧化钛制备工艺的优化及光催化性能研究[J]. 化学工程师,2019,33(10):4-9.
Zhang Chunxiao, Zhao Jiaojiao, Guan Shuyu, et al. Optimization of preparation technology and photocatalytic performance of nano titanium dioxide[J]. Chemical Engineer, 2019, 33(10): 4-9. (in Chinese with English abstract)
[23] 王紫怡. 二氧化钛纳米材料的制备、改性及光催化性能研究[D]. 长春:吉林大学,2017.
Wang Ziyi. Preparation, Modified and Photocatalytic Performance Research of TiO2Nanomaterials[D]. Changchun: Jilin University, 2017. (in Chinese with English abstract)
[24] Yi J, Huang L, Wang H, et al. AgI/TiO2nanobelts monolithic catalyst with enhanced visible light photocatalytic activity[J]. Journal of Hazardous Materials, 2015, 284: 207-214.
[25] 郭敬维. TiO2光催化材料的制备、表征及在砷吸附中的应用[D]. 天津:天津大学,2010.
Guo Jing. The Preparation, Characterization of Photocatalysis Material TiO2and the Application in Arsenic Adsorption[D]. Tianjin: Tianjin University, 2010. (in Chinese with English abstract)
[26] Sathishkumar G, Gobinath C, Karpaga K, et al. Phytosynthesis of silver nanoscale particles usingL. and its inhibitory activity against human pathogens[J]. Colloids and Surfaces B-Biointerfaces, 2012, 95: 235-240.
[27] Tulip D, Aishwarya K K, Surya K, et al. Biosynthesis of silver nanoparticles usingL. as capping and reducing agents[J]. International Journal of Engineering Trends and Technology, 2012, 3(4): 24-34.
Optimization of the process for biosynthesis nano-TiO2 from mango leaf extract and its antimicrobial properties
Xu Qinglian1, Huang Ruihan1, Li Xuanlin1,2, Xing Yage1※, Shui Yuru1,2, Wu Lin1, Yu Jinze3
(1.,,610039,; 2.,,644004,; 3.,,,,300384,)
Fresh fruits and vegetables with a high content of water are easily lost to spoilage by a variety of microorganisms, resulting in short shelf life. Specifically, penicillium (P.) has been the most harmful and frequent disease in postharvest storage of fruits, such as mango and citrus, which are easily infected by moldy pathogens. Fortunately, the nano-TiO2particle has widely been used to preserve fruits and vegetables, due mainly to the high chemical stability and antibacterial properties. Two reasons can be attributed to the preservation mechanism. 1) Ethylene (C2H4) under ultraviolet (UV) irradiation has normally been decomposed into carbon dioxide (CO2) and water (H2O) in the fruits and vegetables packaging, where the concentration of CO2increases, while that of C2H4decreases. As such, the respiration and ripening rate of fruits and vegetables can be effectively delayed by the gas change, thereby controlling the water loss. 2) Microorganisms are composed of organic compounds, such as bacteria and fungi. Strong oxidation can denature the protein, thus inhibiting the growth of microorganisms or even killing, where Reactive Oxygen Species (ROS) has been produced by nano-TiO2under light conditions. Nevertheless, the biosynthesis of nanomaterials has attracted much more attention, with the highly demand for renewable and non-toxic chemicals in recent years. Correspondingly, the nano- TiO2biosynthesis can be assumed as a bottom-up approach, including the main reaction of reduction/oxidation without toxic chemicals involved in the synthesis process, particularly suitable for pharmacy, biomedicine, and food. In this study, nano-sized TiO2particles were prepared by biosynthesis, where the mango leaf extract was taken as the reducing agent, while metatitanic acid (TiO(OH)2) as titanium source. An investigation was also made to explore the effects of extraction times on the reduction ability of mango leaf extracts. Moreover, the Response Surface Method (RSM) in a single factor experiment was selected to optimize the biosynthesis process of nano-TiO2. The nano-TiO2particles were characterized by X-Ray Diffraction (XRD) and Scanning Electron Microscopy (SEM), together with antimicrobial properties against P.. The results showed as follows. The yield of nano-TiO2increased with the extension of extraction time when extracting mango leaves. Specifically, the yield of nano-TiO2was 86.74%, when the extraction time was 30 min, which was not significantly different from 87.62% and 87.93% when the extraction time was 40 and 50 min. An optimal combination of synthesis process was achieved, where TiO(OH)2addition 0.65 g, reaction time 10.2 h, calcination time 2 h, and calcination temperature 786 °C. In this case, the photoinduced degradation rate of nano-TiO2was 96.24%, and the standard deviation from the theoretical value was 0.6%. In addition, the XRD pattern demonstrated that the biosynthetic nano-TiO2was anatase type. SEM images showed that the TiO2nanoparticles obtained by biosynthesis were quasi-spherical, with the distribution of particle size in the range of 20-40 nm and fewer aggregates, but the modified nano-TiO2presented a smaller particle size and fewer aggregates, indicating the better dispersion. Furthermore, the biosynthesized TiO2nanoparticles exhibited a certain inhibitory effect on P., whereas, the modified nano-TiO2performed a better antimicrobial effect under the induction of ultraviolet (UV) light. More importantly, the modified nano-TiO2in composite coating behaved an obvious inhibitory effect on P.. Consequently, the biosynthesized nano-TiO2can widely be expected to serve as the preservation of fruits and vegetables to maintain the quality and prolong the storage life. This preparation process can provide a strong theoretical reference for the synthesis of nano-TiO2 with better photoinduced antibacterial properties.
storage; quality control; nano titanium dioxide; photoinduced; biosynthesis; antimicrobial activity
许青莲,黄锐函,李宣林,等. 芒果叶提取液生物合成纳米TiO2工艺优化及其抗菌性能 [J]. 农业工程学报,2021,37(18):281-289.doi:10.11975/j.issn.1002-6819.2021.18.032 http://www.tcsae.org
Xu Qinglian, Huang Ruihan, Li Xuanlin, et al. Optimization of the process for biosynthesis nano-TiO2from mango leaf extract and its antimicrobial properties[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2021, 37(18): 281-289. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2021.18.032 http://www.tcsae.org
2021-05-08
2021-07-12
农业农村部农产品贮藏保鲜重点实验室开放基金(kf202006);西华大学研究生创新基金(ycjj2019082);四川省科技厅重点研发项目(2019YFN0174,2018NZ0090,2019NZZJ0028,2017NFP0030);成都市科技局技术创新研发项目(2019-YF05-00190-SN,2019-YF05-00628-SN)
许青莲,实验师,研究方向农产品储藏保鲜技术。Email:775938414@qq.com
邢亚阁,博士,教授,研究方向果蔬贮藏保鲜与精深加工技术。Email:xingyege@163.com
10.11975/j.issn.1002-6819.2021.18.032
TS206.4
A
1002-6819(2021)-18-0281-09

