影像学检查在大便失禁病因诊断中的应用*
高勇,苏丹,张恒,万星阳,任东林
1 宁乡市人民医院肛肠外科 湖南长沙 410600
2 中山大学附属第六医院肛肠外科 广东广州 510655
大便失禁(fecal incontinence,FI)又称肛门失禁,主要表现为肛门不能随意控制排粪、排气、粪便污染衣裤并严重影响生活质量等的一系列症候群[1-2],Wexner肛门失禁评分常用于对FI严重程度及生活质量的评估[2-3]。FI发病原因主要包括先天因素和后天因素两个方面:先天因素包括脊柱裂、肛门直肠畸形及先天性巨结肠等;后天因素包括外伤,肛门直肠手术,直肠内套叠、直肠脱垂,炎性肠病、慢性腹泻,以及糖尿病、化疗、放疗及脊椎外伤等引起的神经病变等[4]。
FI的病因及发病机制复杂,临床表现多样,影像学检查对FI的临床诊断具有重要的意义,但单一检查往往效果有限,通常需要联合使用多种检查,这对于选择后续治疗方案也有着良好的指导意义[5-6]。直肠腔内超声(endoanal ultrasonography,EUS)能良好反映肛门括约肌、耻骨直肠肌等的结构病变,盆底超声(transperineal ultrasound,TPUS)可用于评估女性患者的盆底结构状态,肛管MRI成像可清楚显示肛管及肛周解剖结构,3D肛管直肠测压【high-definition(3D)anorectal manometry,3D HDARM】可用于评估直肠和肛管括约肌区域的压力与活动状态,动态MRI排粪造影(dynamic magnetic resonance defecography,DMRD)可较为全面评估盆底器官结构病变及功能异常,而X线排粪造影在明确FI发病因素中也有着重要的作用。
本文对38例FI患者的临床资料进行简要回顾,基于典型病例的病史、专科检查及影像学检查资料分享笔者团队的临床实践经验,并结合已有文献就影像学检查在FI病因诊断中的应用进行探讨,与同道交流。
1 总体情况
回顾性分析2016年6月至2021年6月于中山大学附属第六医院就诊的38例FI患者的临床资料及影像学资料。其中男性21例,女性17例;年龄9~76岁,中位年龄27(18,42)岁;病程0.25~480个月,中位病程48(15,120)个月;有10例患者已行结肠造口术,无法进行Wexner肛门失禁评分,余28例患者入院时Wexner肛门失禁评分为8~20分,平均评分为(16.3±3.8)分。
笔者团队根据患者病史及专科检查情况,向患者作完善影像学检查的建议,在该38例患者中,最终28例完成X线排粪造影,28例完成HD-ARM,27例完成肛管MRI成像,17例完成EUS,3例完成DMRD,2例完成TPUS。
结合影像学检查结果,该38例患者在FI病因分布方面,有12例考虑为先天性疾病,10例考虑为车祸及异物刺伤,8例考虑为医源性损伤,5例考虑为原发性FI,3例考虑与分娩有关。
2 典型病例
2.1 病例 1
车祸外伤患者,女性,42岁,因“大便无法控制污裤20年”就诊。临床表现为固体粪便及气体经常不能完全控制,稀便时常无法控制,污染内裤,排粪3~5次/日,严重影响日常生活。入院时Wexner肛门失禁评分18分。
专科检查:肛门左后方及左侧臀部大面积陈旧性手术瘢痕,肛周皮肤红肿明显并可见湿疹样皮损,未见分泌物附着,肛门口可见直肠黏膜外翻,黏膜无出血。直肠指诊:肛管直肠环纤维化明显,触之质软,嘱患者做排粪动作及提肛动作时可及肛管括约肌舒缩乏力,括约肌张力降低。
诊断过程中考虑患者既往外伤史,肛周解剖结构发生破坏、肛门功能受到影响,故建议并完善EUS、肛管MRI成像及HD-ARM检查。EUS(图1)示:肛管内外括约肌缺如(橙色箭头处反映肛管外括约肌缺如,蓝色箭头处反映肛管内括约肌缺如)。肛管MRI成像(图2)示:肛门变形,直肠下段—肛管右偏;肛管内外括约肌缺如,右侧肛提肌纤细(蓝色箭头处)。HD-ARM(图3)示:1.肛管括约肌平均静息压力降低,最大收缩压力降低,肛周括约肌彩色压力带分布欠均匀;2.模拟排粪时,肛管不能有效舒张;3.直肠肛门抑制反射正常;4.直肠黏膜敏感性升高。

图1 EUS检查所见
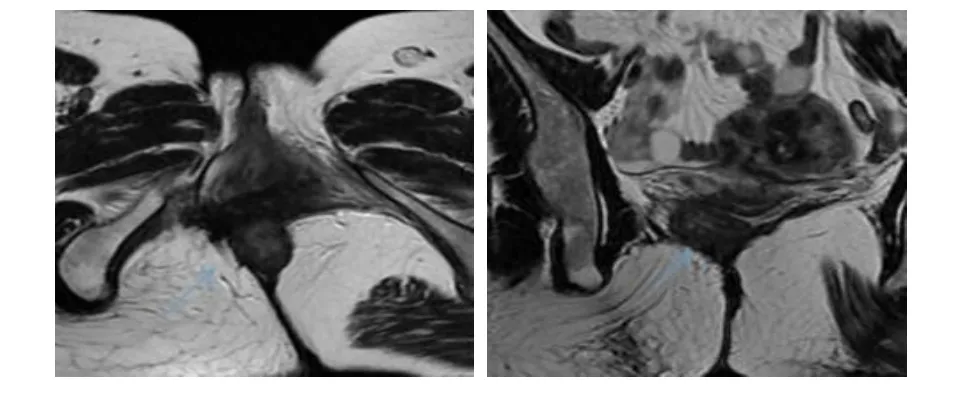
图2 肛管MRI成像检查所见

图3 HD-ARM检查所见
2.2 病例 2
骶尾部直肠间质瘤切除术后患者,男性,65岁,“因粪便无法完全控制4年余”就诊。临床表现为控便能力下降,有时无法控制固态粪便、液态粪便及气体,有时粪便污染内裤,影响正常生活。入院时Wexner肛门失禁评分10分。
直肠指诊:嘱患者做模拟排粪动作及提肛动作时可及肛管括约肌收缩功能下降。
诊断过程中考虑患者既往直肠部位手术史,肛门解剖结构损伤相继影响肛门功能,故建议并完善EUS、肛管MRI成像、HD-ARM检查。EUS(图4)示:肛管周围截石位4至9点钟方向肛管内、外括约肌及部分耻骨直肠肌正常肌纤维回声消失,仅见纤薄低回声带(蓝色箭头处)。肛管MRI成像(图5)示:肛管内外括约肌、左侧耻骨直肠肌深部局部缺失,左侧肛提肌浅部菲薄(蓝色箭头处),考虑术后改变。HD-ARM(图6)示:静息时,仅肛管后方局部有压力带显示,且呈不均匀分布。
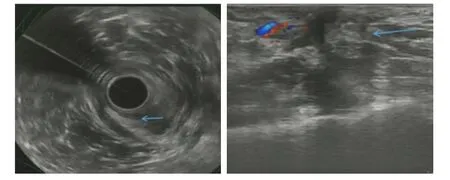
图4 EUS检查所见
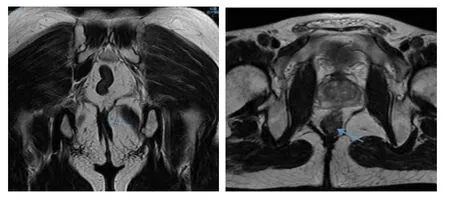
图5 肛管MRI成像检查所见
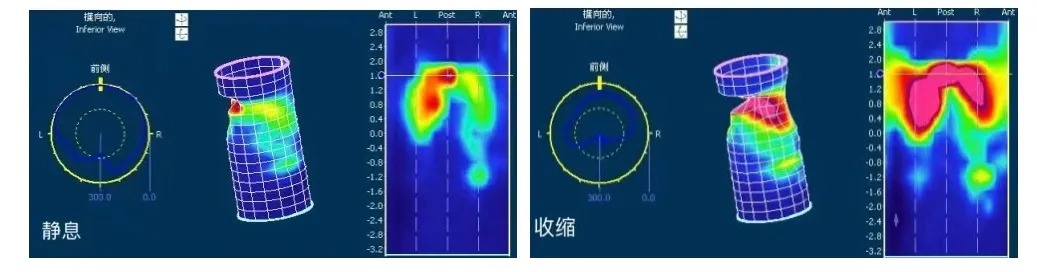
图6 HD-ARM检查所见
2.3 病例 3
先天性肛门闭锁术后患者,男性,27岁,因“先天性肛门闭锁术后粪便无法控制27年”就诊。入院时Wexner肛门失禁评分20分。
直肠指诊:直肠黏膜尚光滑,未触及肿物,嘱患者做模拟排粪动作及提肛动作时可及肛管括约肌舒缩乏力,括约肌张力降低。
诊断过程中考虑患者先天性肛门闭锁病史,存在先天性解剖结构异常及手术后继发性损伤,肛门功能相应受到影响。故建议并完善EUS检查及肛管MRI成像。EUS检查(图7)示:考虑肛管外括约肌中断可能(橙色箭头处)。肛管MRI成像检查(图8)示:先天性肛门闭锁术后,肛管内括约肌连续、菲薄,肛管外括约肌局部不连续,左侧肛提肌局部菲薄(蓝色箭头处)。
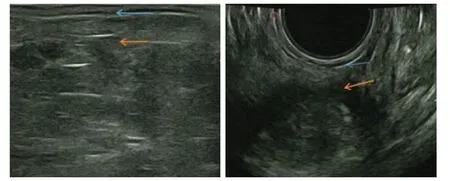
图7 EUS检查所见
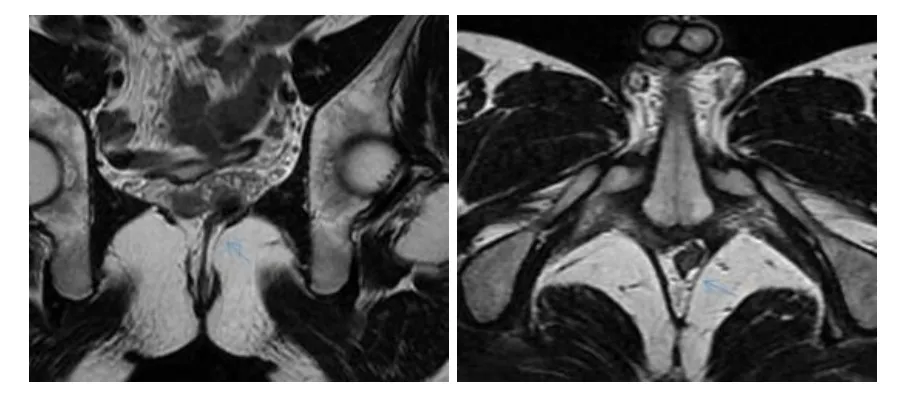
图8 肛管MRI成像检查所见
2.4 病例 4
原发性FI患者,女性,42岁,因“肛门无法控制粪便1年余”就诊。临床表现为肛门不能控制排粪,粪便自肛门流出自己不知,随时污染内裤。入院时Wexner肛门失禁评分20分。
专科检查:嘱患者做模拟排粪动作及提肛动作时可及括约肌张力降低、收缩乏力。
诊断过程中考虑患者无明显确定发病因素,故建议并完善EUS、DMRD、X线排粪造影及HD-ARM检查。EUS(图9)示:肛管内外括约肌及肛提肌未见中断(蓝色箭头处反映内括约肌连续,橙色箭头处反映外括约肌连续),肛提肌裂孔面积增大(黄色箭头处)。DMRD(图10)示:全盆底疝(腹膜疝、膀胱脱垂、子宫脱垂,直肠轻度前突)。X线排粪造影(图11)示:直肠轻度前突及会阴下降(蓝色箭头示会阴下降,橙色箭头示直肠前突)。HD-ARM(图12)示:肛管直肠环紧张度正常,收缩功能减弱,考虑肛周括约肌功能减弱,以肛管前方减弱明显。

图9 EUS检查所见

图10 DMRD检查所见
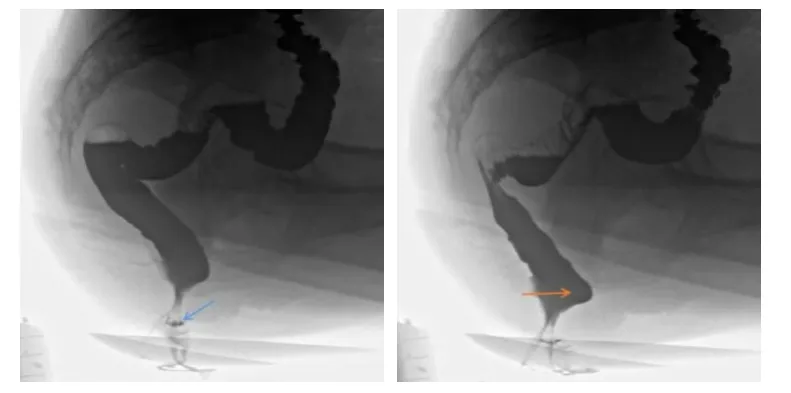
图11 X线排粪造影检查所见
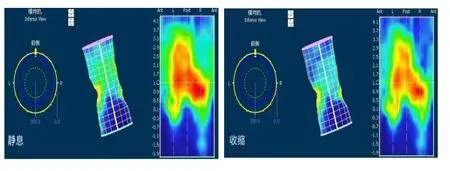
图12 HD-ARM检查所见
3 讨论
在FI诊断方面,目前临床中常用的影像学检查技术主要包括EUS、TPUS、肛管MRI成像、DMRD、X线排粪造影及HD-ARM等。FI的发病因素多样,FI严重程度及临床症状不同的患者中往往有着不同的表现,基于患者的病史及专科检查结果,选择完善相应的影像学检查,可以为疾病诊断提供更为全面的信息,是提高疾病诊治水平的有力工具。
EUS操作简单但同样依赖检查者的技术水平,该项检查可为肛管周围解剖结构的评估提供良好的参考信息[7-8],加之其价格相对便宜,在临床中得以广泛应用,在括约肌损伤或先天性疾病所致FI患者中,往往可检出括约肌缺如,或提示肌肉回声中断,但EUS不适用于肛门狭窄患者。TPUS在女性患者盆底结构的评估中也有着良好的应用价值,可用于观察静息状态、Valsalva动作状态下的肛直角,静息状态下以及Valsalva动作状态下测得的盆膈裂孔前后径、左右径、面积、周长值。检出肛提肌裂孔面积增大对诊断盆腔器官脱垂有提示作用,这在评估女性后盆腔脱垂的严重程度方面有很好的参考价值[9-10]。
肛管MRI成像在肛管及肛周解剖结构显示的清晰度方面有优势,在临床中常用于考虑肛管及肛周解剖结构异常所致FI患者,这对制定治疗方案也有着良好的指导作用[11-12]。尤其是肛门直肠畸形手术,手术前后肛管MRI成像对比可以显示肛周肌肉的解剖形态及完整度[13-15],这对于FI手术疗效评估至关重要,但幽闭恐惧症患者以及安装了心脏起搏器、除颤器和其他金属植入物的患者并不适用。DMRD是一种相对较新的成像方案,在诊断盆底解剖结构异常及盆底功能障碍性疾病方面有优势,如器官脱垂、盆底失弛缓综合征和FI等,就目前来说,是最为理想的检查手段[16]。该项检查基于其静动态扫描序列,借助足够的空间和时间分辨率可显示排粪过程盆底细微的形态学变化和功能状态,其与X线排粪造影相比,可提供较为全面的诊断信息[17-20]。临床上主要将X线排粪造影用于排粪障碍性疾病的辅助诊断,但对于合并直肠前突及直肠脱垂的FI患者,该项检查同样可以提供富有价值的参考信息[21-22]。
HD-ARM指经压力感受器将导管所受到的压力变化,经压力换能器转变为电信号后再显示为直肠肛管压力形态图,可实现对肛管静息压、最大收缩压、肛管高压带长度、排粪迟缓反射、直肠肛门收缩反射、直肠肛门抑制反射以及直肠感觉功能等的检测,所得结果可用于辅助判断肛管括约肌损伤程度,比如该检查可以形象反映先天性肛门直肠畸形患者肛管括约肌缺损情况及其术后肛门情况[23-24]。HD-ARM可用于指导FI的治疗,包括保守治疗和手术治疗[25],也可用于FI手术前后肛门括约肌功能评估、生物反馈治疗效果评价[26-29]。在纵向评估方面,目前已有研究证实HD-ARM检查结果可作为女性患者肛管静息压及最大收缩压的纵向评估数据参考[30]。但该检查对部分指标的检测效能偏低,比如肛管最大收缩压,不能反映排粪时肛门外括约肌的实际最大压力(并非生理排粪状态测得),且正常人群也可检出异常值,检查技术还有待进一步改良[31]。
临床对于FI病因的探讨包括解剖形态学和功能共两个方面。在解剖形态学方面,有学者认为可先行HD-ARM检查,再借助EUS和肛管MRI成像评估内外括约肌及肛提肌的损伤情况及程度[32]。但临床中因肛管MRI成像检查价格相对昂贵,也有部分患者因个人原因未能完成肛管MRI成像检查导致该检查的应用不及EUS广泛,相应地,EUS则由于其价格较低、便捷等特点使其更受推崇,也有研究认为EUS和肛管MRI成像用于评估肛管括约肌解剖结构的效能相似[33]。在功能方面,DMRD可通过动态扫描序列观察排粪过程中相关解剖结构的异常变化,以助于更为全面地分析FI的发病原因及机制,同时可以检出盆底其他重要结构的异常(包括直肠前突、会阴过度下降)和观察器官的运动。由肛门周围解剖结构异常引起的功能变化,在HD-ARM压力形态图中也可得以客观反映。
目前,FI缺乏诊断、治疗的统一标准,临床医师根据个人经验及患者病史、专科检查结果向患者作出进一步完善影像学检查的建议,需要考虑检查的检测效能、针对性及患者的经济状况,这就需要临床医师良好掌握不同的影像学检查手段的应用特点及操作要点,方能施行有效且富有针对性的检查,提高疾病诊治水平。在本次纳入分析的38例患者中,笔者团队在充分了解患者病史、详细完成对患者的专科检查后,向患者提出完善影像学检查的建议,最终的检查完成情况为明确FI病因提供了富有诊断价值的参考信息,这对于后续患者的治疗方案制定也有着重要的意义。我们还需要关注的是,FI治疗周期长,实现治疗效果的动态追踪需要保持良好的医患互动并保持患者高度的依从性,遗憾的是临床中往往难以实现。建立完善的FI患者管理框架及流程,无论是对患者还是对开展临床研究都是非常重要的,当中如何将影像学检查的助益实现最大化,同样是值得思考的问题。

