云南汉族人群Tim-3基因启动子区多态性与支气管哮喘的关联研究
彭传梅,王 杨,高 辉,曹向红,董玉琳,陈婉婷,鲁祥辉,狄 勇
(1.昆明医科大学附属延安医院 医学检验科,云南 昆明650051;2.昆明医科大学基础医学院 生物化学与分子生物学系,云南 昆明650500)
支气管哮喘(Asthma)是呼吸系统常见病,是以呼吸道慢性炎症为特征的异质性疾病[1-2]。已有研究证明支气管哮喘受到周围环境及致病基因的调控,具有较高的遗传性和特异性[3]。其最大特征是伴随环境的变化,发病时特异性IgE或总IgE出现明显的升高[4],同时一部分免疫因子,尤其是Th1和Th2细胞的失衡可进一步促使体内IgE异常升高[5-6],通过全基因组扫描技术已发现多个染色体区域与支气管哮喘发病密切相关,如 16p12、11q12-22、6q21、1q31-32、5q31-33、等,其中以5q31-33区最受关注[7]。
T细胞免疫球蛋白黏蛋白(Tim)家族是2001年由Mclntire团队发现的新家族[8]。在人类中已鉴定3个成员:Tim-1,Tim-3和Tim-4,位于人类染色体5q33.2区域。Tim-3是Tims基因家族重要的一员,其主要作用为调节免疫反应,在外界环境和特殊的细胞因子的刺激作用下,出现Th1类细胞的增殖和和活化受到明显抑制,导致Th2类细胞明显增多,出现免疫失衡[9]。Tim-3的表达及基因多态性与多种疾病相关,如:支气管哮喘、类风湿性关节炎、系统性红斑狼疮等[10]。由于研究人群遗传背景的不同及人群分层的影响,关于Tim-3基因与哮喘易感性的关联存在不同的意见,因此我们对云南地区汉族健康和哮喘人群Tim-3基因启动子区-1516G>T和-574T>G位点的单核苷酸多态性及其与Tim-3 mRNA水平、血浆IgE水平的联系进行研究,探讨这些位点多态性及mRNA水平与支气管哮喘易感性之间的关联性。
1 资料与方法
1.1 研究对象收集2017年1月至2019年12月之间昆明医科大学附属延安医院收治的180名汉族支气管哮喘患者(BA组,男44例,女136例,年龄24-84岁)以及180名健康体检者(control组,男96例,女84例,年龄21-87岁)。选取的支气管哮喘患者符合中华医学会呼吸学分会哮喘学组制定的支气管哮喘诊断标准(2008年)。具体如下:(1)反复发作的喘息、气急、胸闷或咳嗽,多与接触变应原、冷空气、物理、化学性刺激以及病毒性上呼吸道感染、运动等有关;(2)发作时在双肺可闻及散在或弥漫性,以呼气相为主的哮鸣音,呼气相延长;(3)上述症状和体征可经治疗缓解或自行缓解;(4)除外其它疾病所引起的喘息、气急、胸闷和咳嗽;(5)临床表现不典型者(如无明显喘息或体征),应至少具备以下1项试验阳性:①支气管激发试验或运动激发试验阳性;②支气管舒张试验阳性,1秒钟用力呼气量(FEV1)改变>20%,且FEV1增加绝对值>200 ml;③呼气流量峰值(PEF)日内变异率>20%。符合1-4条或4、5条者可诊断为支气管哮喘。对照组为云南省汉族180名体检健康者,彼此没有血缘关系,没有干扰实验结果的病史,同时血清的IgE表达水平没有明显的异常。每位受试人群都已经签署了知情同意书,每位受试者采集EDTA抗凝静脉血3 ml。
1.2 基因组DNA提取采用人全血基因组DNA提取试剂盒(Omega,美国),对支气管哮喘患者及健康体检者外周血基因组DNA进行提取。提取产物溶于30 μl无菌超纯水中,检测浓度和纯度,-20℃保存。
1.3 样本RNA提取取支气管哮喘患者及健康体检者外周血,利用人外周血淋巴细胞分离液(Solarbio,中国)对样本全血进行淋巴细胞分离。取上层淋巴细胞,采用总RNA提取试剂盒(Omega,美国),严格按照说明书规则进行RNA的提取。提取产物溶于20 μl无菌DEPC水中,检测浓度和纯度,-80℃保存。
1.4 样本RNA逆转录利用M-MLV First Stand cDNA Synthesis试剂盒(Omega,美国)对所提的RNA进行逆转录成cDNA,反应条件为42℃ 60 min。
1.5 Tim-3相关片段PCR利用Kodaq 2×PCR MasterMix试剂盒(ABM,美国)对基因组突变位点的片段进行PCR,PCR引物及相应的退火值见表1。PCR反应条件:95℃预变性5 min; 95℃ 40 s,52-60℃ 40 s,72℃ 30 s 35个循环;最后72℃ 延伸10 min。
1.6 PCR片段酶切鉴定PCR产物用内切酶(-1516 G>T用BslI,-574 T>G用TaqI)(Omega,USA)酶切:PCR产物5 μl,10×酶切缓冲液1 μl,限制性内切酶2U,灭菌双蒸水3.9 μl,混匀,BslI酶切条件为55℃酶切1 h;TaqI酶切条件为60℃酶切1 h。酶切产物用2%琼脂糖电泳、EB染色,观察条带。根据电泳图确定基因型。
1.7 Tim-3 熔解曲线对基因多态性分析选取样本基因组DNA 400 ng,Melt 分析时,设置温度45-75℃;选择Continuous模式时每步设置1%。检测荧光;每个步骤升高0.3℃,在每个温度都在收集荧光。荧光检测通道选择FAM检测通道,根据熔解曲线的退火温度和特异性进行基因型的判断,并结合PCR-RFLP结果进行基因型统计。
1.8 Tim-3 qRT-PCR相对定量分析取等量的样本RNA逆转后的cDNA,严格按照EvaGreen 2×qPCR MasterMix试剂盒(ABM,美国)说明书,对各组样本cDNA进行qPCR,PCR引物见表2,qPCR反应条件为95℃10 min;95℃15 s,60℃60 s,72℃30 s,40 cycles;72℃10 min。按照ABI7500后续程序进行荧光值的吸收和熔解曲线的完成。每份标本均得到Ct值。Tim-3 mRNA 的相对表达量以Ct值与GAPDH 的Ct值比值表示。
1.9 人血浆免疫球蛋白E测定对病人全血进行离心,取上层血浆,利用人血浆免疫球蛋白E测定试剂盒(Siemens,德国)在全自动特定蛋白分析仪(BN ProSpec System)系统中自动检测人血浆免疫球蛋白E(IgE)表达水平,记录并进行差异比较。
1.10 统计学处理采用统计学软件 SPSS18.0软件进行处理和分析,采用直接计数法计算基因型和等位基因频率,采用 Hardy- Weinberg方法进行遗传平衡性检验。基因型和等位基因的组间比较采用χ2检验。计量实验数据以多次检测平均值±标准差表示,实验结果重复至少3次。采用 Student’s two-tailed t-test 进行统计学分析,P<0.05为差异具有统计学意义。

表1 PCR-RFLP引物及退火值

表2 qRT-PCR引物
2 结果
2.1 Tim-3启动子区-1516G>T和-574 T>G采用PCR-RFLP分析
Tim-3 -1516 G>T位点PCR产物长度为404 bp,酶切后对应分型如下(图1A):(1)纯合子GG基因型:有338 bp、66 bp 2个片段;(2)杂合子GT基因型:可见404 bp、338 bp和66 bp 3个片段;(3)纯合子TT基因型:只有404 bp 1个片段。
Tim-3 -574 T>G位点PCR产物长度为169 bp,酶切后对应分型如下(图1B):(1)纯合子TT基因型:有132 bp、37 bp 2个片段;(2)杂合子TG基因型:可见169 bp、132 bp和37 bp 3个片段;(3)纯合子GG基因型:只有169 bp 1个片段。
2.2 熔解曲线法对Tim-3基因多态性的判定
对样本基因组DNA进行qPCR检测,发现特定的基因型具有相对固定的熔解曲线及退火温度(Tm)值。如图2A所示,Tim-3-1516GG的熔解曲线Tm值在84±0.3℃;Tim-3-1516TT的Tm值在83.1±0.35℃;Tim-3-1516GT的熔解曲线则出现双峰,分别80.2±0.3℃和84.9±0.3℃。如图2B所示,Tim-3-574GG的熔解曲线Tm值在85.7±0.4℃;Tim-3-574TT的Tm值在84.1±0.4℃;Tim-3-574GT的熔解曲线则出现双峰,分别79.9±0.3℃和85.3±0.3℃。
2.3 基因型与等位基因频率分布
根据酶切电泳和熔解曲线的分析,对患者和健康人群样本的基因分布进行分析。Tim-3-1516G>T位点和-574T>G位点基因型分布、支气管哮喘组和健康体检组基因分布符合Hardy-Weinberg遗传平衡规律(P>0.05)(表3)。χ2检验结果显示:支气管哮喘组与健康体检组Tim-3-1516G>T和Tim-3 -574T>G位点基因型和等位基因频率分布差异均具有统计学意义(P<0.05),见表4。
2.4 Tim-3 mRNA的表达在不同组和不同基因型之间的差异
我们利用淋巴细胞分离液将样本全血中的淋巴细胞分离出来,并提取淋巴细胞总RNA.对RNA进行定量后,选取等量RNA逆转录成cDNA。以等量cDNA作为模板进行qPCR,对Tim-3 mRNA表达水平进行相对定量和比较分析。结果如图3,支气管哮喘组(BA)的Tim-3 mRNA表达水平明显高于健康体检组(control),是健康体检组的3.19±1.21倍(图3A)。BA组Tim-3-1516G>T位点TT基因型mRNA水平是GG型和GT型的1.69±0.41倍和1.83±0.44 倍,差异具有统计学意义(P<0.001)。Tim-3-574T>G位点TT基因型mRNA水平是GG型和GT型的1.76±0.18倍和1.81±0.23倍,差异具有统计学意义(P<0.01,P<0.05)(图3B)。

图1 Tim-3-1516G>T和-574 T>G PCR-RFLP电泳图A:分别为Tim-3-1516G>T 位点GG/GT/TT酶切结果 B:分别为Tim-3-574 T>G 位点TT/GT/GG酶切结果

图2 Tim-3-1516G>T和-574 T>G位点不同基因型的熔解曲线A:分别为Tim-3-1516 G>位点GG/TT/GT熔解曲线及退火值 B:分别为Tim-3-574T>G位点GG/TT/GT熔解曲线及退火值

表3 Tim-3基因两位点基因型频数分布的Hardy-Weinberg遗传平衡检验

表4 Tim-3基因两位点基因型频率及等位基因频率
2.5 IgE的表达在不同组和不同基因型之间的差异
我们对样本血清中的IgE进行检测。结果如图4,支气管哮喘组(BA)的IgE表达水平明显高于健康体检组(control),是健康体检组的5.97±3.02倍(图4A)。BA组Tim-3-1516G>T位点GT基因型IgE表达高于GG型,是GG型1.29±0.16倍,差异具有统计学意义(P<0.05)。Tim-3-574T>G位点 GG和GT基因型样本的IgE表达高于TT型,其表达量分别是是TT型的1.34±0.43倍和1.37±0.39倍,差异具有统计学意义(P<0.05)(图4B)。
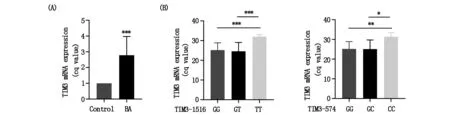
图3 Tim-3 mRNA的表达在不同组和各位点不同基因型之间的差异(1)quantification cycle(Cq)值为qPCR模板扩增循环数,Δcq值=待测样本cq值-内侧(GAPDH)cq值 (2)*P<0.05,**P<0.01,***P<0.001

图4 不同组和各位点不同基因型之间IgE表达的差异***P<0.001,*P<0.05
3 讨论
支气管哮喘是全球范围内呼吸系统常见病之一。 近年来,支气管哮喘的防治和机理研究有很多突破性进展,但支气管哮喘在世界范围内的发病率仍然不断上升,严重影响了人类的健康,危害人类的生命。支气管哮喘发生与遗传密不可分,48%-79%的患者与家族遗传密切相关,表现为家族聚集性[11]。因此支气管哮喘也被认为是一种多基因遗传病,它是受基因、环境等诸多因素共同调控的[12]。
目前的研究中已经发现与支气管哮喘致病有关的基因有数百个,其中关于Tim-3与免疫调节的关系则是研究的热点之一。Tim-3作为T细胞免疫球蛋白黏蛋白(Tim)家族中的一员,Tim-3主要在分化成熟的Th1细胞中高度表达,通过与其配体Galectin-9结合,调控Th1细胞的免疫应答。Tim-3可以抑制Th1的免疫作用。有研究表明,Tim-3的过度活化和启动子基因突变与免疫性疾病的发生发展密切相关。Tim-3及其配体Galectin-9可以明显抑制Th1细胞的活化,从而打破了Th1和Th2细胞的平衡,激发了Th2细胞的过度活化,引起了Th2细胞介导为主的疾病发生,例如支气管哮喘等过敏性疾病。Zhang等[13]报道了湖北省成年人群Tim-3基因-1516G>T和-574T>G两个SPN位点的基因分布与支气管哮喘之间的关系。采用了限制性片段长度多态性聚合酶链反应(PCR-RFLP)技术发现,在健康体检人群中3个基因型GG、GT 和TT频率分别为99.2%、0.8%和0,支气管哮喘病人组分别为94.1%、5.9%和0,具有显著差异。从而证明湖北省人群Tim-3-1516G>T和-574T>G两个基因位点的SNP与支气管哮喘有明显的关联。在动物哮喘疾病模型中证实Tim-3 mRNA表达的上调,同时利用流式细胞术检测小鼠外周血和肺泡灌洗液中Tim-3+/CD4+的细胞比例明显增大,证实了Tim-3表达的升高,在哮喘发生发展中的重要作用[14]。
本研究选择了云南省汉族人群,其受遗传背景的不同及人群分层的影响,关于Tim-3基因与支气管哮喘易感性的关联可能有不同的结论。结果表明支气管哮喘组和对照组Tim-3启动子区多态性位点-1516G>T和-574T>G的基因型及等位基因频率差异在支气管哮喘病人组和健康体检组之间具有统计学意义(P<0.05);支气管哮喘组的Tim-3 mRNA表达明显高于健康体检组(P<0.05);支气管哮喘组血浆IgE表达明显高于健康体检组(P<0.001);支气管哮喘病人两位点TT基因型Tim-3 mRNA表达水平均高于GT型和GT型;携带Tim-3-1516 GT基因型的支气管哮喘病人,IgE表达高于GG基因型,携带Tim-3-574GG和GT的支气管哮喘病人,其IgE表达明显高于携带Tim-3-574TT基因型的病人。因此,我们认为Tim-3启动子区多态性位点-1516G>T和-574T>G的基因多态性均与支气管哮喘遗传易感性相关,两位点不同基因型会影响支气管哮喘患者Tim-1和Tim-3 mRNA的表达水平及机体IgE的水平。
本研究的完成有助于根据Tim-3基因型预测本省人群对支气管哮喘这类过敏性疾病的易感性,对这类复杂疾病易感人群的筛选、发病的风险评估、早期干预防治以及开发药物治疗靶标提供科学依据。

