HIST1H3B表达量变化对结直肠癌细胞功能的影响
刘佳琦,王 海,李凯迪,魏丽萍,齐 新
(吉林大学中日联谊医院 检验科,吉林 长春130033)
结直肠癌患者早期无症状,待有症状时往往是晚期,故早期筛查尤为重要,大便隐血试验、钡剂灌肠造影等为传统的筛查手段,现可利用肿瘤标志物、结直肠镜进行筛查[1-2]。本实验旨在通过各种细胞功能实验探究HIST1H3B表达量变化对结直肠癌细胞功能的影响。
1 材料与方法
1.1 细胞、试剂和仪器
SW1116细胞为人结直肠癌细胞株,购于中国科学院上海生命科学研究院细胞资源中心,DMEM培养液和胎牛血清购自美国Gibco公司,HIST1H3B过表达质粒(pEGFP-N1-HIST1H3B)及其阴性对照(pEGFP-N1)委托生工生物(上海)有限公司合成,小干扰RNA购于生工生物(上海)有限公司,HIST1H3B抗体购自美国signalway antibody,HRP-羊抗兔IgG购自美国CST,Transwell染色试剂盒购自中国Biosharp生物科技有限公司,Lipofectamine 2000购自美国Thermo Fisher scientific。
1.2 方法
1.2.1细胞培养和转染 从液氮中取出冻存的SW1116细胞,加入含10%胎牛血清DMEM完全培养液,混匀,制成细胞悬液,注入培养皿,在37℃、含5% CO2的细胞培养箱中培养,待细胞贴壁生长达到培养皿底面积的 80%-90%时传代。根据Lipofectamine 2000 转染试剂说明书分别进行质粒转染和siRNA 转染,通过脂质体转染技术,构建了HIST1H3B的过表达和沉默表达细胞株,在转染开始前,将每种细胞分为6组,分别转染过表达HIST1H3B质粒(OvHIST1H3B组),无质粒的pEGFP-N1空载体组(OvCtrl组),无处理的空白组(Blank组),沉默表达位点1组(siHIST1H3B.1组),沉默表达位点2组(siHIST1H3B.2组)和沉默表达阴性对照组(siCtrl组)。si-HIST1H3B序列设计具体如下,
siHIST1H3B.1:sense(5’-3’)AGGGCUCUUUGAGGACACAAATT,
antisense(5’-3’)UUUGUGUCCUCAAAGA-GCCCUTT;
siHIST1H3B.2:sense(5’-3’)CGGCGGUAAAGCGCCACGCAATT,
antisense(5’-3’)UUGCGUGGCGCUUUACCGCCGTT。
1.2.2实时荧光定量PCR 收集SW1116细胞沉淀,提取细胞的总RNA,后反转录获得cDNA,冰上准备qPCR反应液,轻柔混合qPCR反应液,短暂离心,按说明书要求将反应液加入PCR八连管中,根据三步法PCR程序开始qPCR反应,具体反应条件为95℃预变性10min,95℃高温变性10 min,55℃-60℃低温退火20 min,共40个循环,72℃室温延伸20 min。引物序列为,
HIST1H3B引物:
Forward 5’ CCAAGACTTCAAGACCGATC-TT 3’,
Reverse 5’ GGGCATAATAGTCACTCGCTTA 3’;
GAPDH引物:
Forward 5’ CCGTATGGGACGCCTGGTTA 3’,
Reverse 5’ CCGTGGGTAGAGTCATACTGGAAC 3’。
1.2.3Western blot 收集细胞,加入配置好的裂解液冰上裂解30 min,裂解完毕后使用移液器将培养皿内液体混合物收集到预冷的离心管中离心,获得总蛋白样品,配制BCA工作液,将样品加入96孔板,再加入BCA工作液,使用酶标仪测量样品在562 nm处的吸光度。并根据吸光度绘制蛋白质浓度标准曲线,计算蛋白质浓度。计算60 μg蛋白样品所需上样体积上样,SDS-PAGE蛋白电泳分离蛋白,然后利用湿转法,将蛋白转移到PVDF膜上,立即将PVDF膜浸入含5%脱脂奶粉的PBST中,4℃,封闭2 h,将封闭好的PVDF膜浸入到稀释后的一抗(1∶2 000)中,4℃摇床过夜,PBST清洗5次,每次5 min,后将清洗后的PVDF膜浸入稀释后的二抗(1∶3 000)中,室温摇床孵育1 h。ECL发光工作液覆盖全膜后显影、曝光。并使用ImageJ软件对图像进行定量分析。
1.2.4Transwell实验检测细胞的迁移及侵袭能力 使用胰酶收集转染后的细胞,使用无血清培养液重悬细胞后调整细胞密度为5×105/ml,接种于 Transwell小室的上室中,取500 μl完全培养液于下室中,培养24 h后取出小室用PBS清洗,使用细胞固定液固定15 min,加入染色液进行染色10 min,待小室自然干燥后,置于显微镜镜下观察,200倍显微镜下,每个样品随机选取5个视野,计数视野中的细胞数。将matrigel胶置于4℃冰箱中过夜,按说明书要求将matrigel胶使用无血清培养液稀释至20-30 μg/ml,取100 μl稀释后的matrigel胶加入到transwell小室的上层,置于细胞培养箱培养1 h。使用胰酶收集转染后的细胞后,剩余步骤同transwell迁移实验。
1.2.5统计学方法 计量资料数据的结果以均数±标准差表示,对于符合正态分布的计量资料各组间的比较采用单因素方差分析。利用SPSS20.0统计学软件进行分析,利用GraphPad Prism 8软件绘制统计图,P<0.05为差异具有统计学意义。
2 结果
2.1 HIST1H3B过表达和沉默表达细胞株的构建
在细胞转染后分别提取总RNA、蛋白。使用RT-qPCR技术和Western blot分别检测构建的细胞株中的HIST1H3B 在mRNA(见图1)和蛋白质(见图2)表达水平的变化评估过表达和沉默表达细胞株是否构建成功。图1中A、B为转染后SW1116细胞株中各组细胞的HIST1H3B的mRNA表达水平。图2中A、B为转染后SW1116细胞株中各组细胞的HIST1H3B的蛋白表达水平。C、D为转染后SW1116细胞株中各组细胞的HIST1H3B的蛋白表达水平的定量分析。
结果显示在SW1116细胞株中,相较于Blank组,OvHIST1H3B组的HIST1H3B的mRNA和蛋白质水平显著上调。OvCtrl组相较于Blank组在mRNA和蛋白的表达水平上无统计学差异。同时,相较于Blank组,siHIST1H3B.1组HIST1H3B的mRNA及蛋白质水平明显降低。siHIST1H3B.2组HIST1H3B的蛋白质的表达量变化无统计学差异。siCtrl组的HIST1H3B相较于Blank组在mRNA和蛋白的表达量变化无统计学差异。所以选择siHIST1H3B.1组进行后续试验。
2.2 HIST1H3B的表达水平对结直肠癌细胞迁移、侵袭的影响
通过transwell迁移实验检测HIST1H3B表达量变化对细胞迁移能力的影响。结果显示如图3,在SW1116细胞株中,相对于Blank组,OvHIST1H3B组的细胞的迁移能力明显增强(P<0.01)。Blank组与OvCtrl组间迁移的细胞数量无统计学差异(P>0.05)。相较Blank组,siHIST1H3B.1组的细胞迁移能力明显减弱(P<0.01)。Blank组与siCtrl组间迁移的细胞数量无统计学差异(P>0.05)。
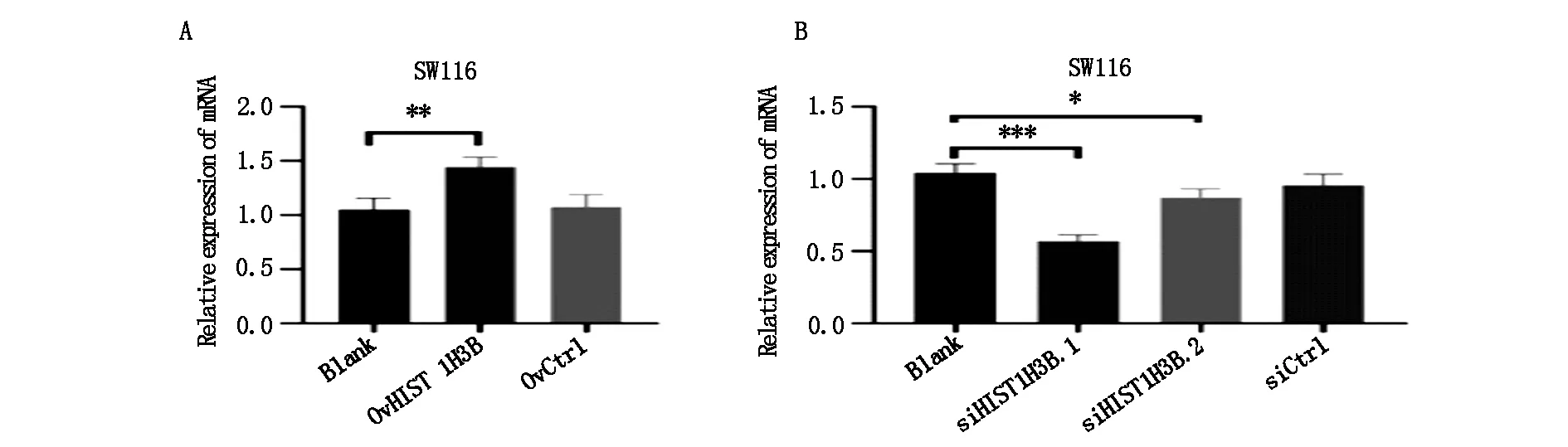
图1 RT-qPCR法检测转染后HIST1H3B在SW1116的表达情况注:P值为各组与Blank组相比较;且***P<0.001,**P<0.01,*P<0.05

图2 Western blot法检测转染后HIST1H3B在SW1116的表达情况注:P值为各组与Blank组相比较;且***P<0.001,**P<0.01,*P<0.05
通过transwell侵袭实验检测HIST1H3B表达量变化对细胞侵袭能力的影响。结果见图4,在SW1116细胞株中,相对于Blank组,OvHIST1H3B组细胞的侵袭能力明显增强(P<0.05)。Blank组与OvCtrl组间侵袭的细胞数量无统计学差异(P>0.05)。siHIST1H3B.1组的侵袭能力相较Blank组明显减弱(P<0.001)。Blank与siCtrl组间侵袭的细胞数量无统计学差异(P>0.05)。
3 讨论
组蛋白作为构成核小体的核蛋白,可分为5种类型,H1、H2A、H2B、H3和H4,其中H1为连接组蛋白,H2A、H2B、H3和H4为核心组蛋白[3]。目前已鉴定出H3.1和H3.3突变为癌蛋白。应用下一代测序和DNA甲基化谱对小儿高级神经胶质瘤的最新研究,已经分别确定了组蛋白变体H3.3和H3.1基因的突变[4]。Xie等人的研究提示了组蛋白基因集可作为乳腺癌患者生存预测的预后因子[5]。Stenman等人也指出在高通量和明显恶性行为的嗜铬细胞瘤(PCCs)和腹部副神经节瘤(PGL)中的HIST1H3B同样与疾病相关的生存期缩短有关[6]。也有研究表明扁桃体鳞状细胞癌患者经过放射治疗后,其组蛋白簇家族中的6个成员包括HIST1H3B的表达下调[7]。
在以往的研究中发现组蛋白的突变与癌症疾病发生有关,且HIST1H3B基因在结直肠癌中表达上调,但是是否影响结直肠癌的转移并不清楚,因此本实验主要研究HIST1H3B是否影响结直肠癌细胞的迁移和侵袭,通过建立HIST1H3B过表达和敲低表达的结直肠癌细胞系,利用transwell迁移和侵袭实验可以发现HIST1H3B过表达促进细胞的迁移及侵袭功能,沉默HIST1H3B可抑制细胞迁移及侵袭功能。可以说明HIST1H3B是影响结直肠癌的转移能力的,但是HIST1H3B是如何促进结直肠癌的分子机制还尚未明确,还需要进一步研究。弥漫性桥脑胶质瘤(DIPG)是由组蛋白H3(HIST1H3B和H3F3A)的体细胞突变驱动的。氨基酸27上的赖氨酸-蛋氨酸点突变伴随着信号基因的改变,包括酪氨酸激酶受体(PDGFR/EGFR)、激活素A受体(ACVR1)、细胞内激酶(PI3K/AKT/mTOR)、细胞周期蛋白依赖性激酶(CDKs1/4/6),转录调节因子(MYCN)和肿瘤抑制因子(PTEN)。这种过程驱动了基因抑制细胞分化的表达特征,并促进其恶性转化[8]。如果利用PI3K的细胞内途径来刺激EGFR,可以达到促进细胞迁移的作用[9]。AKT作为PI3K的下游信号分子,也可以通过磷酸化大量底物或调节基因表达来调控细胞迁移、增殖和凋亡[10]。也有多项研究已经表明EGFR-PI3K-AKT信号通路可介导癌细胞的迁移活动[11]。但EGFR-PI3K-AKT信号通路是否可以参与HIST1H3B对结肠癌细胞的调控还未见报道,值得进一步研究。

图3 SW1116细胞株中不同实验组镜下迁移的细胞及数量统计A:OvHIST1H3B组。B:OvCtrl组。C:Blank组。D:siCtrl组。 E:siHIST1H3B.1组。 F:各组间迁移细胞数量统计图注:P值为各组与Blank组相比较;且***P<0.001,**P<0.01,*P<0.05
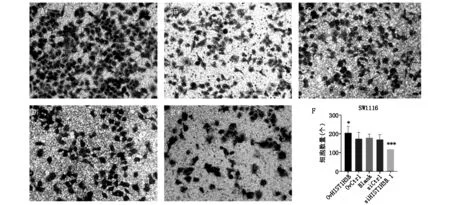
图4 SW1116细胞株中不同实验组镜下侵袭的细胞及数量统计A:OvHIST1H3B组。B:OvCtrl组。C:Blank组。D:siCtrl组。 E:siHIST1H3B.1组。 F:各组间侵袭细胞数量统计图。注:P值为各组与Blank组相比较;且***P<0.001,**P<0.01,*P<0.05

