逆转骨肉瘤耐药的实验研究
黄丽红,秦 迪,徐为民,高奕瑶,王 岩*
(1.吉林大学中日联谊医院 老年病科;2.吉林大学中日联谊医院 科学研究中心,吉林 长春130033)
骨肉瘤是常见的恶性骨肿瘤,肺转移率较高,预后差[1]。目前临床上主要采取术前术后大剂量化疗并结合手术的综合治疗方案[2]。然而骨肉瘤细胞对各种化疗药物极易产生耐受,成为目前骨肉瘤治疗的瓶颈问题[3],因此有必要通过建立肿瘤耐药模型研究肿瘤耐药及其逆转机制。LIMK1是LIM激酶蛋白家族的成员之一[4],LIMK1基因在多种恶性肿瘤中过表达,尤其在骨肉瘤细胞中的表达显著上调,且与细胞迁移/侵袭等密切相关[5]。
本研究应用长春新碱诱导成功构建了骨肉瘤耐药细胞;检测其耐药基因MDR1的表达及其与LIMK1基因的相关性;应用瞬时转染技术有效沉默LIMK1基因,验证了LIMK1逆转骨肉瘤耐药的作用;为肿瘤耐药及其逆转机制的研究提供了依据。
1 材料与方法
1.1 材料
1.1.1细胞系及质粒 人成骨肉瘤(MG63)细胞及重组质粒 pSUPER-LIMK1cDNA由吉林大学王岩教授惠赠。
1.1.2主要试剂 H-DMEM(Gibico/美国),Lipofectamine2000(Invitrogen /美国),胎牛血清来自北京元亨金马公司,RT-PCR试剂盒(TaKaRa/日本),长春新碱(Vincristine,Oncovin)购自哈尔滨医大药业有限公司,预染宽分子量蛋白标准P7708(NEB/美国),2×Taq PCR Master Mix来自北京天根生物技术有限公司,CCK-8检测试剂盒(Sigma/美国),DNA Marker(DL-2000)来自大连宝生物公司。
1.2 方法
1.2.1建立耐药细胞亚系 96孔板中每孔接种4×103个MG63细胞培养,待细胞稳定生长(约24 h)后各孔分别加入终浓度分别为0.2 ng/ml、1 ng/ml、2 ng/ml、5 ng/ml、10 ng/ml、20 ng/ml、40 ng/ml、100 ng/ml的长春新碱(VCR)。继续培养约24 h,镜下观察细胞生长,以死亡细胞数达到约1/5的VCR浓度为起始加药浓度;初次加药维持VCR浓度为2 ng/ml,经传约10代后换成VCR浓度为5 ng/ml继续传代,继续增加剂量10 ng/ml、20 ng/ml传代培养,以细胞在这些浓度下能够半数生存并能稳定生长为准,此诱导过程持续约5个月。最终获得可在含有20 ng/ml长春新碱培养液中存活并稳定生长的MG-63耐药细胞亚系,命名为MG-63/VCR。将获得的MG-63/VCR在含有2 ng/ml的VCR的培养液中培养,以维持耐药株的表型。
1.2.2瞬时转染 用含10%FBS的DMEM培养基稀释对数生长期的MG63/VCR细胞至浓度为1×105/ml,接种于6孔板,培养条件为37℃、饱和湿度、5%CO2,待细胞密度达70%-80%时,将重组质粒 pSUPER-LIMK1cDNA按8 μg/ml稀释至300 μl无血清培养基中,按照Lipofectamine 2000试剂说明书进行转染。
1.2.3RT-PCR实验检测LIMK1及MDR1基因表达 经Trizol法提取上述各组细胞的总RNA,用Thermo反转录试剂盒合成cDNA、RT-PCR实验检测LIMK1及MDR1的表达,以GAPDH为内参,相对表达量用2-△△ct公式计算。所用引物主要包括:① LIMK1,5’-TGAGACAGGTGAGGTGATGG-3’(正向)、5’-AGGCTGAGTCTTCTCGTCCA-3’(反向),400 bp;② MDR1,5’-AGCCTATCTCCTGTCGCATTA-3’(正向)、5’-AGACATGACCAGGTATGCCTAT-3’(反向),158 bp;③ GAPDH,5’-GCACCGTCAAGGCTGAGAAC-3’(正向)、5’-TGGTGAAGACGCCAGTGGA-3’(反向),138 bp。
1.2.4细胞生长曲线 选取处于对数生长期的MG-63和MG-63/VCR细胞,高糖DMEM制备细胞悬液,按浓度为4×103/孔分别接种7块96孔板,每组设3个复孔及3个复孔的空白对照,37℃、5%CO2、饱和湿度条件下培养。按照CCK8检测试剂盒说明配制每100 ml含有10%的CCK-8检测液,每天取1块板,避光孵育2 h后酶标仪检测吸光度值(OD450 nm),计算连续7天的平均值,以培养天数为横坐标,OD值为纵坐标,绘制生长曲线。
1.2.5CCK-8法检测细胞增殖抑制率中半数抑制浓度IC50
抑制率(inhibitionrate)=
将上述细胞接种至96孔板中培养至细胞密度达70%-80%时,以其临床血浆峰浓度为参照加入不同浓度的VCR:4、10、20、40、100、200、400 μg/ml,培养48 h然后换成10%CCK-8的无血清培养基避光培养2 h,检测吸光度值波长450 nm(A),计算半数抑制浓度IC50值。

2 结果
2.1 MG-63长春新碱(VCR)耐药细胞系的建立
首先确定VCR起始加药浓度,继续逐步增加剂量,反复传代约5个月后,获得了在20 ng/ml VCR培养液中稳定生长的耐药细胞,命名为MG63/VCR,用小剂量(2 ng/ml)维持。
2.2 耐药细胞IC50的检测
分别应用不同浓度的VCR作用于MG63和MG63/VCR细胞,CCK-8法测增殖抑制率,使用半数抑制浓度公式计算各组IC50值。结果显示,MG63的IC50值为7.39,MG63/VCR的IC50值为51.80,耐药指数为7.01,属中度耐药。
2.3 MG-63/VCR及MG-63细胞形态
倒置显微镜观察结果显示,MG63细胞大小均一,排列规则,透明度较好,以多边形或短梭形为主(图1 A、B)。瑞氏-姬姆萨染色可见胞体较大的多核巨细胞(图1 E);以及胞体较大的巨核细胞,胞质蓝染,胞核较大,核仁清晰(图1 F)。
而MG63/VCR细胞呈长梭形,大小不均,排列不规则,核较小,两极伸出细长伪足(图1 C、D)。

图1 倒置相差显微镜观察结果A、B、E、F为MG63传代培养72 h;C、D为20 ng/ml的VCR作用于MG63/VCR传代培养72 h;E、F为瑞氏-姬姆萨染色。
2.4 MG-63及MG-63/VCR的生长曲线
CCK-8法分别检测MG63和MG63/VCR细胞培养1-7天的吸光度(OD值),绘制其生长曲线。结果显示,初期MG-63/VCR较MG-63细胞相对生长缓慢,二者均在约第5天进入平台期(图2)。

图2 MG-63/VCR和MG-63的细胞生长曲线
2.5 LIMK1基因在MG-63及其耐药细胞中的基因表达
RT-PCR结果显示:MG-63/VCR中MDR1及LIMK1基因的表达均明显高于MG63细胞,P<0.05(图3,图4),提示LIMK1对调控MG-63/VCR细胞的耐药性有重要作用。

图3 MDR1的RT-PCR结果A为RT-PCR电泳结果,B为相对定量柱状图。lane1:MG63; lane2:MG-63/VCR;※P<0.05。
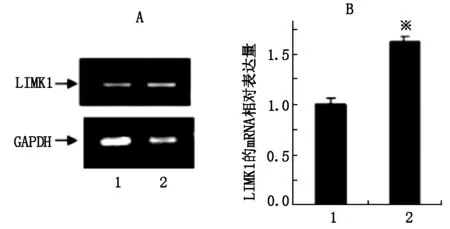
图4 LIMK1的RT-PCR结果A为RT-PCR电泳结果,B为相对定量柱状图。lane1:MG63; lane2:MG-63/VCR ;※P<0.05。
2.6 LIMK1对骨肉瘤耐药的逆转作用
2.6.1基因表达检测 pSUPER-LIMK1为LIMK1的siRNA的真核表达载体,pSUPER为其空载体对照。转染至耐药细胞后RT-PCR检测MDR1及LIMK1的基因表达。首先验证LIMK1基因的沉默效果,结果如图5所示,经转染pSUPER-LIMK1后显著降低了LIMK1在耐药细胞中的表达,说明LIMK1基因被有效沉默。进一步检测MDR1的表达,结果如图6所示,pSUPER-LIMK1质粒转染组MDR1表达显著下调,进一步说明LIMK1基因对耐药基因MDR1的基因表达及细胞耐药性具有重要的调控作用。

图5 RT-PCR检测LIMK1的表达A为RT-PCR电泳结果,B为相对定量柱状图。lane1:MG63组; lane2:MG-63/VCR组 ;lane3:MG-63/VCR pSUPER-LIMK1质粒转染组。 ※P<0.05。
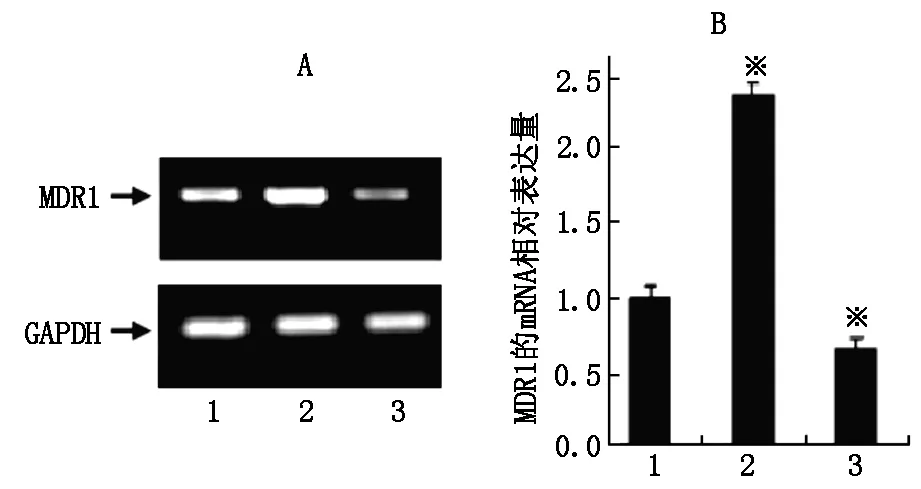
图6 RT-PCR检测MDR1的表达RT-PCR结果显示MDR1的表达:A为RT-PCR电泳结果,B为相对定量柱状图。lane1:MG63组; lane2:MG-63/VCR组 ;lane3:MG-63/VCR pSUPER-LIMK1质粒转染组。 ※P<0.05。
2.6.2沉默LIMK1基因对细胞生长的影响 分别转染pSUPER及pSUPER-LIMK1至MG63/VCR中,24 h后换成10 ng/ml VCR的培养基继续培养5天。倒置相差显微镜下观察细胞生长状态,结果显示空转组细胞生长状态较好,5 d死亡率低于1/5;而pSUPER-LIMK1转染组细胞呈片状死亡,3 d死亡率大于1/5;5 d大部分死亡(图7)。说明沉默LIMK1基因可显著提高耐药细胞对VCR的敏感性、提示LIMK1对MG63/VCR细胞的耐药性具有调控作用。
3 讨论
骨肉瘤是发病率较高的原发性骨肿瘤[6],临床应用化疗药治疗期间易出现耐药的现象是目前骨肉瘤治疗难以逾越的瓶颈问题。众多研究显示MDRl的表达与肿瘤耐药密切相关[7-8]。因此体外建立耐药细胞系对研究肿瘤耐药的分子机制至关重要[9]。本研究以长春新碱(VCR)为诱导剂,使用大剂量冲击与逐步增加剂量相结合[10]、小剂量维持的方法建立MG63耐药细胞,这种方法因为类似临床化疗治疗,被广泛采用。Snow等将耐药指数小于5定为低度耐药,5-15定为中度耐药,大于15定为高度耐药[11]。本研究历时约5个月,建立了在含有VCR20 ng/ml浓度的培养中稳定生长的耐药细胞,命名为MG63/VCR,耐药指数为7.01,属于中度耐药。

图7 倒置相差显微镜观察结果A图,a、b、c为pSUPER空质粒转染MG63/VCR后VCR孵育第1、3、5 d; d、e、f为pSUPER-LIMK1质粒转染MG63/VCR后VCR孵育第1、3、5 d;B图为细胞生存率统计柱状图,*P<0.05。
亲本MG63细胞呈大小均一的长梭形,边界清,可见多个核仁;MG63/VCR大小不均,呈边缘不规则的多角形、或短梭形,两极轴突明显,体积普遍小于MG63,胞浆染色深胞核色浅,背景模糊脏乱可见粉染的絮状物。Wen等[12]等研究发现上述改变可能跟耐药细胞逃逸药物的毒性有关。瑞氏-吉姆萨染色结果显示在MG63中可见瘤巨细胞(巨核细胞及多个胞核),在MG63/VCR中未见,说明瘤巨细胞可能是对化疗药敏感的一类细胞。
应用CCK-8试剂盒连续7天检测获得吸光度值(OD450),用EXCEL软件绘制MG63及MG63/VCR的生长曲线。结果显示,前3天MG63/VCR的增殖速度较MG63慢,而后4天二者生长曲线几乎一致。这种变化体现了细胞在耐药过程中的适应能力。多数化疗药仅对增殖活跃的细胞敏感,反之则不敏感(耐受)。MG63/VCR细胞前期增殖缓慢可能是其对VCR作用后的应答反应,也是其获得耐药性的先决条件:即通过调整细胞状态、减慢增殖速度来抵抗化疗药物的伤害,可能是耐药细胞的共性之一。
丝切因子(Cofilin)是LIMK1与SSH磷酸酶的共同底物蛋白。去磷酸化(激活)的Cofilin是促进肌动蛋白解聚的源动力,主要参与细胞分裂、迁移和伪足形成等[13]。本研究建立的MG63/VCR耐药细胞中MDR1及LIMK1的基因表达均有显著上调,二者呈正相关趋势。
长春新碱(VCR)是一种生物碱类化疗药,其作用机理是通过与细胞微管蛋白(tubulin)等结合,干扰纺锤体的形成,阻滞细胞周期在中期,进而杀灭肿瘤细胞。LIMK1在细胞分裂前期和中期能够一过性激活,随后逐渐回落,而进入到细胞分裂末期又被重新激活[14-15],提示LIMK1具有调控细胞周期的作用[16-17]。LIMK1不仅是肌动蛋白聚合调控因子,也是tubulin重排的调控因子[18],而LIMK1调控tubulin重排机制仍未明确。本研究中耐药细胞MG63/VCR的LIMK1基因表达显著上调,可能通过调控tubulin重排参与细胞耐药。为了进一步探讨LIMK1与MDR1的相关性,转染pSUPER-LIMK1重组质粒至MG63/VCR,结果显示,有效沉默LIMK1的pSUPER-LIMK1组MDR1基因表达显著低于空转组;另外,将pSUPER-LIMK1转染至MG63/VCR,24 h后含换成10 ng/ml VCR的培养基继续培养5 d,倒置相差显微镜下观察可见对照组细胞生长状态良好,死亡率低于1/5;而pSUPER-LIMK1组细胞死亡率显著增加,3 d细胞死亡大于1/5;5 d细胞大部分死亡,死亡呈片状。上述结果提示LIMK1能够调控MG63细胞的耐药特性,沉默LIMK1基因表达可逆转MG63/VCR对VCR的敏感性。
综上所述,LIMK1表达与肿瘤细胞耐药具有明显的相关性,有效沉默LIMK1基因显著逆转了骨肉瘤细胞对VCR的耐药性,但其具体机制尚待进一步研究。
——一道江苏高考题的奥秘解读和拓展

