一测多评法同时测定血府逐瘀胶囊中7种成分的含量*
郑 正,付 鹏
(北京中医药大学东直门医院,北京 100700)
血府逐瘀胶囊源于清代医家王清任的《医林改错》血府逐瘀汤[1],是由11味中药,即炒桃仁、红花、赤芍、川芎、麸炒枳壳、柴胡、桔梗、当归、地黄、牛膝和甘草,在中医基础理论指导下,按照中药剂型工艺制备而成的中药复方制剂。该制剂具有活血祛瘀、行气止痛的功效,广泛用于临床上的瘀血内阻所致胸痛、头痛、失眠多梦、心悸怔忡、内热瞀闷、急躁善怒等症[2]。现代药理研究表明,制剂中的芍药苷通过调控L型电压依赖型钙通道显著改善经前烦躁障碍症肝气郁结大鼠的抑郁情绪,橙皮苷可通过减少神经细胞凋亡和调控GR、NR2B的表达发挥抗抑郁作用[3-4];柚皮苷能够抑制关节炎(CIA)大鼠炎症反应从而对类风湿关节炎有保护作用[5];芸香柚皮苷是一种具有抗过敏活性的黄酮类化合物[6];新橙皮苷对糖脂代谢有一定的调节作用[7];甘草苷能够有效清除氧自由基,甘草酸对治疗乙型肝炎病毒、艾滋病毒方面具有良好的效果[8-11]。该制剂的质量易受药材来源、等级、提取工艺等因素的影响而波动,而目前《国家药品监督管理局标准》WS3-B3049-98对血府逐瘀胶囊的质量控制为采用高效液相色谱(HPLC)法测定制剂中芍药苷的含量,并规定每粒胶囊中含芍药苷不得低于0.24 mg[12-13]。中药发挥疗效的固有特性是多组分、多靶点协同作用,而仅靠控制单一的中药有效成分群的含量,难以客观、全面地评价产品的质量。因此,有必要建立一种简单、方便、实用、可综合评价该制剂的质量控制方法。
一测多评法是指通过药物组分间的某种内在函数关系,建立内参物和各成分间的相对校正因子,从而实现多种有效成分含量同时测定的一种快速评价手段,该评价手段已在中药饮片及其复方制剂的质量控制中广泛应用[14-15]。本研究遵循质量标志物确认的原则,选取血府逐瘀胶囊中赤芍的代表成分芍药苷,枳壳所含主要活性成分柚皮苷、橙皮苷、新橙皮苷、芸香柚皮苷,甘草所含主要成分甘草苷、甘草酸铵为检测指标。其中芍药苷为内参物,采用一测多评法同时测定该制剂中的7种有效活性成分,为血府逐瘀胶囊质量标准的提高与完善提供实验参考。
1 仪器与材料
1.1 仪器HPLC色谱仪(美国安捷伦公司,Agilent 1200型),主要包括UV紫外检测器,四元梯度泵和Empower Pro色谱工作站;自动纯水机(美国,Milli Pore Advantage A10);数控超声波清洗器(昆山市超声仪器有限公司,KQ5200 DE型);电子分析天平(瑞士-梅勒特有限公司,XS205DU型)。
1.2 药物与试剂对照品分别为:芍药苷(批号:110736-201337,纯度为95.7%)、新橙皮苷(批号:110727-201608,纯度为99.9%)、柚皮苷(批号:110722-201613,纯度为94.3%)、橙皮苷(批号:110721-201310,纯度为96.1%)、甘草苷(批号:111610-200604,纯度为98.0%)、甘草酸铵(批号:110731-201619,纯度为93.0%)均来源于中国食品药品检定研究院;芸香柚皮苷(批号:180901,纯度为98.0%)来源于成都瑞芬思生物科技有限公司;甲醇、乙腈和磷酸(色谱级)来源于默克公司,其他试剂(分析纯)来源于天津化学试剂厂,水为屈臣氏蒸馏水。5批血府逐瘀胶囊(批号分别:20190721,20190810,20190920,20191002,20191028,20191125,0.4g/粒)为天津宏仁堂药业有限公司提供。
2 方法与结果
2.1 色谱条件色谱柱为Agilent TC-C18柱(4.6 mm×250 mm,5 μm);流动相为乙腈(A)-0.05%磷酸水溶液(B),梯度洗脱程序为:0~12 min,17% A;12~18 min,17%→20% A;18~23 min,20%→28% A;23~36 min,28%→45% A;36~44 min,45%→70% A;44~50 min,70%→95% A;检测波长:220nm;柱温:30℃,流速:0.8mL/min;进样量:10μL。
2.2 对照品溶液的制备精密称取1.45 mg的芍药苷、1.237 mg的柚皮苷、0.840 mg的橙皮苷、1.56 mg的新橙皮苷、1.14 mg的芸香橙皮苷、1.88 mg的甘草苷、0.678 mg的甘草酸铵对照品,分别置于7个25 mL的透明容量瓶中,滴加50%的甲醇超声溶解后定容至刻度线,制成各自质量浓度为55.51、46.66、32.29、62.34、44.69、73.70、25.22 μg/mL的对照品贮备溶液。
2.3 供试品溶液的制备取血府逐瘀胶囊样品约0.2 g,精密称定样品质量,置于100 mL的具塞锥形瓶中,精密量取25 mL的50%甲醇溶液,缓慢加入后称定总质量,超声波提取目标成分40 min后,取出,放冷后再称重,补足减失的甲醇溶液质量,摇匀,微孔滤膜0.45 μm过滤,即得供试品溶液。
2.4 阴性对照品溶液的制备缺少赤芍药材的阴性对照样品、缺少麸炒枳壳药材的阴性对照样品和缺少甘草药材的阴性对照样品均在中医基础理论的指导下,参照血府逐瘀胶囊用药比例和制备工艺分别制备完成,最后再按“2.3”项下方法制备各阴性对照溶液。
2.5 方法学考察已制备好的混合对照品溶液和供试品溶液各精密吸取10 μL,按照既定的HPLC-UV进样程序设置进样,最后记录50 min的HPLC色谱图(见图1)。结果显示,芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵的色谱峰分离度均≥1.5,理论塔板数按照各成分色谱峰计算均≥3 500,阴性样品对含量测定无干扰。表明所建立的HPLC-UV方法满足本次实验的测试要求

图1 对照品与样品HPLC色谱图
2.6 线性关系、定量限和检出限精密量取0.25、0.50、1.25、2.50、5.0 mL的芍药苷(浓度为55.51 μg/mL)、柚皮苷(浓度为46.66μg·mL-1)、橙皮苷(浓度为32.29μg·mL-1)、新橙皮苷(浓度为62.34μg·mL-1)、芸香橙皮苷(浓度为44.69 μg·mL-1)、甘草苷(浓度为73.70 μg·mL-1)、甘草酸铵(浓度为25.22 μg·mL-1)混合对照品溶液,置于透明的容量瓶中,缓慢滴加甲醇溶液定容至5 mL的刻度线处,即可稀释配制成不同质量浓度的芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷和甘草酸铵对照品溶液,然后依次按照既定的HPLC-UV色谱条件进样10 μL定量分析,根据峰面积(A)计算各个成分的含有量。即7种成分的质量(X,μg)为横坐标,其各自的峰面积积分值(Y)为纵坐标,通过计算得出各自标准曲线的回归方程与相关系数r。结果见表1,表明各成分的线性关系在其相应的质量浓度范围内均有良好的线性关系。以3倍的信噪比(S/N=3)得出仪器检出限和10倍的信噪比(S/N=10)得出仪器的定量限。

表1 7种化学成分线性关系
2.7 精密度试验取同一批次的血府逐瘀胶囊样品1份,按照已定的样品制备和HPLC-PDA程序进样方法,连续测定6次后计算各成分的含量。结果芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵的含有量RSD值分别为:1.20%、1.03%、1.02%、1.05%、0.95%、1.03%、0.98%,表明本次实验仪器的精密度良好。
2.8 稳定性试验取同一批次的血府逐瘀胶囊样品1份,按照已定的样品制备和HPLC-PDA程序进样方法,分别于0、2、4、6、8、12 h注入HPLC色谱仪。结果芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵7种有效成分的峰面积(A)的RSD值分别为:1.05%、1.12%、1.33%、0.84%、0.73%、1.02%、0.98%,表明样品溶液中的7种成分在12 h内均有良好的稳定性。
2.9 重复性试验取同一批次的血府逐瘀胶囊样品共6份,按照已定的样品制备和HPLC-PDA程序进样方法,分别进样分析。结果芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵的含有量RSD值分别为:1.01%、1.22%、1.21%、0.99%、0.95%、1.35%、0.98%,表明建立的方法重复性较好。
2.10 加样回收率试验取同一批次的血府逐瘀胶囊样品共9份,每份取约0.1 g,精密称定后分别置于锥形瓶100 mL中,每组分别加入芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵对照品溶液,加入的量为血府逐瘀胶囊样品中各成分含量的50%、100%和150%,按照已定的样品制备和HPLC-UV程序进样方法进行色谱分析,并计算7种有效成分的加样回收率。结果显示,平均回收率分别是芍药苷为99.88%(RSD=1.12%);柚皮苷为101.80%(RSD=1.10%);橙皮苷为105.07%(RSD=0.53%);新橙皮苷为98.98%(RSD=1.21%);芸香橙皮苷为101.22%(RSD=1.23%);甘草苷为100.99%(RSD=1.31%);甘草酸铵为98.79%(RSD=1.02%),本次实验的加样回收率良好,表明建立的实验方法准确、可靠。
2.11 建立一测多评(QASM)法的质量评价模式
2.11.1 计算相对校正因子(fi/s) 精密量取“2.6”项下配制的一系列混合对照品溶液,按照HPLC-PDA程序进样的方法依次进样测定芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵的峰面积,以芍药苷为内参物,用浓度与峰面积之比计算校正因子,将待测成分与内参物校正因子之比计算fi/s,计算公式为fi/s=AsCi/AiCs,式中As为内参物峰面积,Cs为内参物浓度,Ai为待测成分峰面积,Ci为待测成分浓度。计算柚皮苷(f1)、橙皮苷(f2)、新橙皮苷(f3)、芸香橙皮苷(f4)、甘草苷(f5)、甘草酸铵(f6)的fi/s分别为1.80、1.08、0.82、0.78、0.57、0.52。
2.11.2 fi/s的耐用性考察 本次实验对不同人员、流速、柱温、色谱柱和HPLC仪器对fi/s的影响进行了考察:分别选用了Agilent 1260色谱仪和Waters 2695色谱仪系统;Agilent TC-C18(4.6 mm×250 mm,5 μm)、Agilent EC-C18(4.6 mm×250 mm,5 μm)、Thermo BDS-C18(4.6 mm×250 mm,5 μm)、Waters XBridgeTM C18(4.6 mm×250 mm,5 μm);3种不同的流速;3种不同柱温;2名研究人员进行了耐用性考察。结果表明各因素对fi/s无显著影响,RSD值在0.48%~1.87%(见表2),表明重现性良好、方法可行,因此可采用一测多评法进行血府逐瘀胶囊的含量测定。
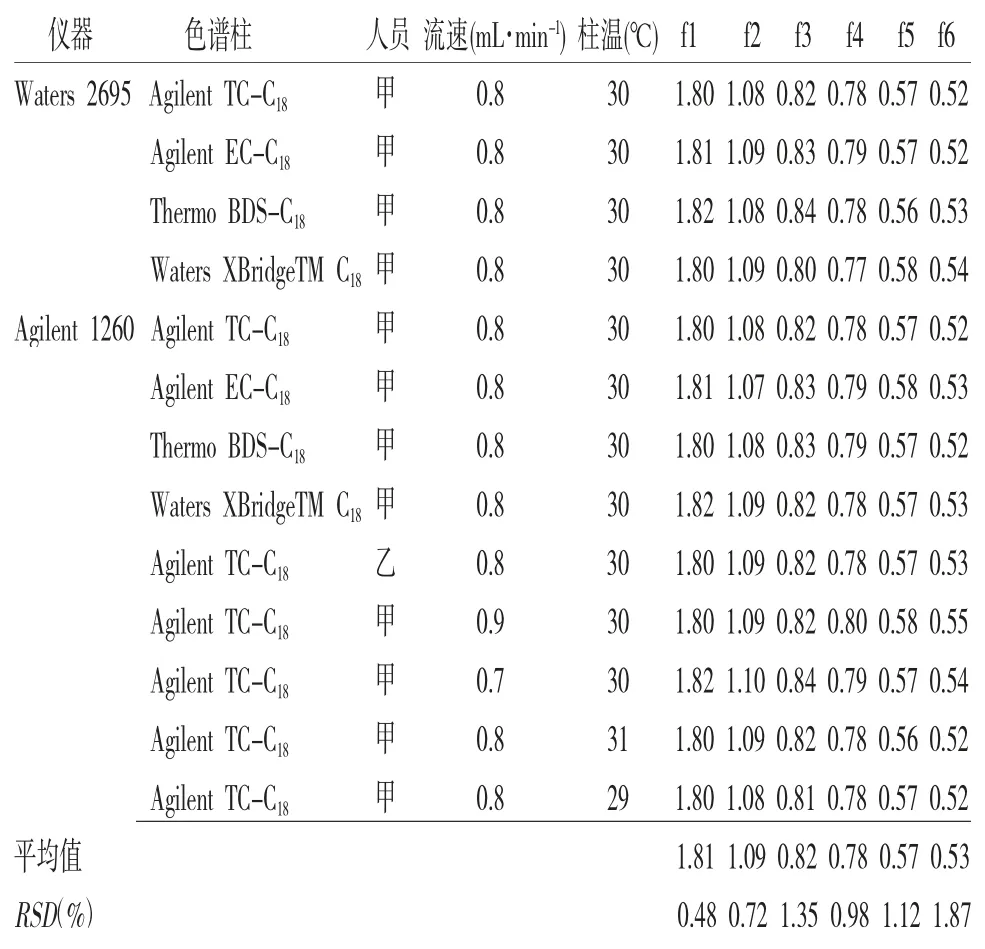
表2 各种因素对fi/s的影响
2.12 样品含量测定及比较为了进一步验证所建立的一测多评法的准确性,本研究采用外标法和一测多评法的fi/s对5批血府逐瘀胶囊中芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵的含量进行测定,并进行比较分析。结果显示,一测多评法与外标法测定结果的相对误差(RD)小于2%,无明显差异,表明所建立的一测多评法可以用于血府逐瘀胶囊的质量评价研究(见表3)。

表3 5批血府逐瘀胶囊7种指标成分含量测定结果(mg/粒)
3 讨 论
3.1 测定指标成分的选择血府逐瘀胶囊是在中医基础理论指导下,经过中药药剂制备工艺精心制备而成的中药复方,该方中各有效成分协同作用、共同发挥药效。2015年版《中华人民共和国药典》中规定芍药苷和柚皮苷为血府逐瘀胶囊的指标成分,笔者结合该复方的药理实验结果,选择可能发挥疗效的芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵7种化学成分为测定指标,采用一测多评-HPLC法同时定量分析了各有效成分在样品中的含有量,结果显示,7种有效成分在已定的HPLC色谱方法下分离度均较好。
3.2 波长的选择本次实验笔者通过全波长扫描发现,在波长220 nm处芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵均有明显的吸收,故实验选择在波长220 nm下对芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵7种有效成分的含量进行测定。
3.3 HPLC条件优化实验过程中分别对乙腈-0.05%磷酸水、乙腈-水、乙腈-0.1%磷酸水3种流动相系统进行了对比,发现在乙腈-0.05%磷酸水流动相体系下进行梯度洗脱时,芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵7种成分之间色谱峰的分离度均大于1.5,分离效果较好;考察不同的温度(29、30、31℃)和不同的流速(0.7、0.8、0.9 mL·min-1)对各有效成分色谱峰的分离效果,结果发现30℃的柱温、0.8 mL·min-1的流速可以达到色谱峰基线平稳、分离度和峰形较好的效果;考察不同品牌的4种色谱柱Agilent EC-C18(4.6 mm×250 mm,5 μm);Agilent TC-C18(4.6 mm×250 mm,5μm);Waters XBridgeTM C18(4.6mm×250mm,5 μm);Thermo BDS-C18(4.6 mm×250 mm,5 μm),结果发现Agilent TC-C18柱能将7种成分,即芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵的色谱峰分开,并达到良好的分离度。通过对耐用性的考察,结果显示不同品牌的色谱柱、不同的HPLC检测仪器和不同的实验人员操作对相对校正因子(f)的影响均不显著,并且在不同条件下,7种有效指标性成分的f重现性较好(RSD<2.0%)。
3.4 样品提取方法的选择通过单因素考察的方式对血府逐瘀胶囊样品的提取溶剂、提取方法等进行考察。考察了甲醇、50%甲醇,70%甲醇;加热回流、浸提和超声提取;提取30、40、50 min对芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵提取效果的影响,结果发现50%的甲醇超声提取40 min即可使该制剂样品中的芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵提取完全。
3.5 小结本研究建立了一测多评-HPLC法同时测定血府逐瘀胶囊中芍药苷、柚皮苷、橙皮苷、新橙皮苷、芸香橙皮苷、甘草苷、甘草酸铵含量的方法,对5批血府逐瘀胶囊中7种成分进行了外标法和一测多评法定量分析,结果表明两种方法测定的成分含量差异较小。通过对HPLC分离参数进行了一系列的方法学考察,优化得出最理想的HPLC色谱分离方法,表明本次实验所建立的一测多评方法能同时测定血府逐瘀胶囊中7种有效成分的含有量,结果较为准确、快速。本研究不仅能够科学客观的评价血府逐瘀胶囊内在质量,同时又能节约对照品、提高检测速度、降低成本,便于应用于该制剂生产过程中的质量控制。

