消癌平联合磁感应热疗对小细胞肺癌细胞的作用*
范林林,钟 雪,唐劲天,李利亚
(1.天津中医药大学研究生院,天津 301617;2.大连大学生命科学与技术学院,辽宁 大连 116622;3.清华大学工程物理系医学物理与工程研究所医疗新技术实验室,北京 100084;4.中日友好医院,北京 100029)
肺癌是我国最常见的恶性肿瘤之一,其中小细胞肺癌占新发肺癌的15%[1],且早期极易扩散,其中60%~70%的患者在诊断时已为广泛期疾病(ES-SCLC)[2]。数十年来其治疗无显著进展,免疫治疗的发展为小细胞肺癌的治疗带来希望,但是生物标志物不明确等问题仍然存在[3],因此探索新的治疗方法尤为必要。
随着磁感应热疗在肿瘤研究领域的深入,其在联合化疗及中药方面已展现出巨大的优势。中药消癌平的主要成分是通关藤,目前研究显示其具有抑制肿瘤细胞增殖、诱导细胞凋亡、抑制肿瘤血管生成、细胞毒作用、免疫调节和降低肿瘤细胞耐药性等作用,对于肺癌、胃癌等多种肿瘤治疗具有良好的效果[4-5]。因此本研究将从细胞增殖、细胞凋亡和细胞周期等方面探讨消癌平联合磁感应热疗对于小细胞肺癌H446细胞的作用效果,以期为小细胞肺癌的治疗提供新型联合用药方案,并进一步探索磁感应热疗对于深部肿瘤治疗的可能性。
1 材 料
1.1 细胞株H446细胞株由中国科学院上海细胞库提供。
1.2 药物与试剂 伊立替康(辉瑞制药有限公司,规格:5 mL∶0.1 g,批号:AA9139);细胞周期及Annexin V-FITC/PI双染细胞凋亡试剂盒(南京凯基生物科技发展有限公司,规格:100T,批号:KGA108);RPMI-1640培养基(美国Gbico公司,规格:500mL,批号:C11875500BT);胎牛血清(美国Hyclone公司,规格:500mL,批号:SH30070.03E);CCK-8试剂盒(日本同仁化学研究所,规格:500T,批号:CK04);胰蛋白酶(美国sigma公司,规格:100mg,批号:T2600000)。
1.3 主要仪器FACS Calibur型流式细胞分析仪(美国BD公司);ZE5多功能酶标仪(美国ThermoScientific公司);CO2恒温培养箱(赛默飞世尔科技(中国)有限公);SW-CJ-2D超净工作台(杭州艾普仪器设备有限公司)。
2 方 法
2.1 磁性微球升温性能的检测 将40、60、80 mg的磁性微球分别放于24孔板中,加入2 mL含有20%胎牛血清的1640培养基,将HP型测温光纤插入在板盖正中已打好的小孔中,将24孔板置于300 kHz,40 Gs的交变磁场下,使用测温软件记录随加热时间变化情况。
2.2 磁性微球浸提液制备 将微米级磁性微球使用超纯水清洗3~5次直到清洗液变清澈,用75%酒精灭菌3次,再使用超纯水将酒精洗净,120℃高压蒸汽灭菌30 min,干燥后放置超净台备用,每次使用前用紫外线照射30 min。取其中一部分干燥后的无菌磁性微球,加入含20%FBS的1640培养液,使其质量浓度达到40、60、80 mg/mL,密封,放在37℃恒温培养箱中24 h得到相应质量浓度的浸提液。
2.3 细胞生物相容性检测 将细胞悬液以5×103个/孔接种于96孔板内,在37℃、5%CO2的条件下培养24 h后,依次将质量浓度为0、40、60、80 mg/mL的浸提液200 μL加入孔内,继续培养24、48、72 h。连续3 d用CCK-8法检测细胞增殖率。每孔加入10 μL的CCK-8检测液,避光孵育3 h,用酶标仪检测每孔在450 nm波长下的吸光度值(OD值),细胞存活率=(实验组平均OD值/对照组平均OD值)×100%。
2.4 细胞培养 于37℃水浴中快速解冻H446细胞,转移至15 mL离心管内,加入8 mL的1640培养液(含有20%的胎牛血清,100 U/mL链霉素、青霉素),离心去上清,加入15 mL配好的1640培养液,重悬细胞,转至55 cm2培养皿内。培养箱孵育24 h后换液,待细胞贴壁生长占培养皿底面积80%~90%时,PBS漂洗2次,用0.25%胰蛋白酶(不含EDTA)2 mL消化,消化后加入6 mL培养液。离心收集细胞加入新鲜的培养液,重悬细胞,将细胞数目调整至需要的比例备用。
2.5 消癌平对细胞的增殖抑制实验 将200 μL细胞浓度为2×104个/mL的细胞悬液接种至96孔板内,培养24 h后,依次加入0、20、40、60、80 mg/mL的消癌平注射液。培养24、48 h后,用CCK-8检测法测定每组的OD值(方法同“2.3”项),计算各组细胞增殖抑制率。
2.6 不同干预对细胞增殖抑制实验 将实验设置为6组:对照组(正常培养H446细胞)、磁感应组(实验参数为:300 kHz,40 Gs,30 min)、消癌平组(质量浓度为36.27 mg/mL)、联合组(磁感应+消癌平)、无细胞加药组、无细胞不加药组。将H446细胞浓度调整为2.0×104个/mL,接种于24孔板内,每孔1 mL,每组3个复孔。避光孵育24 h后,消癌平组、联合组、无细胞加药组分别换上含36.27 mg/mL消癌平的培养液,对照组、磁感应组、无细胞不加药组换上仅含胎牛血清的1640培养液。磁感应热疗分别干预联合组、磁感应组,30 min/次。24 h后CCK-8工作液以50 μL/孔加入24孔板内,避光孵育3 h后检测OD值(方法同“2.3”项),计算每组的细胞抑制率及联合组组合指数q值。
2.7 细胞凋亡/死亡检测 实验分为对照组、磁感应组、消癌平组及联合组。将H446细胞的浓度调整为2×104个/mL,接种于24孔板内,每孔2 mL,37℃、5%CO2的条件下避光孵育24 h后,消癌平组、联合组分别换上含36.27 mg/mL的消癌平药物培养液,对照组、磁感应组换上仅含20%FBS的1640培养液。将24孔板置于磁场下,30 min/次,继续培养24 h,离心收集细胞,PBS洗涤2次。加入100 μL的Binding Buffer重悬H446细胞,予5 μL Annexin V-FITC及10 μL Propidium Iodide轻吹均匀,继续加入400 μL的Binding Buffer混合均匀,室温避光反应10 min,1 h内用流式细胞仪检测检测分析。重复实验3次。
2.8 细胞周期检测 分组干预方法同“2.7”项。收集细胞后,将每0.5 mL的染色缓冲液加入10 μL碘化丙啶储备液及10 μL RNaseA的PI染色液,放入4℃冰箱暂存。收集悬浮细胞及贴壁细胞(方法同“2.7”项),1 000 r/min离心3 min,弃去上清液,用预冷的灭菌PBS洗涤2遍。加70%的预冷乙醇500 μL吹打均匀,4℃冰箱固定2 h,随后1 000 r/min离心3 min,弃去上清液,加入预冷的无菌PBS清洗1遍,加入配好的PI染色液500 μL重悬细胞混匀,37℃避光孵育30 min,流式细胞仪分析,在5 h内完成检测。重复实验3次。
2.9 统计学方法 采用SPSS 20.0软件对数据进行处理,计量资料以(s)表示,各组数据符合正态性和方差齐性检验,采用单因素方差分析,组间两两比较采用LSD法,P<0.05为差异有统计学意义。
3 结 果
3.1 细胞存活率检测CCK8检测结果显示,磁性微球在0、40、60、80 mg/mL的质量浓度下,在24、48、72 h 3个时间点细胞存活率最低值均大于90%,说明磁性微球浸提液对H446细胞活力影响较小,H446细胞在不同质量浓度的浸提液内可以正常生长。(见图1)
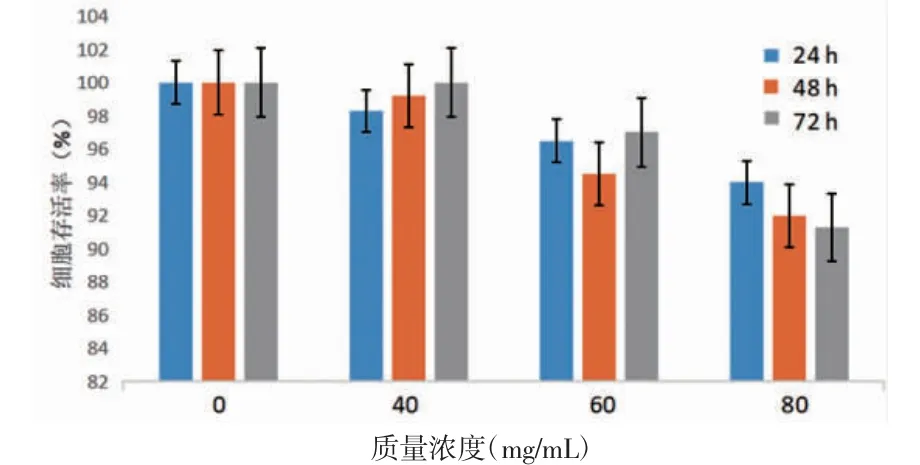
图1 磁性浸提液对H446细胞活力的影响,n=3)
3.2 磁性微球的体外升温 不同质量浓度磁性微球在300kHz、40 Gs磁场下,30 min内的升温情况见图2,测温光纤测得磁性微球随时间的增长而产热增加。结果表明不同质量浓度样品在磁场作用下具有较好的产热能力,其中磁性微球在60mg/mL的质量浓度下,30 min升温到45℃,表明其具有良好升温能力和温度维持能力,符合磁感应热疗介质的要求。
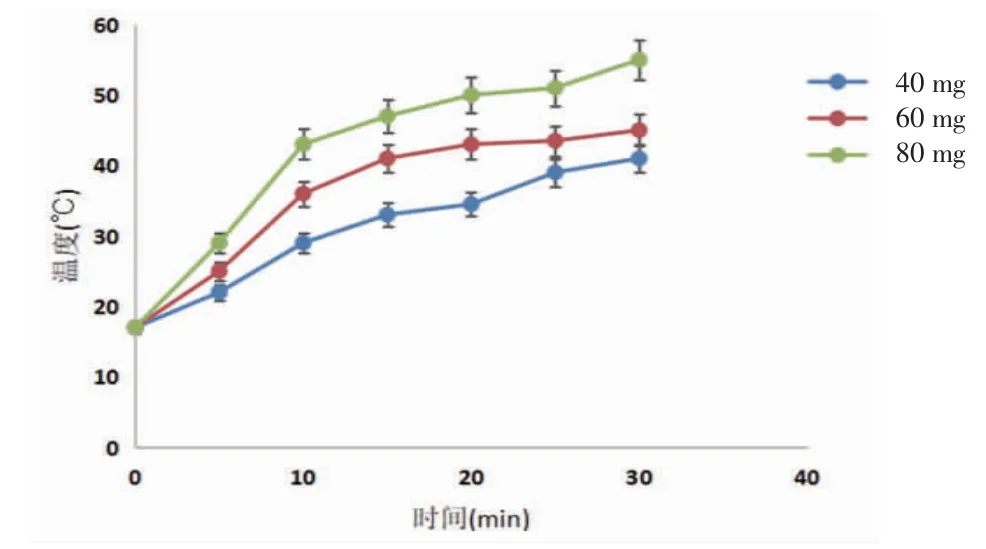
图2 磁性微球升温曲线s,n=3)
3.3 消癌平对H446细胞的增殖抑制实验CCK-8检测结果显示,消癌平能明显抑制H446细胞的增殖;随着药物浓度的增大及作用时间的延长,消癌平对H446细胞的抑制作用逐渐增强。药物的亚细胞毒性是指在抑制率为10%~20%时的药物浓度,经计算消癌平24 h的20%抑制率的质量浓度为36.27 mg/mL,故选用36.27 mg/mL的质量浓度作为联合用药浓度。(见表1)
表1 不同质量浓度消癌平作用下H446细胞抑制率,n=3)

表1 不同质量浓度消癌平作用下H446细胞抑制率,n=3)
注:与0 mg/mL比较,aP<0.01
质量浓度(mg/mL) 24 h(%) 48 h(%)0 0.53±0.36 0.76±0.57 20 7.75±2.04a 27.56±0.63a 40 24.80±3.97a 43.36±3.09a 60 35.98±1.89a 51.21±2.28a 80 44.66±3.02a 59.69±2.47a
3.4 不同干预措施对细胞增殖抑制实验 采用CCK-8法检测各组细胞的增殖抑制率,磁感应组、消癌平组和联合组H446细胞增殖抑制率均明显高于对照组(P<0.05),磁感应组H446细胞增殖抑制率明显高于消癌平组(P<0.05),联合组H446细胞增殖抑制率明显高于磁感应组和消癌平组(P<0.05)。组合指数(q)=1.12,说明磁感应热疗联合消癌平对H446细胞增殖抑制具有一定的相加作用。(见表2)
表2 不同干预措施干预H446细胞增殖抑制率s,n=3)
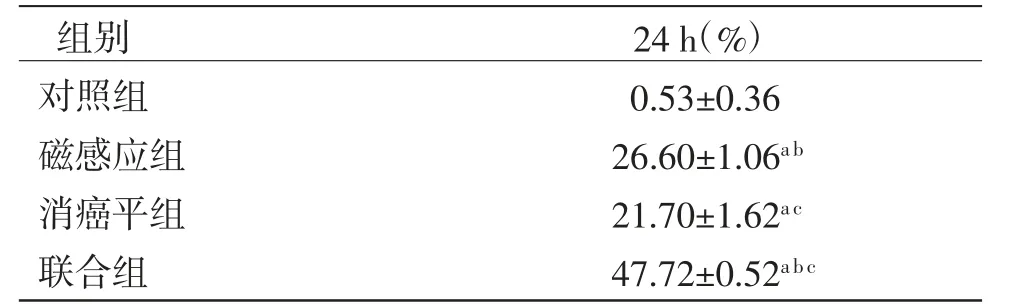
表2 不同干预措施干预H446细胞增殖抑制率s,n=3)
注:与对照组比较,aP <0.05;与消癌平组比较,bP<0.05;与磁感应组比较,cP<0.05
组别 24 h(%)对照组 0.53±0.36磁感应组 26.60±1.06a b消癌平组 21.70±1.62a c联合组 47.72±0.52a b c
3.5 不同干预措施对H446细胞凋亡/死亡的影响 磁感应组和消癌平组H446细胞的总凋亡率均高于对照组(P<0.05),尤其是H446细胞早期凋亡率均明显高于对照组(P<0.05),说明磁感应热疗和消癌平均能增加H446细胞的凋亡;磁感应热疗联合消癌平作用H446细胞24 h后,联合组总凋亡率高于消癌平组和磁感应组(P<0.05)。组合指数(q)=1.11,提示联合组H446细胞凋亡率明显增加,表明磁感应热疗联合消癌平诱导H446细胞凋亡成相加作用。(见图3、表3)
表3 各组细胞在凋亡率方面的比较s,n=3)
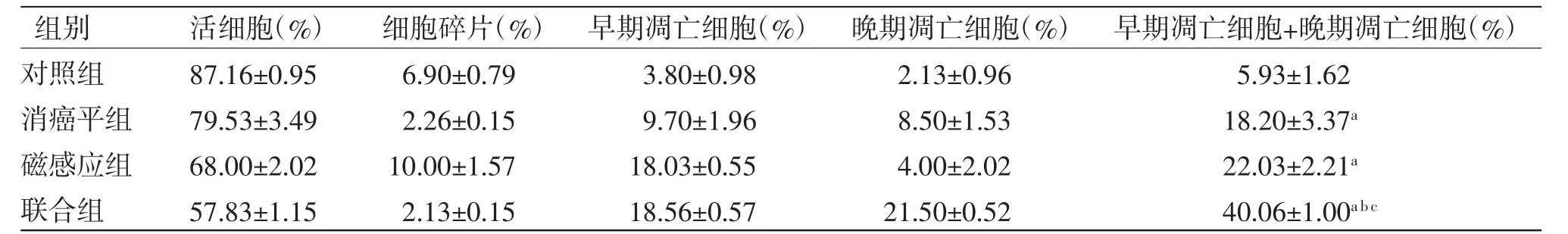
表3 各组细胞在凋亡率方面的比较s,n=3)
注:与对照组比较,aP<0.05;与消癌平组比较,bP<0.05;与磁感应组比较,cP<0.05
?
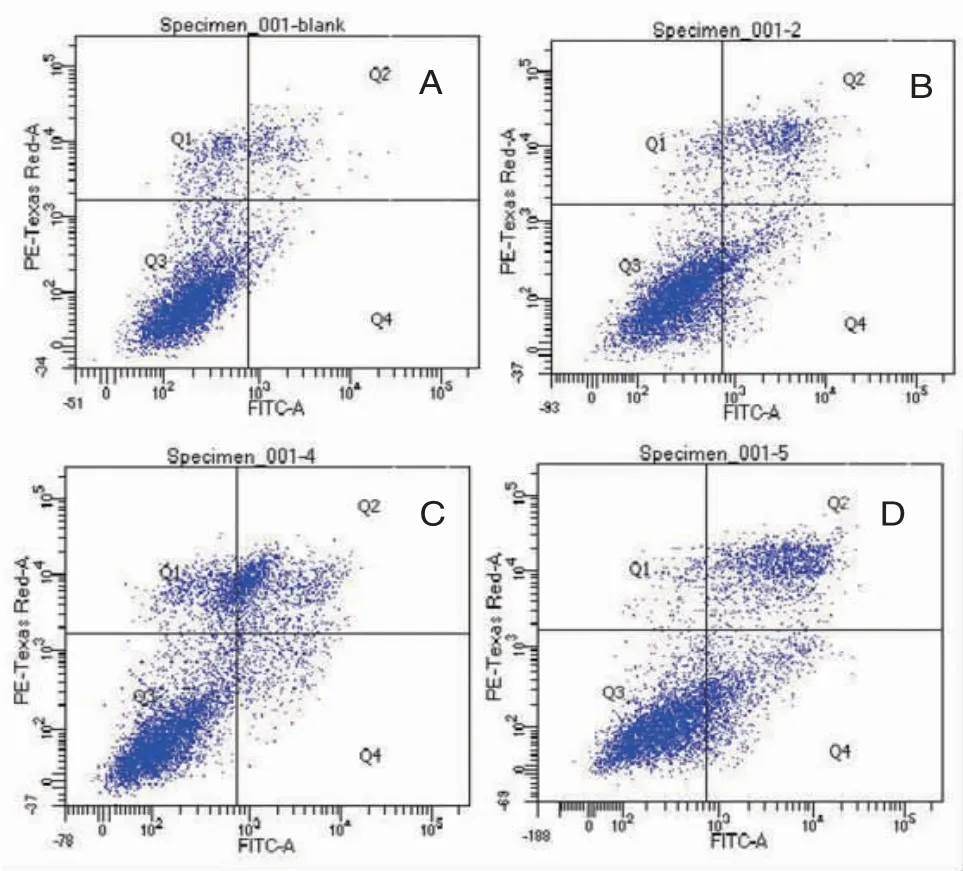
图3 不同干预措施对H446细胞凋亡/死亡的影响
3.6 不同干预措施对H446细胞细胞周期的影响 与对照组比较,消癌平组和磁感应组G0/G1期H446细胞比例明显下降(P<0.01),G2/M、S期细胞比例均上升(P<0.01),说明消癌平和磁感应热疗能改变H446细胞的细胞周期,将H446细胞阻滞于G2/M、S期;与对照组比较,联合组G2/M期H446细胞比例明显上升(P<0.01),提示联合治疗能将H446细胞阻滞于G2/M期;但细胞G2/M期所占比例与消癌平组和磁感应组比较,S期H446细胞比例与对照组比较,差异均无统计学意义(P>0.05),说明磁感应热疗联合消癌平治疗对H446细胞周期的协同阻滞作用不明显。(见图4、表4)
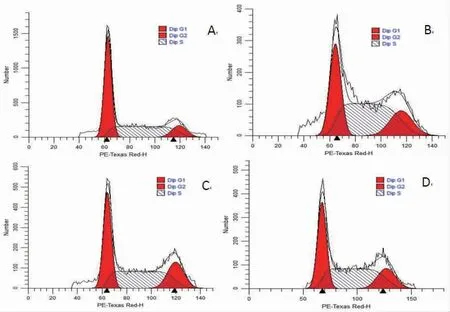
图4 各组H446细胞的细胞周期比较
表4 各组H446细胞的细胞周期中各期细胞所占比例s,n=3)
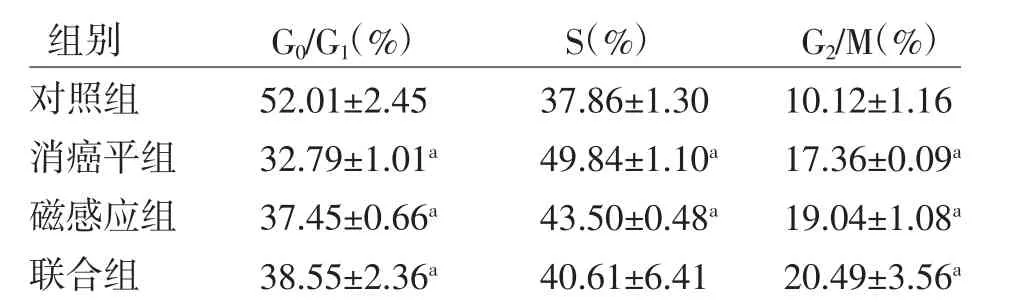
表4 各组H446细胞的细胞周期中各期细胞所占比例s,n=3)
注:与对照组比较,aP<0.01
组别 G0/G1(%) S(%) G2/M(%)对照组 52.01±2.45 37.86±1.30 10.12±1.16消癌平组 32.79±1.01a 49.84±1.10a 17.36±0.09a磁感应组 37.45±0.66a 43.50±0.48a 19.04±1.08a联合组 38.55±2.36a 40.61±6.41 20.49±3.56a
4 讨 论
中医药治疗肿瘤,具有多靶点、疗效好和毒性低的优点,因此越来越受到人们的关注,且已成为肿瘤药物研发的重要来源之一[6]。中药消癌平的有效成分是通关藤,通关藤具有清热、平喘、化痰的功效,可用于治疗具有喘咳症状的疾病,如哮喘、支气管炎、肺癌等。随着实验的深入,研究者发现通关藤中C21甾体皂苷抗肿瘤效果十分明显,所以该药渐渐成为抗肿瘤专药[7]。临床研究表明,消癌平联合放疗、化疗和靶向治疗可以改善肿瘤患者症状,提高生活质量,延长生存时间,如朱丽娜等[8]认为消癌平治疗进展期非细胞肺癌效果理想值得临床推广;骆许静等[9]证实消癌平片联合PC方案能够改善晚期非小细胞肺癌患者的免疫功能;同时一项Meta分析[10]研究表明消癌平注射液能提高晚期非小细胞肺癌患者化疗疗效,改善生活质量,减轻不良反应。因此,本研究选用消癌平作为干预手段,采用不同质量浓度的消癌平注射液体外作用于H446细胞,发现随着消癌平浓度的升高,H446细胞的活力降低,增殖抑制率增高,进一步证实消癌平注射液在小细胞肺癌细胞层面干预是可行的。
本实验团队研制开发出第三代磁感应治疗仪,进一步研究表明,磁感应热疗技术对多种肿瘤细胞具有不同程度的抑制作用[11-12]。本实验分别给予H446细胞质量浓度为40、60、80 mg/mL的磁性微球浸提液,连续培养H446细胞3 d,结果表明磁性微球对H446细胞的活力影响较小,符合国家标准>75%的要求。升温曲线表明,质量浓度为60 mg/mL磁性微球在300 kHz、40 Gs磁感应下作用30 min,温度可以达到45℃,其毒性小及具有良好的升温能力,是良好的磁感应热疗介质。将磁感应热疗和磁感应热疗联合消癌平应用于H446细胞,从细胞增殖抑制方面可以看到磁感应热疗和磁感应热疗联合消癌平都可以抑制H446细胞的增殖,并且联合应用明显增加了对细胞增殖的抑制。其中的原因可能是与高温诱导肿瘤细胞凋亡有关;也可以诱导H446细胞形成更成熟的细胞类型,从而抑制其自我更新能力,使肿瘤细胞对包括中药在内的辅助治疗更加敏感[13]。王国卿等[14]研究发现人肺癌A549细胞接受磁流体热疗后细胞呈凋亡样改变,高温时呈坏死样改变;胡润磊等[15]通过动物实验也发现小鼠肺癌A549细胞在交变磁场作用下生长受到抑制。
细胞凋亡,又称程序性死亡,是细胞在基因调控下的主动性死亡过程[16]。其主要有内源性和外源性凋亡两种途径,均参与肿瘤发生发展的过程。促进肿瘤细胞凋亡为抗肿瘤治疗的机制之一,目前促进肿瘤细胞凋亡的药物研发也成为研究的热点[17]。本实验检测了消癌平组、磁感应组和联合组H446细胞的凋亡情况,结果表明联合组的细胞凋亡明显增加。调控细胞周期是诱导肿瘤细胞凋亡的方式之一,不同措施将细胞阻滞于不同周期,导致细胞无法正常分裂而凋亡。本实验结果表明磁感应组和消癌平组能将H446细胞阻断在G2/M和S期,联合组能将其阻断在G2/M期,说明H446细胞G2/M期对于3种干预措施均比较敏感,而联合治疗阻滞周期效果较单独治疗并不明显,结果表明调控细胞周期可能不是消癌平联合磁感应热疗促肿瘤凋亡的作用机制。其作用机制可能涉及信号通路和细胞因子,其中通路主要有Akt通路、Notch通路和Wnt通路,涉及的细胞因子主要有Puma、Bcl-2、Bax和cleaved Caspase-3蛋白等,但需要进一步验证[18-20]。
综上,消癌平联合磁感应热疗能明显增加对小细胞肺癌H446细胞增殖的抑制作用,促进其凋亡,但在周期阻滞未见明显相加作用。

