丹参多酚酸盐对急性肺栓塞大鼠肺损伤的保护作用及肺组织CX3CR1、NF-κB蛋白表达的影响*
曾 光,胡俊晟,黄 荣,黄 毅,金永志,李梦帆
(上海市普陀区中心医院,上海 200062)
急性肺栓塞(acute pulmonary embolism,APE)是机体凝血-纤溶平衡失调导致血栓形成并堵塞肺动脉主干或分支引起的严重呼吸循环障碍的病理生理综合征[1],该病具有较高的发病率与致死率,严重威胁患者的生命健康。有研究指出APE发生时,血栓会对血管内皮细胞造成机械性损伤并诱发炎症反应[2]。炎症反应发生时,静息状态的核因子-κB(nuclear factor kappa-B,NF-κB)被激活并参与调控多种病理及生理过程。CX3CL1是CX3C的家族成员,CX3CR1是它的特应性受体,APE发生时其能加速炎症因子渗出从而扩大炎症反应[3]。当前,APE的临床治疗以抗凝治疗为主。丹参多酚酸盐是从丹参中提取的具有行血通脉、活血化瘀之效的制剂,其主要成分是丹乙酸镁,具有抗血小板聚集的效果[4]。本次研究通过设计APE大鼠模型,观察丹参多酚酸盐对APE大鼠肺损伤的保护作用,并分析其对大鼠肺组织CX3CR1、NF-κB蛋白表达的影响,探讨其可能的作用机制。
1 材料与方法
1.1 实验动物3个月龄SPF级健康雄性SD大鼠60只,体质量(200±20)g,购自安徽医科大学实验动物中心,合格证号:0001507。在室温22~24℃,相对湿度45%~55%环境中适应性饲养3 d,期间自由进食饮水,12 h交替光照,处理方法遵守动物伦理原则,伦理审核编号:20181030c0241114[280]。
1.2 药物与试剂 丹参多酚酸盐(上海绿谷生命园医药有限公司,国药准字Z20050246,批号:190827);免疫组化试剂(香港Abcam,批号:146897);SP免疫组化染色试剂盒(福州迈新生物技术开发有限公司,批号:mx154026);蛋白印迹相关试剂(美国Beyotime Biotechnology,批号:A44585);肿瘤坏死因子-α(TNF-α)ELISA试剂盒(货号:JKSJ-1857)、白细胞介素-1β(IL-1β)ELISA试剂盒[货号:JK-(a)-1438]、白细胞介素-8(IL-8)ELISA试剂盒[货号:JK-(a)-1002](上海晶抗生物工程有限公司)。
1.3 主要仪器RM2235型石蜡切片机(Leica公司);HZQF160型电恒温培养箱(上海新苗医疗器械制造有限公司);NP-B型生物组织包埋机(Leica公司);Universal HoodⅢ型凝胶成像系统(Bio-Rad公司)。
1.4 造模与分组 采用随机数字表法将60只SD雄性大鼠随机分为正常对照组、假手术组、模型组、丹参多酚酸盐组,每组15只。模型组与丹参多酚酸盐组大鼠采用自体血栓法复制APE大鼠模型[5],造模前4 h,采集大鼠0.2 mL自体眼眶静脉血置于无菌试管中,凝固4 h后将其分割成2 mm2血栓与0.5 mL生理盐水混合制备成血栓混悬液(15~20个血栓)。采用水合氯醛将大鼠麻醉,自大鼠右颈总静脉快速注入血栓混悬液。正常对照组大鼠不接受任何干预措施,假手术组则自大鼠右颈总静脉注入0.5 mL生理盐水。大鼠出现呼吸加深加快、发绀等症状表示建模成功。
1.5 实验给药 造模前1天与造模前40 min对各组大鼠进行药物灌胃,参照人与动物等效剂量换算,丹参多酚酸盐组按照10 mg/kg剂量灌胃丹参多酚酸盐(浓度为10 mg/mL)2 mL,其余各组大鼠采用等量生理盐水灌胃,1次/d。实验期间各组大鼠均自由进食饮水。毒理试验表明[6],320 mg/kg剂量可引起Beagle犬注射部位血管内皮细胞损伤,肾小管上皮细胞、肝细胞含棕黄色药样物,本次研究使用剂量在安全范围内。
1.6 观察指标
1.6.1 HE法观察各组大鼠肺组织病理变化情况 取出肺组织,采用10%甲醛固定石蜡包埋制备成4 μm的切片在65℃恒温箱中6~12 h,苏木素-伊红(hematoxylin-eosin staining,HE)染色镜检,观察各组大鼠肺组织病理变化情况。
1.6.2 ELISA检测大鼠血清炎症因子表达水平 栓塞4 h、72 h后,分别从各组随机取6只大鼠,水合氯醛麻醉后采用颈部脱臼法处死大鼠,采集各组大鼠血液样本,3000r/min离心15min,取上清液,采用ELISA检测炎症因子TNF-α、IL-1β、IL-8表达水平,严格按照试剂盒说明书执行各项操作。
1.6.3 免疫组化法检测大鼠肺组织CX3CR1、NF-κB蛋白表达情况 石蜡切片脱蜡至水,加入3% H2O2在37℃条件下孵育10 min,消除内源性过氧化物酶活性。采用蒸馏水清洗切片并在PBS中浸泡5 min×3次,将切片置于0.01 mol/L枸橼酸缓冲液中进行抗原修复。磷酸缓冲盐溶液(PBS)冲洗5 min×3次,采用5%~10%正常山羊血清进行封闭,室温条件下孵育10 min,弃血清,加入一抗之后在4℃冰箱内过夜。室温静置30 min,PBS冲洗5 min×3次,加入适量二抗37℃孵育30 min。冲洗5 min×3次,加入适量碱性磷酸酶或辣根酶标记的链霉卵白素工作液PBS 37℃孵育30 min。冲洗5 min×3次,加入显色剂显色15 min,自来水充分冲洗后苏木素复染,脱水、干燥、透明、封片。光学显微镜镜检,每张切片选取3个不重叠视野,每只大鼠取4张肺片进行阳性细胞计数,获得的平均值作为大鼠CX3CR1、NF-κB阳性细胞计数结果。
1.6.4 Western blotting法检测大鼠肺组织CX3CR1、NF-κB蛋白表达情况 取大鼠肺组织加入200 μL RIPA缓冲液稀释,混匀后冰上放置40 min,4℃,10 000 r/min离心15 min,取上清液作为样品。取50 μL样品加入上样孔,电泳后转印至硝酸纤维素膜。TBS封闭过夜,次日TBS洗膜,加入1∶400一抗室温孵育12 h,加入(1∶2 000)二抗室温孵育2 h,清洗后采用凝胶成像分析软件分析检测电泳条带的灰度值。
1.7 统计学方法 采用SPSS21.0统计软件进行数据分析,计量资料以(s)表示,数据进行方差齐性检验,组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 大鼠肺组织病理变化情况 栓塞4 h,大鼠肺组织病理变化主要表现为轻中度水肿、出血,伴有肺泡壁增厚、炎症细胞浸润等,未发生明显细胞坏死。正常对照组大鼠肺泡结构正常,血管内无血栓,未见明显炎症细胞浸润;假手术组大鼠与正常对照组情况相似,但肺间质间表现出少量炎症细胞浸润;模型组大鼠肺组织可见凝血血栓,肺泡肿胀增厚,血管周围出现大量炎症细胞浸润;丹参多酚酸盐组大鼠肺组织血栓减少,炎症症状减轻。
栓塞72 h,正常对照组大鼠肺组织与4 h时无明显差异;假手术组大鼠出现轻度肺泡壁水肿;模型组大鼠肺组织病理变化主要表现为明显的肺泡壁充血,伴肺气肿,轻、中度单核巨噬细胞、中性粒细胞浸润,肺泡腔内有水肿液,坏死区支气管上皮折叠与管壁分离,坏死区出血;丹参多酚酸盐组大鼠肺组织结构与正常对照组、假手术组相似,病理变化主要表现为轻、中度肺泡壁水肿,伴有少量炎症细胞浸润。(见图1)
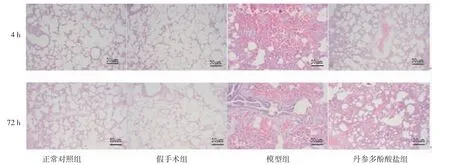
图1 各组大鼠肺组织病理变化(HE,×200)
2.2 各组大鼠不同时期血清炎症因子水平比较 假手术组大鼠在各时间点血清TNF-α、IL-1β、IL-8水平与正常对照组比较,差异均无统计学意义(P>0.05)。栓塞4 h,模型组大鼠血清TNF-α、IL-8水平明显高于正常对照组(P<0.05);4组大鼠血清IL-1β水平比较,差异均无统计学意义(P>0.05);丹参多酚酸盐组大鼠血清IL-8水平明显低于模型组(P<0.05)。
栓塞72h,模型组大鼠血清TNF-α、IL-1β、IL-8水平均明显高于正常对照组(P<0.05);丹参多酚酸盐组大鼠血清TNF-α、IL-1β、IL-8水平均明显低于模型组(P<0.05);模型组大鼠栓塞72 h血清TNF-α、IL-8含量明显高于栓塞4 h(P<0.05)。(见表1)
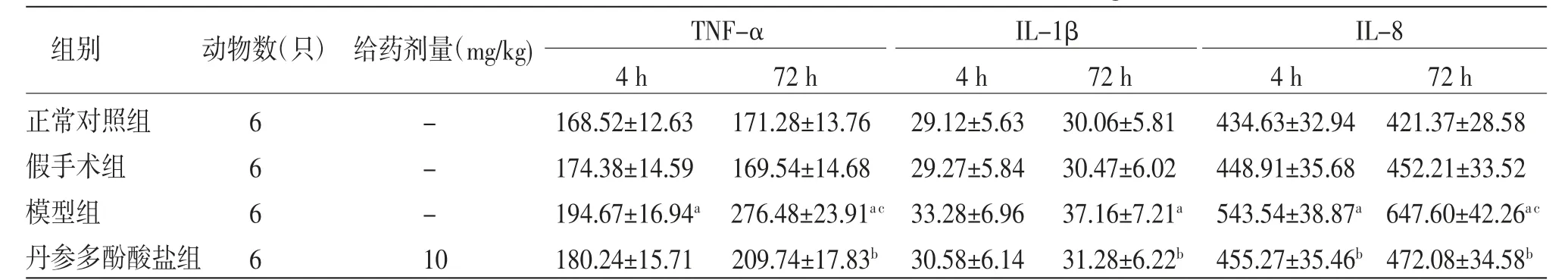
表1 各组大鼠不同时期血清炎症因子水平比较(x±s,ng/L)
2.3 各组大鼠肺组织CX3CR1、NF-κB阳性细胞计数比较 栓塞4 h、72 h后,假手术组大鼠肺组织CX3CR1、NF-κB阳性细胞数与正常对照组比较,差异均无统计学意义(P>0.05);模型组大鼠肺组织CX3CR1、NF-κB阳性细胞数均明显多于正常对照组(P<0.05);丹参多酚酸盐组大鼠肺组织CX3CR1、NF-κB阳性细胞数明显少于模型组(P<0.05)。模型组大鼠栓塞72 h肺组织NF-κB阳性细胞数明显少于栓塞4h(P<0.05)。(见表2、图2~3)
表2 各组大鼠肺组织CX3CR1、NF-κB阳性细胞计数比较±s,个)

表2 各组大鼠肺组织CX3CR1、NF-κB阳性细胞计数比较±s,个)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与栓塞4 h比较,cP<0.05
CX3CR1 NF-κB 4 h 72 h 4 h 72 h正常对照组 6 - 11.79±4.68 10.52±3.54 15.63±4.72 15.81±4.88假手术组 6 - 10.87±4.62 11.76±5.08 18.57±5.63 15.47±4.56模型组 6 - 20.94±4.73a 20.36±5.42a 51.74±8.92a 31.97±6.85ac丹参多酚酸盐组 6 10 13.17±4.39b 14.62±6.03b 21.74±4.92b 18.17±4.59b组别 动物数(只)给药剂量(mg/kg)
2.4 各组大鼠肺组织CX3CR1、NF-κB蛋白表达水平比较 假手术组大鼠各时间点肺组织CX3CR1、NF-κB蛋白表达水平与正常对照组比较,差异均无统计学意义(P>0.05)。栓塞4 h、72 h后,模型组大鼠CX3CR1、NF-κB蛋白表达水平明显高于正常对照组(P<0.05);丹参多酚酸盐组大鼠CX3CR1、NF-κB蛋白表达水平明显低于模型组(P<0.05)。模型组、丹参多酚酸盐组大鼠栓塞72 h肺组织CX3CR1、NF-κB蛋白表达水平均明显低于栓塞4 h(P<0.05)。(图4~5、见表3)

图4 各组大鼠肺组织CX3CR1蛋白表达电泳图

图5 各组大鼠肺组织NF-κB蛋白表达电泳图
表3 各组大鼠肺组织CX3CR1、NF-κB蛋白表达水平比较

表3 各组大鼠肺组织CX3CR1、NF-κB蛋白表达水平比较
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与栓塞4 h比较,cP<0.05
CX3CR1 NF-κB 4 h 72 h 4 h 72 h正常对照组 6 - 0.96±0.03 0.97±0.02 0.98±0.03 0.99±0.01假手术组 6 - 0.98±0.02 0.99±0.01 0.99±0.02 0.98±0.02模型组 6 - 1.74±0.08a 1.42±0.07a c 1.81±0.09a 1.47±0.08a c丹参多酚酸盐组6 10 1.48±0.07b 1.28±0.07b c 1.39±0.07b 1.08±0.06b c组别 动物数(只)给药剂量(mg/kg)
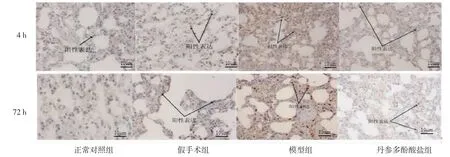
图3 各组大鼠肺组织NF-κB蛋白表达情况比较(免疫组化,×100)
3 讨 论
2014年欧洲心脏病学会指出[7],APE是静脉血栓栓塞症最严重的表现。其主要致病机制包括血液高凝、血管内皮损伤等[8]。王清鹤等[9]通过对比肺腺癌合并肺栓塞、单纯肺腺癌、单纯肺栓塞与健康志愿者发现,炎症反应、NF-κB信号通路、补体反应等均参与到疾病病理过程中。APE病理过程中,血管内皮细胞、白细胞、血小板间的黏附作用促进了血栓形成,血栓形成后对肺动脉造成阻塞引起呼吸、循环功能障碍,同时产生大量炎症细胞,不断加重APE病理程度。CX3CL1是趋化因子CX3C家族中的唯一成员,其具有细胞黏附分子与趋化蛋白的功能,可以募集中性粒细胞、单核细胞、淋巴细胞,在内皮细胞损伤过程中发挥重要作用[10]。SUKKAR M B[11]等研究指出,CX3CL1在慢性阻塞性肺疾病、支气管哮喘等疾病中起了到趋化T淋巴细胞、单核细胞与细胞黏附分子的作用,能够与特应性受体CX3CR1相结合促使血管内皮细胞与炎症细胞相黏附,并参与血管炎的病理过程。CX3CL1和CX3CR1广泛分布于机体各处,因此在许多慢性炎症疾病中均可发现CX3CL1、CX3CR1表达水平明显上调。此外,APE发生时会对NF-κB产生刺激作用,使其从静息状态转变为激活状态,并对APE病理生理过程的相关基因进行调控,释放TNF-α、IL-1β、IL-8等炎症因子,放大并持续炎症反应。由于NF-κB广泛存在于各类细胞中,因此APE发生时其表达水平也会明显上调。
当前,APE的主要治疗方法为抗凝溶栓治疗,但西医治疗存在大出血的风险。中医治疗肺系疾病多注重化痰活血药物的应用,相对于单纯的西医治疗,中医治疗APE通常可以减轻患者治疗过程中的药物不良反应。有研究指出[12-14],清热解毒扶正颗粒、二陈汤、止咳定喘汤等补气化痰方均能有效抑制NF-κB活性,为APE的防治工作提供了新思路。中医学将APE归于“痰饮”“喘证”“胸痹”等范畴,认为其病机在于痰浊、血瘀、气虚,祛瘀、补气、化痰是APE的主要治疗原则[15]。丹参具有通脉、活血、化瘀的功效,丹参多酚酸盐从是丹参中提取的有效成分。有研究[16-17]表明丹参多酚酸盐含有丹参乙酸镁,可以抑制机体炎症反应,保护血管内皮细胞,并起到抗细胞凋亡、抗炎、抑制氧化应激、改善微循环等功效。我们推测丹参多酚酸盐可以对APE大鼠肺组织起到一定的保护作用,其具体作用机制可能与抑制APE大鼠肺组织炎症反应、CX3CR1表达水平与NF-κB信号通路有关。故设计动物学实验复制APE大鼠模型验证以上猜想。
APE大鼠肺组织HE染色结果表明,APE大鼠肺组织主要的病理变化为肺泡壁血管充血、轻度扩张,并伴有轻、中度水肿,可见炎症细胞浸润。栓塞4 h后各组大鼠肺组织HE染色结果表明,丹参多酚酸盐组大鼠肺损伤程度减轻,但相对模型组仅略有缓解,效果并不明显。栓塞72 h后,APE大鼠肺组织主要病理改变为肺泡壁血管充血、高度扩张,伴有肺出血与肺泡壁坏死。此时与模型组比较,丹参多酚酸盐组大鼠肺损伤程度明显减轻,提示丹参多酚酸盐可以有效缓解APE带来的肺组织病理损害,对肺组织具有一定的保护作用。柴海强[18]发现丹红注射液联合利伐沙班可以有效改善APE患者的凝血功能与微循环,认为与丹红注射液活血化瘀功效有关。研究[19-20]表明丹参多酚酸盐具有降低血清TNF-α、IL-8水平,减少血管内皮损伤的功效。可以预见丹参多酚酸盐不仅可以活血化瘀,缓解APE病理症状,同时可以起到抗炎功效,改善肺循环。本研究表明栓塞72 h,丹参多酚酸盐组大鼠血清TNF-α、IL-1β、IL-8水平均低于模型组(P<0.05),提示丹参多酚酸盐减轻了APE大鼠机体炎症反应,与以上研究结果相似。我们猜想丹参多酚酸盐可以通过减轻机体炎症反应,从而抑制NF-κB信号通路激活与CX3CR1表达,避免进一步的炎症细胞浸润与血管内皮细胞损伤。免疫组化与蛋白印迹结果表明,模型组大鼠CX3CR1、NF-κB呈高表达,阳性细胞计数及蛋白表达水平明显高于其余各组(P<0.05)。栓塞4 h后,丹参多酚酸盐组大鼠CX3CR1、NF-κB蛋白表达水平均低于模型组,但仍高于正常对照组与假手术组,栓塞72 h后,丹参多酚酸盐组大鼠CX3CR1、NF-κB蛋白表达水平与正常对照组与假手术组相近,提示丹参多酚酸盐可以下调大鼠CX3CR1、NF-κB蛋白表达水平,从而起到保护大鼠肺组织,减轻APE损伤的效果。根据以上研究结果,我们推测APE发生后,内源性或外源性血栓进入肺动脉内造成呼吸循环系统障碍并引起血管内皮细胞缺氧缺血与机械性损伤,激活NF-κB信号通路并上调CX3CL1、CX3CR1表达水平,促使TNF-α、IL-1β、IL-8等炎症因子分泌与释放,从而扩大炎症反应加重肺组织损伤。丹参多酚酸盐可以下调CX3CR1表达水平,抑制NF-κB信号通路活化,破坏炎症级联反应,从而改善APE的病理过程。
综上所述,丹参多酚酸盐能够减轻APE大鼠肺组织损伤,可能与抑制肺组织中CX3CR1、NF-κB蛋白表达,减轻机体炎症反应水平有关。

