牛膝醇提物对实验兔膝骨关节炎模型AMPK/Wnt/MAPK信号通路串话的影响*
马笃军,华树良,彭力平,蒋顺琬,曹亚飞,高 坤,王立新,莫益斌
(1.广州中医药大学第四临床医学院,广东 深圳 518033;2.百色市人民医院/右江民族医学院附属西南医院,广西 百色 533000;3.百色市人民医院隆林分院,广西 隆林 533499)
骨关节炎(osteoarthritis,OA)以关节软骨退行性变为核心病理改变,好发于中老年人[1]。近年来,膝关节OA在年轻人群中发病越来越多。OA致残率高,对健康危害极大,给患者、家庭和社会带来了巨大的经济负担,目前尚无理想治疗药物[2]。前期研究表明牛膝对实验兔OA模型关节软骨损伤具有促进修复作用[3-4],具体信号通路不清楚。信号通路可在分子水平上对疾病的发生、发展及治疗机制进行解释,而OA的发病机制涉及多种信号通路互作,不是局部或者单一发生作用,因此治疗也应该从整体出发进行多通路互作研究[5]。故课题组拟深入研究探讨牛膝有效成分醇提物对实验兔膝OA模型腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)/Wnt/丝裂原活化蛋白激酶(mitogen-activatedproteinkinase,MAPK)信号通路的影响,现报告如下。
1 材料与方法
1.1 实验动物2~3个月龄普通级健康新西兰大白兔64只,雌、雄各半,体质量(1.36±0.73)kg,购自广东省实验动物中心,动物生产许可证号:SCXK(粤)2019-0035。饲养环境:温度20℃,湿度40%。于2019年1月至2019年12月在广州中医药大学第四临床医学院中心实验室、深圳市中医药研究所完成,获得实验动物伦理委员会批准,实验操作符合2006年中华人民共和国科学技术部颁布的《关于善待实验动物的指导性意见》。
1.2 药物与试剂 牛膝醇提物(怀牛膝,广州中医药大学第四临床医学院药剂科制备,院内制剂);10%甲醛标本固定液、环氧合酶-2(cyclooxygenase-2,Cox2)抗体(货号:4842S)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)抗体(货号:9252S)、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)抗体(货号:9102S)、P38抗体(货号:9212s)(CST公司);AMPK抗体(Lifespan公司,货号:LS-B14414-50);β-连环蛋白(β-catenin)抗体(Merck公司,货号:MAB2081);Tubulin抗体(Genetex公司,货号:GTX11214);苏木素染料抗体(Servicebio公司,货号:G1004)。
1.3 主要仪器EG11504型包埋机、ASP300S脱水机、EG1150C型冷却台、RM2235型切片机(Leica公司);Mshot MF53型显微镜(广州明美光电);EPS-200型电泳仪、VE180C电泳槽、VE-586型转膜槽(誉维生物)。
1.4 造模与分组 将64只实验兔按照随机数字表法分为造模组50只、空白对照组(未造模)14只,将实验兔右膝关节用棉垫包裹好后于伸直位管型石膏固定制动6周,石膏外层缠绷带[6]。每天监测生命体征、查看石膏固定松紧情况。造模6周后,从造模组和空白对照组各随机抽取2只实验兔进行膝关节比较,空气栓塞法处死,从兔右膝髌骨内侧纵行切开,行膝关节标本大体观察,取胫骨平台同一部位3mm×5 mm软骨组织,留作病理HE染色,观察组织结构。造模成功标准参照改良Mankin's评分标准[3]:关节表面出现不规则裂隙、软骨基质染色减退、软骨潮线结构不完整。造模成功后,将48只实验兔随机分为模型对照组、牛膝醇提物低剂量组、牛膝醇提物中剂量组、牛膝醇提物高剂量组,每组12只。
1.5 实验给药 怀牛膝在2015年版《中华人民共和国药典》[7]人体常规最高用量为每日12 g,根据药物试验等效剂量换算,实验兔每日用量约1 g/kg,牛膝醇提物每毫升醇提液相当于含原材料1 g。按照常规用药量的1、3、6倍,分别予牛膝醇提物低、中、高剂量组实验兔低、中、高剂量[1、3、6 mg/(kg·d)]牛膝醇提物灌胃,2次/d,每次灌胃时用蒸馏水配成15 mL,连续用药6周。空白对照组、模型对照组按照上述灌胃方法,予等量蒸馏水灌胃,15 mL/次,2次/d,连续6周。
1.6 观察指标
1.6.1 软骨组织病理学HE染色观察 实验兔连续灌胃6周后用过度麻醉处死实验兔,然后用手锯小心切取右膝胫骨平台外侧髁负重区同部位3 mm×5 mm软骨组织,新鲜标本以10%中性甲醛溶液固定48 h,3%硝酸溶液脱钙24~36 h,然后常规脱水、包埋,连续切片,厚4~5 μm,进行HE染色。
1.6.2 软骨组织改良Mankin’s评分 软骨组织HE染色后光镜下观察形态变化,采用改良Mankin’s法对关节软骨结构、细胞、染色及潮线的完整性进行评分。评分标准见表1。
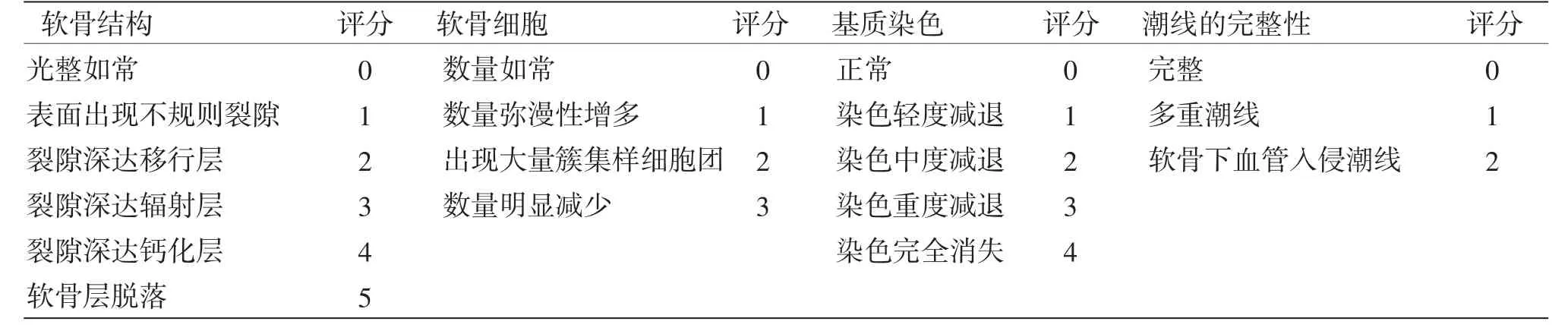
表1 切片关节软骨组织学改良Mankin’s评分表
1.6.3 免疫组化检测关节软骨AMPK、ERK、JNK、p38、COX-2、β-Catenin蛋白表达 留取软骨组织,新鲜标本以10%中性甲醛溶液固定48 h,然后常规脱水,石蜡包埋,连续切片,厚3~4 μm,留做免疫组化染色,测定AMPK、ERK、JNK、p38、COX-2、β-Catenin蛋白表达情况。具体操作步骤如下,石蜡切片脱蜡至水:依次将切片放入二甲苯Ⅰ15min-二甲苯Ⅱ15 min-二甲苯Ⅲ15 min-无水乙醇Ⅰ5 min-无水乙醇Ⅱ5 min-85%酒精5 min-75%酒精5 min蒸馏水洗。抗原修复:组织切片置于盛满EDTA抗原修复缓冲液的修复盒中于微波炉内进行抗原修复,中火8 min至沸,停火8 min保温再转中低火7 min,此过程中应防止缓冲液过度蒸发,切勿干片。自然冷却后将玻片置于PBS中在脱色摇床上晃动洗涤3次,5 min/次。阻断内源性过氧化物酶:切片放入3%双氧水溶液,室温避光孵育10 min,将玻片置于PBS中在脱色摇床上晃动洗涤3次,5 min/次。血清封闭:在组化圈内滴加5%山羊血清均匀覆盖组织,室温封闭30 min。加一抗:轻轻甩掉封闭液,在切片上滴加按一定比例配好的一抗,切片平放于湿盒内4℃孵育过夜。加二抗:一抗室温复温30 min,玻片置于PBS中在脱色摇床上晃动洗涤3次,5 min/次。切片稍甩干后在圈内滴加与一抗相应种属的二抗(HRP标记)覆盖组织,室温孵育50 min。DAB显色:玻片置于PBS(pH=7.4)中在脱色摇床上晃动洗涤3次,5 min/次。切片稍甩干后在圈内滴加新鲜配制的DAB显色液,显微镜下控制显色时间,阳性为棕黄色,自来水冲洗切片终止显色。复染细胞核:苏木素复染5 min左右,自来水洗,苏木素分化液分化数秒,自来水冲洗,苏木素返蓝液返蓝,流水冲洗。脱水封片:将切片依次放入75%酒精5 min-85%酒精5 min-无水乙醇Ⅰ5 min-无水乙醇Ⅱ5 min-二甲苯Ⅰ5 min-二甲苯Ⅱ5 min中脱水透明,将切片从二甲苯拿出来稍晾干,中性树胶封片。显微镜下采集图像。蓝色的为细胞核,棕色的为阳性点。
1.6.4 Western blotting检测关节软骨AMPK、ERK、JNK、p38、COX-2、β-Catenin蛋白表达 取软骨组织剪碎后,加蛋白裂解液,用组织匀浆器研磨(加蛋白酶抑制剂1∶100+PMSF 1∶100+磷酸酶抑制剂1∶100)冰上裂解,4℃12 000 r/min离心15 min,离心半径60 mm,BCA蛋白浓度测定试剂盒检测总蛋白量,水浴变性5 min,冷却后上样,跑胶,电转,封闭,加入一抗:按照抗体说明书稀释抗体,用5%BSA的TBST稀释,4℃孵育过夜,TBST洗涤5次,加入二抗:按照兔1∶10 000,鼠1∶5 000稀释抗体,TBST稀释、洗涤,显色:按1∶1配制发光液,覆盖在膜表面,最后图像采集分析。
1.6.5 AMPK/Wnt/MAPK信号通路关键蛋白相互作用网络机制预测 根据https://string-db.org/网址预测绘制AMPK/Wnt/MAPK信号通路关键蛋白AMPK、Wnt、MAPK、ERK2、JNK(SAPK)、p38、COX-2、beta-catenin相互作用网络机制图。
1.7 统计学方法 采用SPSS25.0统计软件分析,计量资料用“均数±标准差”(±s)表示。采用单因素方差分析,不满足方差分析时用非参数检验,P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 造模6周后,未见实验兔固定肢体出现坏死、褥疮等表现,空白对照组兔膝关节表面光滑,造模组兔膝关节有骨质增生、不规则裂隙、关节面硬化等表现。(见图1)造模过程未出现实验动物死亡,灌胃过程中出现3只实验兔死亡,其中模型对照组1只、牛膝醇提物中剂量组1只、牛膝醇提物高剂量组1只,造成实验兔死亡原因主要考虑是灌胃操作不当,导致药液灌入肺中造成窒息急性死亡。
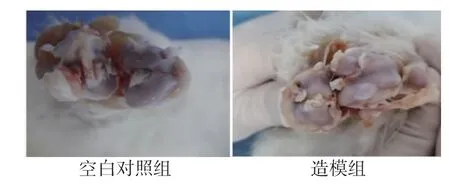
图1 两组兔膝关节表面比较
2.2 各组兔软骨组织病理学改变情况 空白对照组兔软骨组织潮线结构、软骨细胞形态、软骨细胞排列纹理、基质染色等未见明显改变。模型对照组兔软骨组织血管入侵潮线结构,软骨细胞数量明显减少,软骨细胞排列纹理、基质染色变浅。牛膝醇提物低、中、高剂量组兔局部软骨表面可见不规则裂隙,达钙化层,软骨细胞数量增多,基质染色呈浅红色,潮线结构稍正常,与剂量呈递增趋势。(见图2)

图2 各组兔软骨组织病理改变(HE,×100)
2.3 各组兔膝关节病理学改良Mankin’s评分比较 模型对照组兔膝关节病理学改良Mankin’s评分明显高于空白对照组(P<0.01);牛膝醇提物中、高剂量组兔膝关节病理学改良Mankin’s评分明显低于模型对照组(P<0.05或P<0.01),牛膝醇提物低剂量组兔膝关节病理学改良Mankin’s评分与模型对照组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组兔膝关节病理学改良Mankin’s评分比较
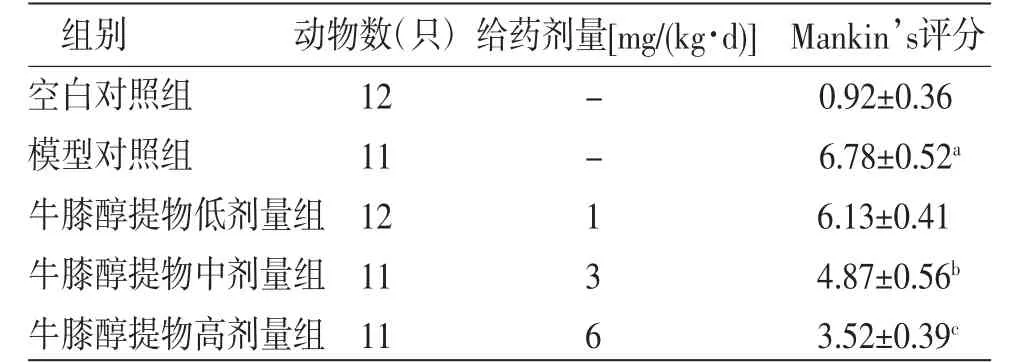
表2 各组兔膝关节病理学改良Mankin’s评分比较
注:与空白对照组比较,aP<0.01;与模型对照组比较,bP<0.05,cP<0.01
?
2.4 各组兔膝关节软骨AMPK、ERK、JNK、p38、COX-2、β-Catenin蛋白表达比较 免疫组化结果显示,模型对照组兔膝关节软骨ERK、JNK、p38、COX-2、β-Catenin蛋白表达明显高于空白对照组(P<0.05),AMPK蛋白表达与空白对照组比较,差异无统计学意义(P>0.05);牛膝醇提物低、中、高剂量组兔膝关节软骨ERK、JNK、p38、COX-2、β-Catenin蛋白表达明显低于模型对照组(P<0.05);牛膝醇提物高剂量组兔膝关节软骨AMPK蛋白表达明显高于模型对照组(P<0.05),牛膝醇提物低、中剂量组兔膝关节软骨AMPK蛋白表达与模型对照组比较,差异无统计学意义(P>0.05)。(见图3~4)
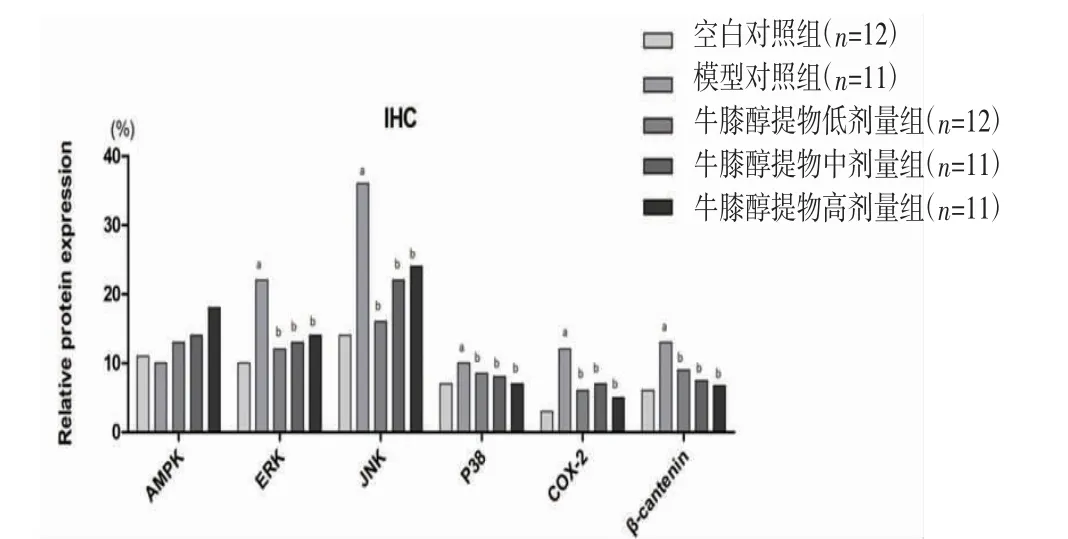
图3 各组兔膝关节软骨AMPK、ERK、JNK、p38、COX-2、β-Catenin表达比较)
Western blotting结果显示,模型对照组兔膝关节软骨ERK、JNK、p38、COX-2、β-Catenin蛋白表达明显高于空白对照组(P<0.05),AMPK蛋白表达与空白对照组比较,差异无统计学意义(P>0.05);牛膝醇提物低、中、高剂量组兔膝关节软骨ERK、JNK、p38、COX-2、β-Catenin蛋白表达明显低于模型对照组(P<0.05);牛膝醇提物高剂量组兔膝关节软骨AMPK蛋白表达明显高于模型对照组(P<0.05),牛膝醇提物低、中剂量组兔膝关节软骨AMPK蛋白表达与模型对照组比较,差异无统计学意义(P>0.05)。(见图5)
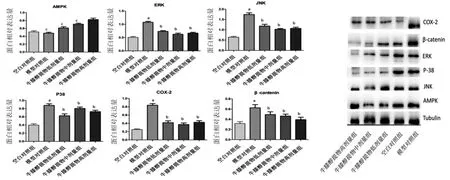
图5 各组兔膝关节软骨组织AMPK、ERK、JNK、p38、COX-2、β-Catenin蛋白表达Western blotting检测结果
2.5 AMPK/Wnt/MAPK信号通路关键蛋白相互作用网络机制预测图 在https://string-db.org/网址输入AMPK/Wnt/MAPK信号通路AMPK、Wnt、MAPK、ERK2、JNK(SAPK)、p38、COX-2、β-Catenin关键蛋白,可以输出关键蛋白之间相互作用网络机制三级预测图(来源:https://string-db.org/cgi/network.pl?taskId=qjKGQTZkskFu)。蛋白预测图结果显示,Akt家族蛋白节点最多,其次为Mapk家族蛋白节点,因此,Akt家族蛋白、Mapk家族蛋白在牛膝醇提物对AMPK/Wnt/MAPK信号通路网络互作之间的联系起了到关键桥接蛋白作用。(见图6)
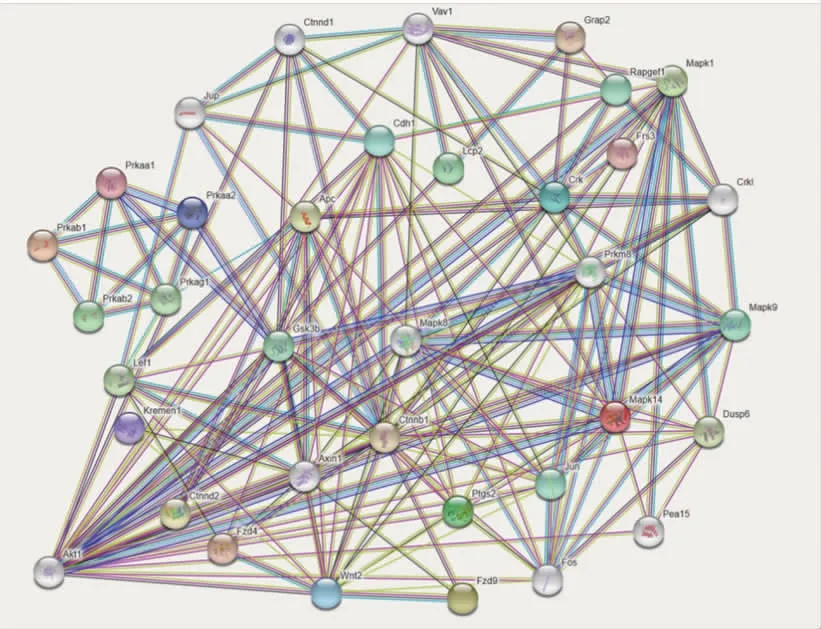
图6 牛膝醇提物对AMPK/Wnt/MAPK信号通路关键蛋白相互作用网络机制预测图
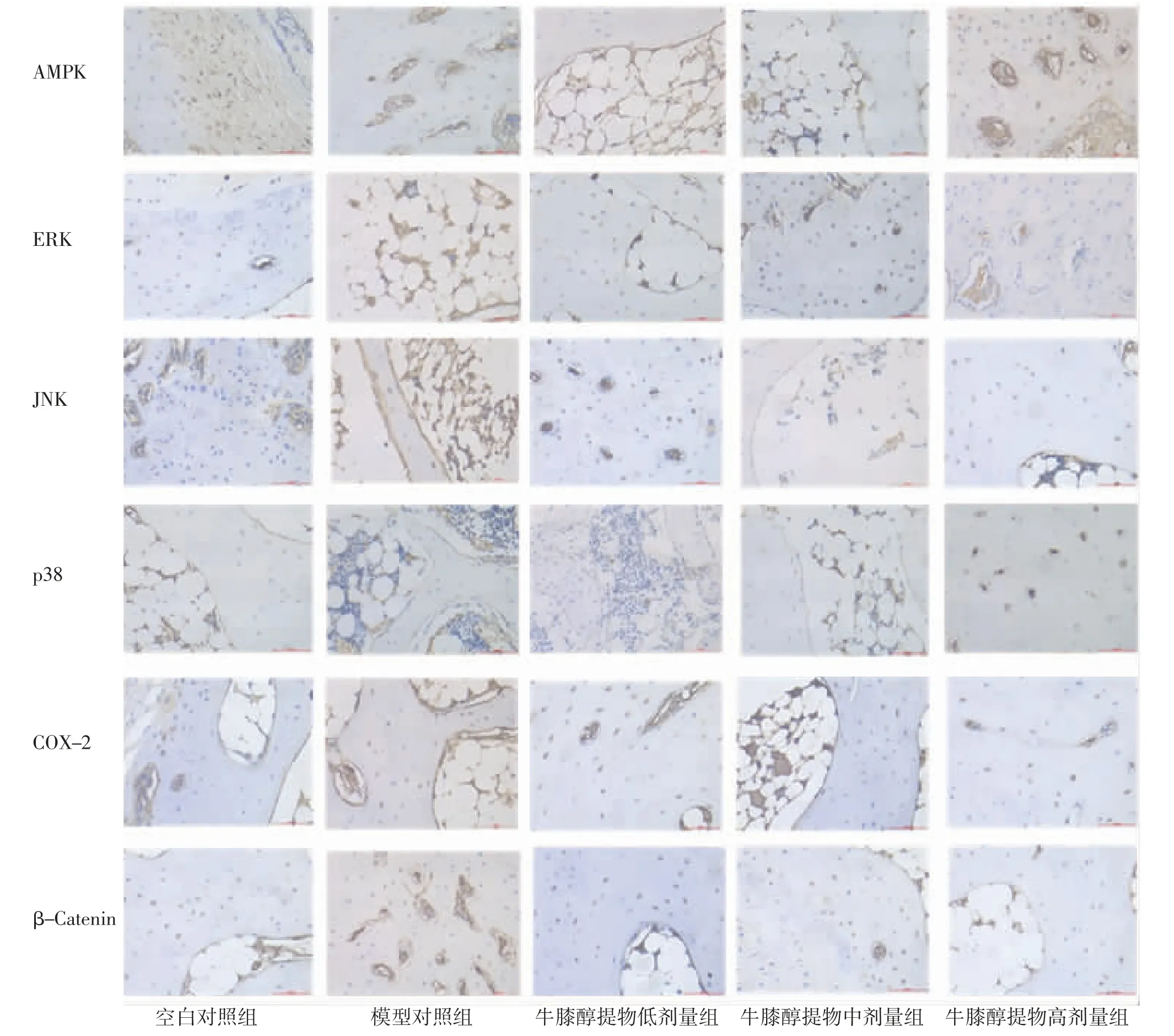
图4 各组兔膝关节软骨组织AMPK、ERK、JNK、p38、COX-2、β-Catenin免疫组化图(×100)
3 讨 论
OA是临床常见病,虽然手术治疗OA发展迅速,如自身软骨或软骨细胞移植、关节置换等,但只适于极少数患者,药物治疗仍最常用[8]。但目前的药物仍存在一定的副作用,有些制剂还处于探索研究阶段,不能在临床常规应用。因此如何恢复关节软骨的完整性和正常功能,是目前OA研究的重点和难点[9]。
中医药治疗骨关节炎有一定的优势,中药含有多种有效成分,可多途径、多靶点发挥作用而提高疗效。牛膝是在此类中药中较为突出的一味,其主要有效成分包含黄酮类、甾酮类、多糖类、皂苷类等[10-12]。现代药理研究表明,黄酮类成分能抑制IL-6等炎症因子的分泌,通过AMPK通路抑制NF-κB向细胞核转移,导致细胞核内NF-κB的表达水平降低来抑制炎症因子;甾酮类成分可借助激活ERK/MAPK信号通路途径促进细胞增殖和细胞抗氧化作用;多糖类成分可通过上调Wnt-4、Frizzled-2、β-Catenin和cyclin D1的表达,下调GSK-3β的表达,激活Wnt/β-Catenin信号通路,促进Ⅱ型胶原的合成,达到软骨保护作用;皂苷类成分能通过降低Wnt通路β-Catenin蛋白磷酸化来下调β-CateninmRNA的表达和抑制Wnt信号通路,下调TGF-β1表达发挥抑制系膜细胞增殖的作用。因此,AMPK/Wnt/MAPK信号通路串话可能是牛膝醇提物对OA软骨修复作用的信号交互通路之一。
软骨细胞生长、成熟受多因素的影响,多种细胞因子和信号转导通路参与其中,组成了一个复杂多变的分子生物网络系统[13]。AMPK、Wnt和MAPK信号传导通路参与调节正常细胞生长、增殖、迁移、分化,调控正常组织重建,其发生异常改变与人类关节病变密切相关[14-15]。腺苷酸活化蛋白激酶(AMPK)是细胞的能量感受器,在关节软骨细胞中,AMPK能被异常激活,AMPK磷酸化的激活可促进mTOR、P13K减少细胞凋亡[16]。本研究免疫组化和Western blotting结果显示牛膝醇提物能有效上调AMPK表达,说明牛膝醇提物具有减少软骨细胞凋亡的能力。Wnt/β-Catenin通路是一种独特的信号通路,可影响关节炎的发生、发展,主要是通过调节软骨细胞的分化、增殖、凋亡,以及调节关节软骨细胞外基质的合成与分解等而发挥调节作用,还可通过COX-2、IL、BMP2、MMPs、aggrecanases、RANKL/OPG比值变化来影响软骨代谢[17]。前期实验证实[4],怀牛膝有效醇提物含药血清在体外能有效地促进软骨细胞增殖、Ⅱ型胶原蛋白表达及糖胺聚糖的分泌。陈达等[18]对兔OA模型用牛膝醇提物灌胃后发现,实验组血液和关节液中IL-1β、TNF-α和MMP-3等炎症介质的含量明显低于空白对照组。目前的研究认为Wnt/β-Catenin信号通路是OA软骨破坏病程中最重要的信号通路之一,与本实验中软骨组织免疫组化病理、Western blotting结果提示牛膝醇提物能降低COX-2、β-Catenin蛋白表达相符合,表明Wnt/β-Catenin通路可能是牛膝醇提物促进软骨细胞增殖和抗凋亡的作用机制之一。MAPK是哺乳动物体内广泛存在的一类丝氨酸/苏氨酸蛋白激酶,在OA病理过程中MAPK信号通路也参与并调节软骨细胞的凋亡、肥大化、钙化及增殖等生物学反应,例如当关节内炎症因子增多时,可激活细胞内的MAPK信号转导途径,引起MMPs表达增加、软骨细胞凋亡、软骨破坏等一系列反应,其中MAPK家族参与了OA发病的有JNK、p38和ERK,在MAPK家族中ERK主要受生长因子的激活,而JNK/p38通路则主要受细胞外的应激,以及细胞因子和低氧因素刺激而活化,并且在对软骨细胞的调节中3种亚型可以独自或同时被激活。本实验中ERK、JNK、p38蛋白在模型对照组高表达,在牛膝醇提物低、中、高剂量组表达依次呈降低趋势,说明牛膝醇提物对MAPK信号通路具有一定抑制作用。String蛋白预测图结果显示Akt家族蛋白、Mapk家族蛋白在牛膝醇提物对AMPK/Wnt/MAPK信号通路网络互作之间桥接蛋白节点最多,说明MAPK/AKT信号通路在牛膝醇提物治疗OA中发挥了不可替代的作用,与报道相符[19-20]。
本研究观察了牛膝醇提物对实验兔膝关节OA模型AMPK/Wnt/MAPK信号网络通路的影响,结果显示牛膝醇提物能改善兔膝关节OA模型病理评分,有效上调AMPK通路AMPK蛋白表达,下调Wnt通路β-Catenin、COX-2蛋白,以及MAPK通路JNK、P38、ERK蛋白表达;蛋白互作网络预测结果表明Akt家族蛋白、Mapk家族蛋白在牛膝醇提物对AMPK/Wnt/MAPK信号通路网络互作之间的联系起到了关键桥接蛋白作用,对证实牛膝治疗膝骨关节炎具有重要的基础理论意义,但具体的作用位点还需要深入研究。

