Bar基因双元载体的快速构建及其在蛹虫草中的功能验证
娄海伟,林俊芳,赵仁勇,叶志伟,田双起,王新伟,郭丽琼*,赵 玉*
(1 河南工业大学粮油食品学院 郑州 450001 2 华南农业大学食品学院 广州 510642)
蛹虫草 (Cordyceps militaris) 又名北冬虫夏草,是虫草属的模式种,已实现人工规模化栽培。蛹虫草作为一种新食品原料,其菌丝体和子实体富含多种生物活性成分,如虫草素[1]、免疫调节蛋白[2]、虫草多糖[3]、新型黄色素[4-5]、喷司他丁[6]等,具有抗癌[7]、免疫调节[2-3]、抗炎[8]、抗氧化[9]等功效。基于此,蛹虫草的市场需求量逐年增多,在东南亚国家被广泛食用,目前在西方国家亦得到广泛推广。
虽然蛹虫草含有多种生物活性成分,但是其含量较低,不能满足市场需求。提高蛹虫草生物活性成分的含量是亟待解决的关键问题。采用基因工程方法(如异源表达、关键基因超表达等)可从根本上解决这一问题,然而需要鉴定(活性物质生物合成途径中)关键基因的功能。鉴定基因功能的方法有基因敲除[10]、基因超表达[11]、RNA 干扰[12]等技术,然而,使用上述技术需要选择标记基因来筛选目标转化子,目前在蛹虫草基因功能鉴定中被广泛使用的筛选标记基因为膦丝菌素(Phosphinothricin)乙酰转移酶基因(即Bar基因)[13-14]。
构建载体较常用的方法为T4 DNA 连接酶法[15],通过对载体、插入片段进行限制性内切酶酶切,然后在T4 DNA 连接酶的作用下实现载体和插入片段的连接;而同源重组法构建载体是一种较新的方法[16],通过限制性内切酶酶切或者PCR方法制备线性载体,然后在重组酶的作用下实现线性载体和插入片段的重组。上述两种构建载体的方法,哪一种更快速、更高效,目前未见对比上述两种方法的相关报道。本研究首先采用双接头PCR(Double-joint PCR,DJ-PCR)方法构建Bar基因表达盒;其次,以双元载体pAg1-H3 作为出发载体,通过构建标记基因载体(pAg-Bar),比较两种载体构建方法 (T4 DNA 连接酶法和同源重组法)的效果,旨在获得一种更快速、高效的载体构建方法。最后通过农杆菌介导转化法(Agrobac terium tumefaciens-mediated transformation,ATMT)来验证载体pAg-Bar 的有效性及Bar基因在蛹虫草中的功能。为促进蛹虫草基因功能鉴定,加快蛹虫草活性物质代谢通路研究,以及通过生物技术方法提高蛹虫草活性物质的产量奠定基础。
1 材料和方法
1.1 菌株与试剂
大肠杆菌DH5α,天根生化科技公司;农杆菌AGL1,上海唯地生物技术有限公司;蛹虫草菌株CM10、质粒pCAMBIA3301(含Bar基因),保藏于华南农业大学食品学院天然产物实验室;质粒pAg1-H3(含构巢曲霉的PtrpC启动子、TtrpC终止子),中国科学院微生物研究所刘钢研究员馈赠;草铵膦(Basta),德国Bayer 公司;琼脂糖(Agarose G-10),Biowest 公司;质粒抽提试剂盒、DNA 纯化试剂盒、基因组抽提试剂盒,美基生物公司;PrimeSTAR Max DNA 聚合酶,Takara 公司;KOD FX DNA 聚合酶,Toyobo 公司;T4 DNA 连接酶、限制性内切酶(Hind III 和EcoR I),Thermo Fisher Scientific 公司;无缝克隆试剂盒,Abm 公司;卡那霉素(Kanamycin),Amresco 公司;头孢噻肟(Cefotaxime),Solarbio 公司;乙酰丁香酮(Acetosyringone),广州赛国公司;硫酸铵、磷酸二氢钾、磷酸氢二钾、硫酸镁等试剂均为分析纯级,广州化学试剂厂。
1.2 培养基
LB(Luria broth)培养基,参照李晓霞等[17]的方法;PDA(Potato dextrose agar)培养基,参照娄海伟等[5]的方法;液体诱导培养基(Induction liquid medium,IM)、固体诱导培养基 (Induction solid medium,CO-IM),参照Zheng 等[18]的方法。
1.3 仪器与设备
SW-CJ-1FD 超净工作台,江苏安泰有限公司;MJ-Ⅱ霉菌培养箱,上海一恒科技有限公司;DMi8L 徕卡显微镜,德国徕卡有限公司;凝胶成像系统Gel Doc XR+、C1000 PCR 仪,Bio-Rad 公司;ND-1000 超微量分光光度计,NanoDrop 公司;FRESCO21 冷冻离心机,Thermo Fisher Scientific公司。
1.4 方法
1.4.1 草铵膦抑制蛹虫草生长的浓度梯度试验转化蛹虫草较常用的方法为ATMT 法[18],使用的受体细胞为分生孢子。本文研究草铵膦对蛹虫草分生孢子的抑制效果。根据有关报道,完全抑制蛹虫草生长的草铵膦质量浓度有150 μg/mL[19],200 μg/mL[20]和400 μg/mL[21]。基于此,本文分别采用草铵膦质量浓度为0,200,250,300,350,400,450,500,600,700 μg/mL 的PDA 抗性培养基做浓度梯度试验,以确定能完全抑制蛹虫草分生孢子生长的草铵膦浓度。蛹虫草分生孢子的收集方法参照Lou 等[13]的报道,在显微镜下观察是否收集到分生孢子,将该分生孢子涂布在含有不同草铵膦质量浓度的PDA 培养基上,25 ℃避光静止培养10 d,观察并记录草铵膦对蛹虫草的抑制效果。
1.4.2 质粒的抽提 采用质粒抽提试剂盒抽提质粒pCAMBIA3301、pAg1-H3 和pAg-Bar,抽提方法参照试剂盒说明书。采用ddH2O (Double distilled water)洗脱质粒。
1.4.3 元件的扩增和Bar基因表达盒的构建 双元载体pAg1-H3 含有潮霉素抗性基因(hyg)。前期试验表明潮霉素不能完全抑制蛹虫草CM10 的生长,因此本文采用Bar基因替换载体pAg1-H3中的hyg基因。由于hyg基因两端均无单一的酶切位点,而hyg基因表达盒的两端均有合适的单一酶切位点(Hind III 和EcoR I),因此本试验采用Bar基因表达盒替换载体pAg1-H3 中hyg基因表达盒。
以源于构巢曲霉的PtrpC启动子和TtrpC终止子作为Bar基因的启动子和终止子,采用DJPCR 方法[22]融合启动子PtrpC、Bar基因和终止子TtrpC,融合产物即Bar基因表达盒 (PtrpC-Bar-TtrpC),融合流程见图1和图2,所使用的引物见表1。

表1 本试验用引物Table 1 Primers used in this study
以质粒pAg1-H3 作为DNA 模板,采用引物F1/R1、F3/R3 分别扩增PtrpC启动子和TtrpC终止子。以质粒pCAMBIA3301 作为DNA 模板,用引物F2/R2 扩增Bar基因。采用DNA 纯化试剂盒对PCR 产物进行纯化回收。以纯化回收的元件PtrpC、Bar、TtrpC作为DNA 模板(3 种元件的物质的量比为1∶1∶1),以F1 和R3 为引物,采用DJ-PCR融合Bar基因表达盒,最后对融合片段进行纯化回收。元件扩增和融合采用PrimeSTAR Max DNA聚合酶,PCR 反应体系和反应条件参照其说明书。
1.4.4 线性载体的制备 采用T4 DNA 连接酶法和同源重组法均需对载体进行线性化处理,因PCR 方法制备线性载体易出现碱基突变,故采用限制性内切酶酶切法制备线性载体。首先用限制性内切酶HindIII 和EcoR I 对质粒pAg1-H3 进行双酶切,然后采用DNA 纯化试剂盒对酶切产物进行纯化回收,即得长度为3 801 bp 的线性载体pAg1-H3(图1和图2)。双酶切体系和反应条件参照限制性内切酶的说明书,仅把酶切时间调整为30 min,以保证酶切完全。
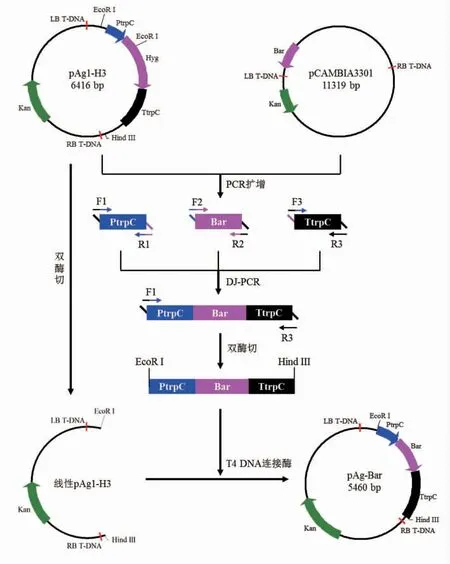
图1 T4 DNA 连接酶法构建双元载体pAg-BarFig.1 Construction of binary vector pAg-Bar by T4 DNA ligase method
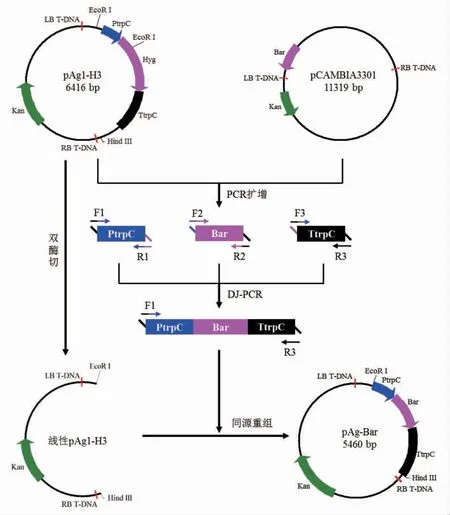
图2 同源重组法构建双元载体pAg-BarFig.2 Construction of binary vector pAg-Bar by homologous recombination method
1.4.5 双元载体pAg-Bar 的构建 T4 DNA 连接酶法构建双元载体pAg-Bar 的方法见图1。首先对融合的Bar基因表达盒进行双酶切,用DNA 纯化试剂盒对酶切产物进行纯化回收,获得两端为Hind III 和EcoR I 黏性末端的Bar基因表达盒,然后采用T4 DNA 连接酶将带有黏性末端的Bar基因表达盒与线性载体pAg1-H3 进行连接,连接体系和反应条件参照T4 DNA 连接酶说明书。该说明书提供的连接时间为10 min,而预试验结果表明,该条件下未获得转化子。将连接时间延至2 h 时才出现目标转化子。将本试验的T4 DNA连接酶反应时间延长至2 h。
同源重组法构建双元载体pAg-Bar 见图2。在1.4.3 节,构建的Bar基因表达盒两侧序列分别与线性载体pAg1-H3 的两侧序列同源,两端的同源序列长度均为18 bp。采用无缝克隆试剂盒对线性载体pAg1-H3 和插入片段Bar基因表达盒进行重组,重组体系和反应条件参照无缝克隆试剂盒说明书。
上述两种方法所得连接体系和重组体系分别转化大肠杆菌DH5α 感受态细胞,并涂布在含50 μg/mL 卡那霉素的LB 培养基上,于37℃倒置过夜培养。随机挑取抗性转化子进行PCR 分析和测序鉴定。
1.4.6Bar基因在蛹虫草中的功能验证 为验证本试验构建载体(pAg-Bar)的有效性和Bar基因在蛹虫草中的功能,首先把载体pAg-Bar 转化入农杆菌AGL1 的感受态细胞,获得菌株AGL1-pAg-Bar,然后参照Zheng 等[18]报道的ATMT 法对蛹虫草分生孢子和农杆菌菌株AGL1-pAg-Bar 进行共培养,以实现Bar基因表达盒整合入蛹虫草基因组。挑取共培养平板上的抗性转化子,接种至含400 μg/mL 草铵膦的PDA 抗性培养基上,进行抗性筛选。对具有草铵膦抗性的蛹虫草转化子进行基因组提取,以提取的基因组为DNA 模板,采用引物F4/R4 和KOD FX DNA 聚合酶扩增转化子中Bar基因表达盒的836 bp 片段,对PCR 产物进行测序,以鉴定Bar基因是否整合入蛹虫草基因组。
2 结果与分析
2.1 草铵膦对蛹虫草分生孢子生长的抑制作用
收集的蛹虫草分生孢子见图3。蛹虫草分生孢子呈圆形或椭圆形,这与Zheng 等[23]的研究结果一致。
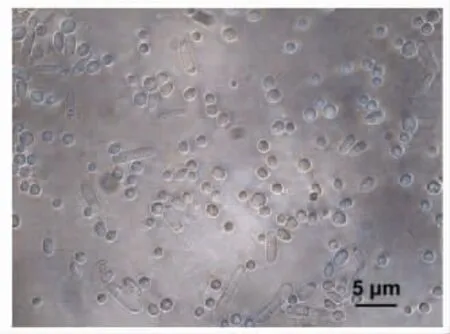
图3 蛹虫草分生孢子Fig.3 Conidia of C.militaris
不同浓度的草铵膦对蛹虫草分生孢子生长的抑制效果见图4。在不含草铵膦的PDA 培养基上,蛹虫草分生孢子生长最快,菌落最大,而随着PDA抗性培养基中草铵膦浓度的增加,蛹虫草分生孢子的菌落越来越小,在草铵膦质量浓度400 μg/mL时,蛹虫草分生孢子的生长被完全抑制,这与Wang 等[21]采用的草铵膦浓度一致。Xiong 等[19]和茅文俊等[20]在蛹虫草转化子筛选试验中所用草铵膦质量浓度分别为150 μg/mL 和200 μg/mL,与本研究结果不一致,这可能是因菌株差异,不同蛹虫草菌株对草铵膦的敏感程度不同所致。针对蛹虫草菌株CM10,宜采用400 μg/mL 草铵膦进行转化子的筛选。

图4 草铵膦对蛹虫草分生孢子生长的抑制Fig.4 Inhibition of glufosinate ammonium on the growth of C.militaris conidia
2.2 Bar 基因表达盒的构建
抽提的质粒pAg1-H3 和pCAMBIA3301 分别见图5的泳道1 和泳道2。以质粒pAg1-H3 为DNA 模板扩增的启动子PtrpC(402 bp)和终止子TtrpC(770 bp),分别见图5的泳道3 和泳道5,条带清晰,启动子PtrpC的长度在300~500 bp 之间,终止子TtrpC的长度在500~800 bp 之间。以质粒pCAMBIA3301 为DNA 模板扩增的Bar基因(582 bp),见图5的泳道4,条带清晰,长度在500~700 bp 之间。采用DJ-PCR 方法融合启动子PtrpC、Bar基因、终止子TtrpC 3 个元件,融合片段(1 694 bp)见图5的泳道6,条带明亮且清晰,长度在1 200~2 000 bp 之间,符合预期长度。经测序鉴定,Bar基因表达盒融合成功,融合片段的5' 端有18 bp 序列,与载体pAg1-H3 的EcoR I 位点序列同源;融合片段的3' 端有18 bp 序列,与载体pAg1-H3 的Hind III 位点序列同源。
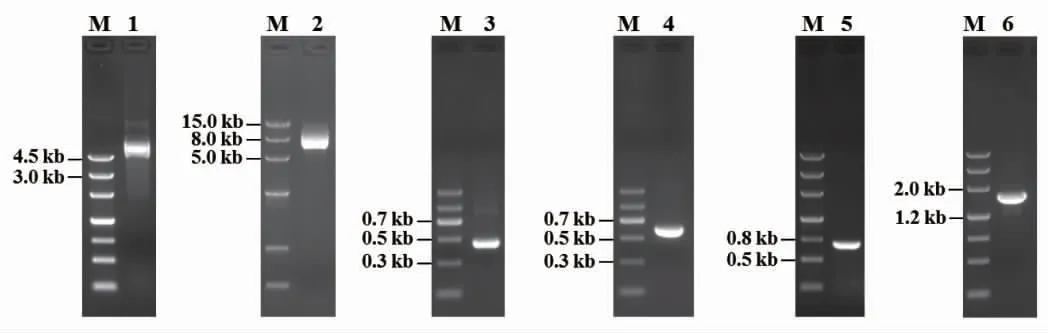
图5 Bar 基因表达盒的构建Fig.5 Construction of bar gene expression cassette
2.3 双元载体pAg-Bar 的构建
限制性内切酶Hind III 和EcoR I 对质粒pAg1-H3 的双酶切效果见图6的泳道1 和泳道2。双酶切效果明显,酶切后出现3 个条带,拟回收的线性载体pAg1-H3 长度3 800 bp。纯化回收线性载体pAg1-H3,结果见图6的泳道3,条带清晰明亮,符合预期长度,其两端分别为限制性内切酶Hind III 和EcoR I 的黏性末端。
采用限制性内切酶Hind III 和EcoR I 对融合片段PtrpC-Bar-TtrpC 进行双酶切,回收的酶切产物(1 668 bp)见图6的泳道4,条带清晰明亮,该(插入)片段与线性载体pAg1-H3 进行T4 DNA连接酶连接,连接产物转化大肠杆菌DH5α。转化子经PCR 分析和测序、鉴定,成功构建双元载体pAg-Bar。抽提该质粒,结果见图6的泳道5。
在重组酶的作用下,DJ-PCR 融合的Bar基因表达盒与线性载体pAg1-H3 直接进行同源重组,重组产物转化大肠杆菌DH5α。转化子经PCR 分析和测序、鉴定,成功构建双元载体pAg-Bar。抽提该质粒,结果见图6的泳道6。

图6 双元载体pAg-Bar 的构建Fig.6 Construction of binary vector pAg-Bar
以上结果表明,T4 DNA 连接酶法和同源重组法均可成功构建双元载体pAg-Bar。T4 DNA 连接酶法较同源重组法多了一步(插入片段的)双酶切,酶切时间30 min,酶切产物仍需纯化,纯化时间1 h,表明T4 DNA 连接酶法更繁琐、耗时。在线性载体与插入片段连接时,T4 DNA 连接酶法需2 h,而同源重组法仅需30 min,即同源重组法更省时。此外,T4 DNA 连接酶的连接产物转化大肠杆菌DH5α 后,在LB 抗性培养基(含50 μg/mL卡那霉素)上出现的菌落较少(图7a),而重组酶的重组产物转化大肠杆菌DH5α 后,在LB 抗性培养基上出现的菌落较多(图7b),表明同源重组法更高效。综上,在构建载体时,同源重组法较T4 DNA 连接酶法更快速、更高效。
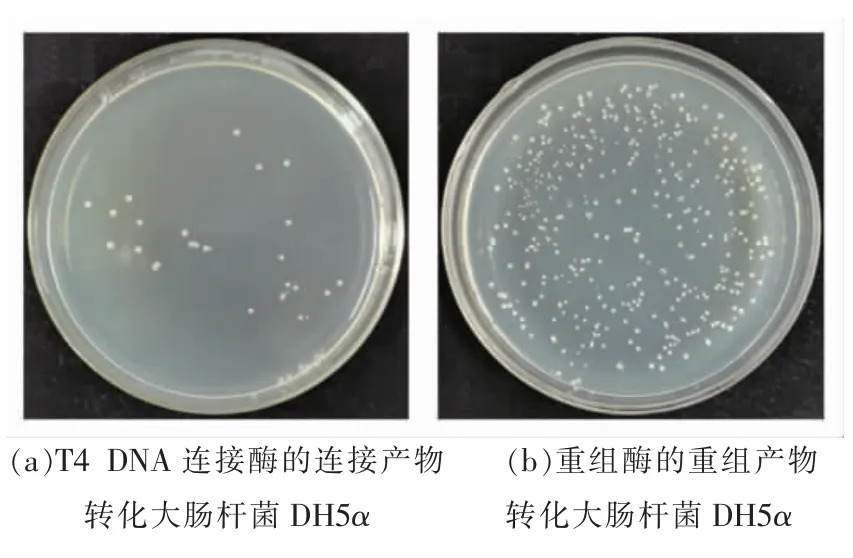
图7 大肠杆菌DH5α 的转化Fig.7 Transformation of Escherichia coli DH5α
2.4 Bar 基因在蛹虫草中的功能验证
农杆菌菌株AGL1-pAg-Bar 与蛹虫草分生孢子的共培养结果见图8a。在含有400 μg/mL 草铵膦的PDA 抗性培养基上出现许多白色的蛹虫草抗性菌落。挑取蛹虫草抗性菌落进行草铵膦抗性筛选,结果见图8b。左侧的蛹虫草转化子在PDA抗性培养基上生长良好,能够抵抗400 μg/mL 草铵膦的抑制,而右侧的野生型蛹虫草CM10 被完全抑制,这表明获得的蛹虫草转化子具有草铵膦抗性。随机选取3 株具有草铵膦抗性的蛹虫草转化子,对其基因组进行PCR 扩增,检测Bar基因是否整合入蛹虫草基因组,结果见图8c。3 株转化子均有清晰的条带,长度在800 bp 左右,符合预期长度。经测序鉴定,Bar基因被成功整合入蛹虫草基因组,这表明本研究构建的双元载体pAg-Bar 能有效应用于蛹虫草,且Bar基因能作为蛹虫草的选择标记基因。

图8 Bar 基因在蛹虫草中的功能验证Fig.8 Functional verification of bar gene in C.militaris
3 结论
蛹虫草分生孢子呈圆形或椭圆形,400 μg/mL草铵膦能够完全抑制蛹虫草分生孢子的生长。通过DJ-PCR 方法融合启动子PtrpC、Bar基因和终止子TtrpC,成功获得Bar基因表达盒PtrpC-Bar-TtrpC。T4 DNA 连接酶法和同源重组法均能有效构建双元载体pAg-Bar,而同源重组法更简便、快速和高效。通过农杆菌介导转化蛹虫草分生孢子,成功把双元载体pAg-Bar 中的Bar基因整合入蛹虫草基因组,并获得具有草铵膦抗性的蛹虫草转化子。本研究不仅提供了一种快速构建载体的方法,而且确定了双元载体pAg-Bar 能够用于蛹虫草的遗传转化,进一步明确了Bar基因适合作为蛹虫草的选择标记基因,这对促进蛹虫草中关键基因的功能鉴定和活性物质代谢途径的解析,具有重要的理论意义和应用价值。

