异氰酸苯酯诱导的类胶原多肽自组装
王苗,郑虹宁,许菲
江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡 214122
1 引言
目前,分子自组装是制造多功能纳米器件最有效的方法之一1。然而,如何进行合理设计,使合成材料能够自组装形成超分子聚集体是分子自组装面临的挑战。体内的生物大分子通常是在纳米尺度范围内运作,创造出复杂的超分子机制,进行与细胞代谢、通讯以及分化相关的化学、电学以及机械功能2。而这些复杂的生物机器的产生基础是生物大分子在分子水平上编程形成特殊自组装结构。因此,学习和利用生物系统中自然存在的结构原理,基于序列间的关系在体外设计和构建多种仿生纳米材料是人类理解天然自组装机制的基础。
在分子尺度上操控生物大分子是纳米制造的重要手段。在体外,如核酸3,多肽4-8以及蛋白9等天然生物大分子已经用于复杂生物材料的开发。相比于复杂精巧的核酸自组装设计,多肽分子间作用力种类繁多,增加了其自组装设计的难度。胶原蛋白是动物体内含量最高的蛋白质,也是生物医用材料领域最常用的天然高分子之一。目前,在生物体内发现共有29种类型的胶原蛋白,不同类型的胶原蛋白的拓扑结构从纳米纤维束到网络结构等不尽相同10,11。其中II型胶原和III型胶原在体内主要以胶原纤维束的形式存在。胶原蛋白由三条肽链扭转形成三股螺旋的二级结构,其中每一条肽链均由氨基酸三重子Gly-Xaa-Yaa的重复序列组成,Xaa通常为Pro (脯胺酸),Yaa通常为Hyp((2S,4R)-4-羟脯氨酸)。目前天然胶原蛋白被广泛应用于生物医用材料,但是该类材料具有高致敏性、易被动物源所带有的疾病如朊蛋白污染等生物风险。化学合成的类胶原多肽来源清洁、可编程性高,是理想的纳米生物基底材料。
目前,基于对同源胶原多肽设计组装已有一些报道。该设计以高脯氨酸序列,(POG)n或(PPG)n为主体,插入如Cys、Asp、Lys、Phe、His等带有特定功能基团的氨基酸,依靠半胱氨酸之间二硫键12,静电引力13,14,π–π堆叠15,16,金属配位诱导17–20等,使其自发或可控触发自组装形成结构特异的组装体,从而进一步形成结构复杂多变的生物纳米材料。非脯氨酸氨基酸的引入会导致胶原三股螺旋热稳定性下降,限制了其作为纳米材料的应用范围。为了提高胶原三股螺旋稳定性,可以在胶原序列中插入非天然氨基酸。比如,在类胶原多肽中嵌插Gly-Nleu-Pro、Gly-Pro-Nleu以及Gly-Pro-FPro三重子可以有效提高类胶原多肽三股螺旋稳定性(Nleu:N-异丁基甘氨酸;FPro:反式-4-氟脯氨酸)21,22。
类比上述基于单一非共价作用设计的类胶原多肽材料的自组装,Luo和Tong23利用在类胶原多肽N端设计β-片层和长链烷烃,利用β-片层形成氢键作用力和长链烷烃疏水作用力协同诱发类胶原多肽的组装形成了胶原蛋白水凝胶。由于其在类胶原多肽N端修饰的分子结构较大,化学合成过程复杂。本文采用简单有机小分子修饰类胶原多肽末端促进类胶原多肽自组装。首先,选取自身不易形成胶原蛋白三股螺旋结构的多肽(POG)6为目标序列24,以此来探索有机小分子修饰对类胶原多肽折叠与自组装的影响。4,4’-亚甲基双(异氰酸苯酯)分子已被成功的用于设计组装二维(2D)有机纳米材料25。因此,我们试图将4,4’-亚甲基双(异氰酸苯酯)分子设计在类胶原多肽(POG)6以及(POG)8的末端,以弱相互作用力协同方式提高类胶原多肽三股螺旋的热稳定性并诱发三股螺旋分子间的高聚自组装。实验过程分别利用质谱和液相色谱对修饰的类胶原杂合肽进行验证。利用圆二色谱对类胶原杂合肽的折叠进行表征。随后,利用纳米粒度仪表征可溶性组装体的粒径分布。最后,利用透射电镜和原子力显微镜表征了类胶原杂合肽高聚自组装的形貌,并进一步推测了其组装机理。
2 实验部分
2.1 实验材料
Fmoc-Gly-Wang树脂,Fmoc-Gly-OH,Fmoc-Pro-OH和Fmoc-Hyp-OH,O-苯并三氮唑-四甲基脲六氟磷酸酯(HBTU),N,N-二异丙基乙胺(DIEA),N,N-二甲基甲酰胺(DMF)(纯度≥ 99.5%),乙腈(ACN)(纯度≥ 99.8%),二氯甲烷(CH2Cl2)(纯度≥99.5%),甲醇(CH3OH)(纯度≥ 99.8%),二甲基亚砜(DMSO)(纯度≥ 99.0%),三氟乙酸(TFA)(阿拉丁,纯度≥ 99.5%),1,5-萘二异氰酸酯(阿拉丁,纯度≥ 98.0%),4,4’-亚甲基双(异氰酸苯酯)(安耐吉化学,纯度≥ 97.0%),三异丙基硅烷(TIS)(纯度99.0%),哌啶(纯度≥ 99.0%)。
2.2 实验方法
2.2.1 类胶原多肽的合成
采用多肽固相合成法26–29,具体步骤如下:(1)溶胀树脂:合成0.1 mmol多肽,取0.3 g Fmoc-Gly-Wang树脂溶于6 mL DMF溶胀6 h后除去DMF。(2)脱Fmoc保护:用4 mL 20%哌啶/80% DMF(体积比)溶液室温下搅拌15 min,脱保护2次。脱保护后都使用DMF、CH2Cl2各洗涤3次。(3)氨基酸缩合:加入含0.5 mmol Hyp,0.5 mmol HBtu和1 mmol DIEA的DMF 6 mL室温下搅拌2–3 h,抽干洗涤3次。(4)茚三酮检测:若树脂呈蓝色则重复步骤(3),若树脂透明则反应完全连接下一个氨基酸,直到连上最后一个氨基酸后脱保护2次。分别用DMF、CH2Cl2和CH3OH洗涤3次。(5)切割多肽:将合成的(POG)6和(POG)8取少量,与95% TFA/2.5% TIS/2.5%水(体积比)切割液5 mL混匀后加入圆底烧瓶,用带孔橡胶塞塞住瓶口,置于磁力搅拌器上裂解1–2 h。脱脂棉过滤除去树脂颗粒,加入冷乙醚沉淀,离心三次弃上清。将得到的沉淀物加水溶解,冻干得到样品粉末。
2.2.2 类胶原杂合肽的合成
在确定原料肽合成正确的基础上,采用化学合成法合成类胶原多肽杂合分子25,30。将连在Wang树脂上的(POG)6与有机分子以4 : 3的摩尔比在DMSO (6–7 mL)中进行化学合成反应。将连在Wang树脂(POG)8与有机分子以4 : 3的摩尔比在DMF (6–7 mL)和DIEA (与多肽等摩尔量)反应,室温搅拌24–48 h。反应后分别用DMF、CH2Cl2、甲醇各洗涤3次抽干。将反应完成后的杂合肽树脂用切割液裂解1–2 h。冷乙醚沉淀后冻干得到样品粉末。类胶原多肽杂合分子合成路线如图1所示。
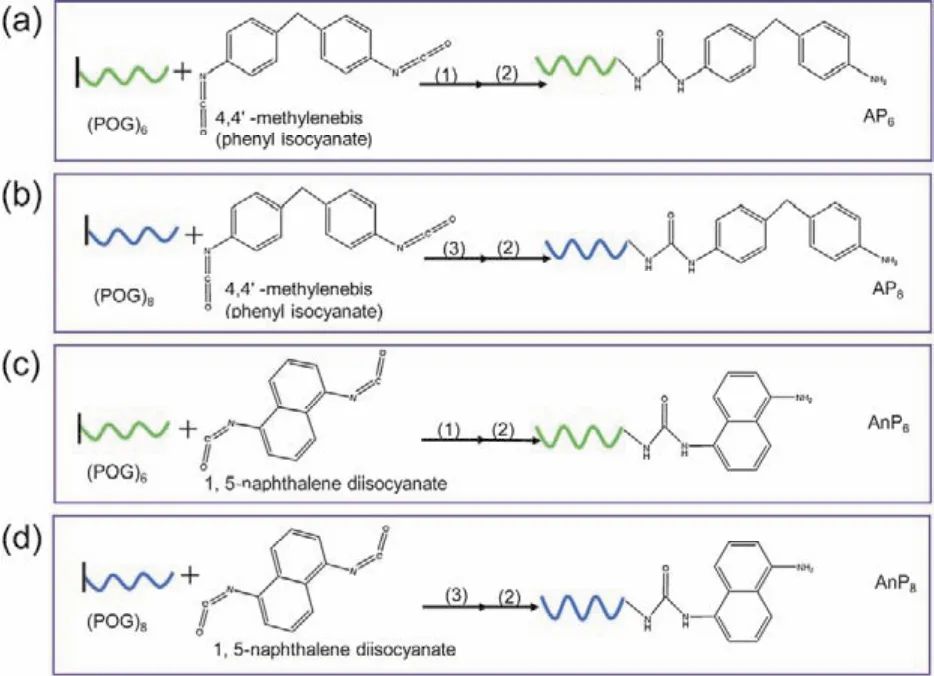
图1 类胶原杂合分子合成路线图Fig. 1 Synthesis scheme of collagen-like hybrid peptides.
2.2.3 反相高效液相色谱
采用高效液相色谱(RP-HPLC)半制备(Waters 1525;Eclipse XDB-C18 9.4 mm × 250 mm × 5 μm)对粗肽进行制备。将制备得到的肽通过分析型反相高效液相色谱(1260;EC-C18,2.1 mm × 100 mm ×2.7 μm)进行纯度检验。流动相A液:1 L超纯水中加入1 mL三氟乙酸(TFA)。流动相B液:1 L乙腈(ACN)中加入1 mL三氟乙酸(TFA)。紫外检测220 nm处吸收峰。柱温控制在50 °C。
2.2.4 基质辅助激光解吸电离飞行时间质谱
采用质谱仪MALDI-TOF-MS (ultrafleXtreme)(布鲁克,美国)对样品进行分子量鉴定。取少量粉末样品加水溶解,基质为无Na的DHB (2,5-二羟基苯甲酸)溶液。1 μL样品点在靶板上,待样品晾干后再点1μL基质。基质干燥结晶后即可进靶。开始之前先使用多肽标准品进行校准。所用模式为RP700-3500。
2.2.5 样品处理
将从高效液相色谱半制备纯化得到纯度较高的样品冻干后使用超纯水溶解,然后转移到Float-A-LyzerG2透析管(允许透过分子量1000 g∙mol−1)中,使用超纯水透析24 h除盐。透析后的样品冻干后置于−20 °C保存。
2.2.6 圆二色谱(CD)
采用圆二色谱仪Chirascan (应用光物理,英国)对合成纯化后的多肽进行二级结构表征。将样品溶解在10 mmol∙L−1的磷酸盐(PB)缓冲液(pH =7)中,配制成终浓度为0.2 mmol∙L−1的体系,置于4 °C孵育24 h。使用光学匹配的1 mm的石英比色皿在CD控温4 °C下进行扫描。波长范围为190–280 nm,间隔为1 nm,扫描速度2 snm−1得到全波长曲线。通过对225 nm处进行监测,从4到80 °C,平衡时间为6 min,每步1 °C记录一次数据,每次每个样品扫描时间为5 s,得到胶原热变图。拟合热变曲线,将溶液在4和80 °C所对应的吸光值取平均值,平均吸光值所对应的温度即为熔融温度(Tm),该数据表征胶原的热稳定性。
2.2.7 动态光散射(DLS)
采用纳米粒度仪Zetasizer Nano ZS测量样品的水力学半径。将样品溶解在10 mmol∙L−1PB (pH =7)缓冲液中,配置成终浓度为0.2 mmol∙L−1的体系。样品退火至4 °C,然后在4 °C孵育24 h。使用光学匹配的石英比色皿ZEN2112,在DLS控温25 °C下进行测量,平行3次取平均值。
2.2.8 原子力显微镜(AFM)
采用原子力显微镜Multimode-8 (布鲁克,美国)进行样品自组装后的形貌表征。将样品溶解在10 mmol∙L−1PB (pH = 7)缓冲液中,配置成浓度为2 mmol∙L−1的体系。样品退火至4 °C,然后在4 °C孵育9天。AFM制样方法:取5 μL自组装的样品滴到干净平整的云母片上表面,待完全晾干后加200 μL超纯水冲洗云母表面,吹干云母片表面。采用Scanasyst Air模式进行图像扫描,探针为 SNL-10。
2.2.9 透射电镜(TEM)
采用透射电镜HT-7700 (100 KV,日立,日本)对自组装后的样品进行形貌表征。将样品溶解在10 mmol∙L−1PB (pH = 7)缓冲液中,配置成浓度为2 mmol∙L−1的体系。样品退火至4 °C,然后在4 °C孵育9天。TEM制样方法:取5 μL自组装后的样品吸附在亲水处理后的铜网(300目碳支持膜,中镜科仪)上,室温下吸附45 s,滤纸吸走后再水洗,用10 μL 2%醋酸铀染色45 s,待铜网完全干燥后对样品形貌进行透射电镜表征。
3 结果与讨论
3.1 类胶原杂合肽的结构设计
如图2所示,组装分子分别由类胶原多肽、酰胺键、芳香族和氨基四部分组成。在设计的类胶原杂合肽中,芳香基团提供的π–π堆积旨在加强分子之间的作用力;酰胺键间隔用于连接类胶原多肽与芳香族基团以及提供的氢键作用力;氨基提供氢键作用力。本研究中,选取了自身不能形成三股螺旋的类胶原多肽(POG)6序列为胶原部分24。将(POG)6的氮端通过酰胺键与含有苯环的4,4’-亚甲基双(异氰酸苯酯)分子连接得到AP6。研究修饰在末端的4,4’-亚甲基双(异氰酸苯酯)分子是否能够促进(POG)6的折叠以及能否进一步促进高聚组装。近而又选取了自身可形成三股螺旋的(POG)8序列为研究对象,将其N端修饰4,4’-亚甲基双(异氰酸苯酯)得到AP8,研究对已折叠的胶原三股螺旋能否更有效的促进高聚自组装。

图2 分子设计图解以及分子结构图Fig. 2 Illustration and Structure of the molecular design.
与此同时,选取了4,4’-亚甲基双(异氰酸苯酯)分子的类似物1,5-萘二异氰酸酯修饰(POG)6和(POG)8氮端分别得到AnP6和AnP8。虽然4,4’-亚甲基双(异氰酸苯酯)和1,5-萘二异氰酸酯都含有两个芳环,但是1,5-萘二异氰酸酯中萘基团刚性较强,旨在研究有机分子刚性是否会影响类胶原多肽的折叠与组装。文中用到的多肽序列如表1所示。
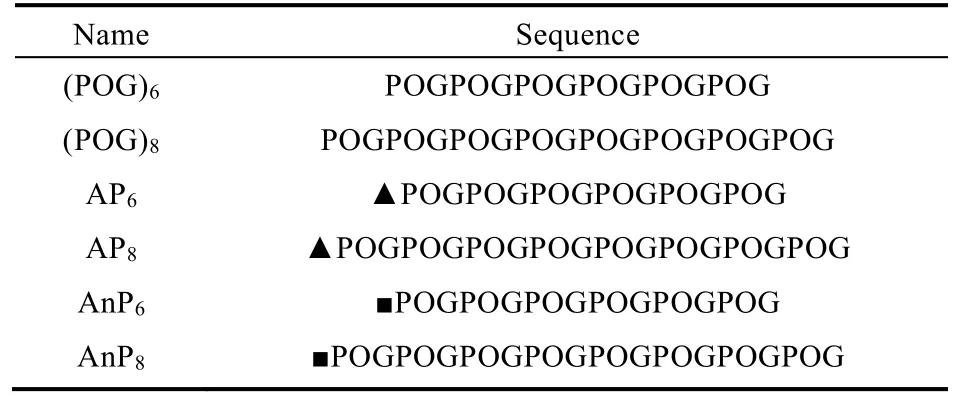
表1 类胶原多肽分子序列Table 1 Molecular Sequence of Collagen-like Peptides.
3.2 类胶原杂合肽的纯度检验和分子质量鉴定
将纯化获得的类胶原杂合肽通过高效液相色谱表征纯度。通过质谱进行分子量鉴定,实验结果与理论相符(图3)。AP6,Mw = 1846.05 g∙mol−1,m/z= 1885.0 g∙mol−1(M + K)+。AP8,Mw = 2380.25 g∙mol−1,m/z= 2419.25 g∙mol−1(M + K)+。AnP6,Mw = 1805.99 g∙mol−1,m/z= 1828.99 g∙mol−1(M +Na)+。AnP8,Mw =2340.19 g∙mol−1,m/z= 2379.19 g∙mol−1(M + K)+。
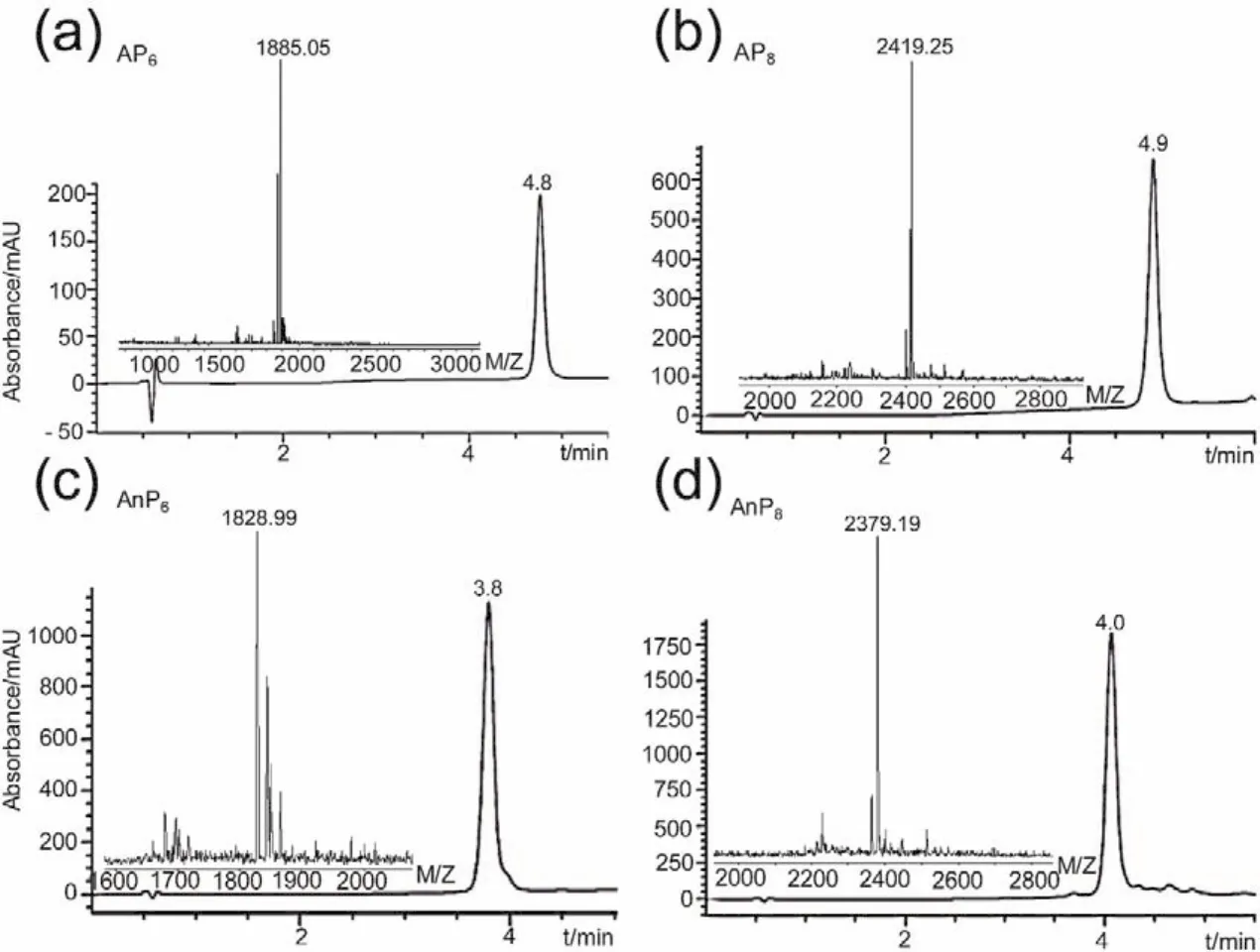
图3 类胶原杂合肽RP-HPLC及MALDI-TOF分析图Fig. 3 RP-HPLC and MALDI-TOF spectra of Collagen-like hybrid Peptides.
3.3 圆二色谱表征三股螺旋的热稳定性
通过圆二色谱(CD)测定AP6、AP8、AnP6和AnP8的全波长吸收和热变曲线,研究4,4’-亚甲基双(异氰酸苯酯)和1,5-萘二异氰酸酯对类胶原多肽折叠的影响。胶原蛋白三股螺旋的特征吸收峰在225 nm附近31,32。如图4a全波长图黑色实线所示,(POG)6三聚体在225 nm处呈现微弱的吸收峰。相应的,图4b的热变实验中没有形成反S曲线,说明没有形成稳三股螺旋结构。AP6三聚体的全波长CD图如图4a中橘黄色实线所示,MRE值大约为4,Tm值约为25.2 °C。这说明4,4’-亚甲基双(异氰酸苯酯)分子能诱导原本不能折叠的(POG)6形成稳定的三股螺旋结构。
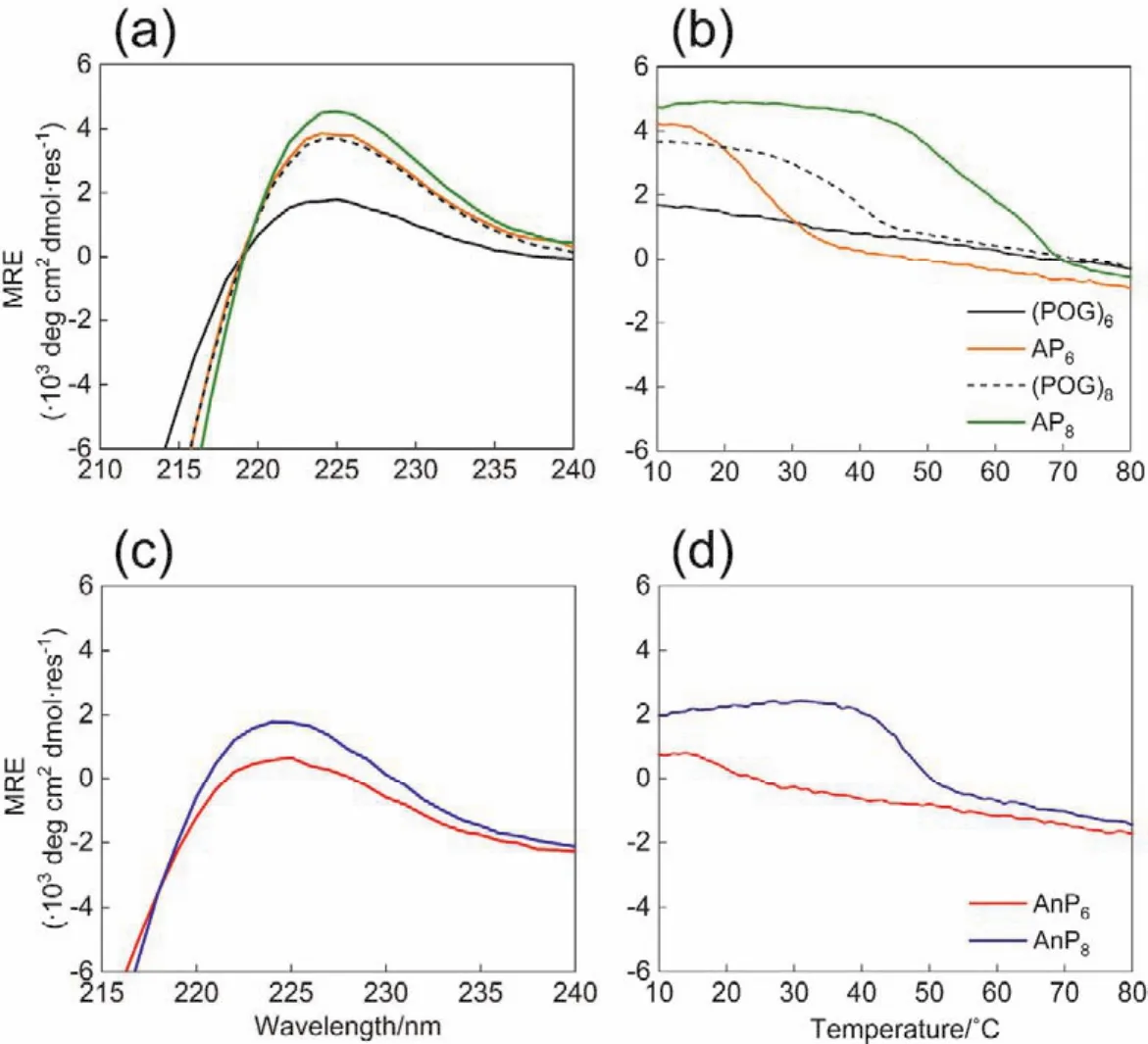
图4 类胶原杂合肽CD全波长与热变光谱图Fig. 4 Full-wavelength scans and thermal unfolding profile of collagen-like hybrid peptidesmonitored by CD.
如图4a,b所示,(POG)8三聚体225 nm处吸收值为3.9,Tm值约为37.7 °C,与已报道的数据相吻合24。与(POG)8三聚体相比,AP8三聚体的MRE值提高了约1个单位,Tm值提高了约21 °C,对于自身可形成三股螺旋结构的(POG)8来说,4,4’-亚甲基双(异氰酸苯酯)显著提高了其三股螺旋结构的热稳定性。
为了验证4,4’-亚甲基双(异氰酸苯酯)分子可高效的促进类胶原多肽的分子内自组装,我们将4,4’-亚甲基双(异氰酸苯酯)分子替换成作用力较弱的1,5-萘二异氰酸酯分子修饰在(POG)6和(POG)8的N端得到AnP6和AnP8。同样,如图4c,d通过圆二色谱测定AnP6、AnP8的全波长吸收和热变曲线,研究1,5-萘二异氰酸酯分子对(POG)6和(POG)8折叠的影响。AnP6的MRE值低,热变曲线不是典型的反S型,说明其没有促进(POG)6形成三股螺旋。AnP8的MRE值低于(POG)8,但是其Tm值略微高于(POG)8,这表明1,5-萘二异氰酸酯分子在一定程度上可以促进(POG)8的折叠。
3.4 动态光散射表征可溶性自组装体的粒径分布
利用动态光散射(DLS)对各样品中可溶性的自组装体的粒径和粒径分布进行检测。如图5a所示,(POG)6粒径大小在分布在1 nm左右,(POG)8粒径大小分布在3 nm左右,这与CD结果(POG)6没有形成三股螺旋结构,而(POG)8形成了三股螺旋结构一致33,34。AP6和AP8的粒径大小约7–8 nm (图5a),AnP6和AnP8粒径大小约3–4 nm (图5b)。结果表明,AP6和AP8与(POG)6和(POG)8相比能够形成粒径较大纳米结构,而AnP6和AnP8粒径大小与(POG)6和(POG)8无较大变化。

图5 类胶原杂合肽粒径分布图Fig. 5 Size distributions of collagen-like hybrid peptides.
3.5 电子显微镜表征自组装形貌
通过原子力显微镜(AFM)和透射电镜(TEM)进一步表征了类胶原杂合肽三股螺旋分子间的高聚自组装形貌。经AFM表征,AP6形成了宽度约12 nm、高度约为2 nm的纤维结构(图6a,b),相应的,TEM表征也显示了类似的纳米纤维结构(图6e)。同样,AP8形成了宽度约16 nm、高度约为5 nm的纤维结构(图6c,d,f)。在相同组装条件下,AnP6和AnP8则没有形成任何纳米结构,如图7a,b AFM图所示。

图6 类胶原杂合肽AP6和AP8自组装图Fig. 6 Collagen-like hybrid peptides self-assembly of AP6 and AP8.

图7 类胶原杂合肽AnP6和AnP8的AFM表征图Fig. 7 AFM images ofcollagen-like hybrid peptides.
3.6 自组装机理
本研究通过对原料肽(POG)6和(POG)8进行N端修饰有机小分子4,4’-亚甲基双(异氰酸苯酯)得到杂合肽AP6和AP8,其形成了高稳定性的胶原三股螺旋结构,并进一步高聚自组装形成纳米纤维结构。与4,4’-亚甲基双(异氰酸苯酯)相比较,刚性更强的类似物4,4’-亚甲基双(异氰酸苯酯)修饰多肽N端得到的杂合肽AnP6和AnP8则没有形成高聚自组装。我们通过PyMOL软件得到如下分子结构模型来对胶原纤维的形成机理进行研究。AP6三股螺旋的理论长度约6.6 nm。实验测得AP6形成的纳米纤维宽度约12 nm。AP8的三股螺旋理论长度约为8.4 nm。实验测得AP8形成的纳米纤维宽度约16 nm。如图8所示,AP6和AP8纳米纤维宽度均为未进行N端修饰的多肽长度的两倍,这说明可能氮端的4,4’-亚甲基双(异氰酸苯酯)分子通过多重若作用力诱导胶原三股螺旋结构进行N端对N端的排列,从而进一步形成纳米纤维结构。

图8 类胶原杂合肽组装机理Fig. 8 Assembly mechanism of collagen-like hybrid peptide.
4 结论
在过去二十年,基于溶液自组装,依据自下而上设计原则制备出了多种维度纳米材料。胶原蛋白在体内呈现多种形态分布,但是纤维状结构形式占据了90%。然而,高聚脯氨酸带来了胶原蛋白结构稳定性的同时也带来了不易功能化的缺点。近年来,研究者通过在(POG)n序列引入功能侧链氨基酸实现类胶原多肽高聚。比如可在其中部嵌插Cys,利用Cys分子之间形成二硫键组装得到纤维结构12;在(POG)n末端设计含有芳环或者氟代芳环的氨基酸组装形成纤维结构15,16;在(POG)n或者(PPG)n末端的设计与金属配位的氨基酸,组装得到纤维结构17–20等。虽然以上设计均可形成高聚的胶原纳米材料,但是纤维形貌难以预测与控制。
在本工作中,我们首次展示了有机小分子促进的类胶原多肽分级组装形成结构规整的纳米纤维可能性。设计含有4,4’-亚甲基双(异氰酸苯酯)修饰类胶原多肽,利用末端的有机小分子之间形成非共价作用力协同促进类胶原多肽自组装。对于不能形成三股螺旋结构(POG)6序列,进行异氰酸苯酯修饰后的AP6序列,形成了三股螺旋结构。对于能形成三股螺旋结构(POG)8序列,进行异氰酸苯酯修饰后的AP8序列,MRE值从3.9提高到了4.9,Tm值提高了21 °C。说明末端修饰异氰酸苯脂分子可以提高三股螺旋的稳定性。由于临近胶原三股螺旋同向组装具有较大的空间位阻,使得类胶原杂合肽三股螺旋呈交错形式排列,所形成的的纳米纤维的宽度约为类胶原多肽长度的两倍。同时,值得注意的是,AP6与AP8形成的三股螺旋直径均为1 nm左右,但是,AP8所形成纳米纤维的高度约为AP6的2.5倍,,推测这些纳米纤维可能是有多层的螺旋堆积而成,并且AP8堆积的层数比较多。由于AP8的分子比AP6稍长,可能其组装效率更高,但是我们仍然无法悉知其多层堆积的组装机制。
综上所述,有机小分子异氰酸苯酯修饰的类胶原多肽(POG)6或(POG)8,提高了三股螺旋的稳定性并且促进了类胶原多肽自组装形成纳米纤维,实现了胶原纤维的部分可控组装。该设计结合了超分子化学与肽的自组装,丰富了类胶原多肽材料的设计类型,为开发新型的类胶原多肽纳米材料提供了选择。
- 物理化学学报的其它文章
- PVP封端剂对Pd纳米晶电催化氧化甲醇和乙醇性能的影响
- Photocrosslinking-Immobilized Polymer Vesicles for Lowering Temperature Triggered Drug Release
- Hollow Nitrogen-Rich Carbon Nanoworms with High Activity for Metal-Free Selective Aerobic Oxidation of Benzyl Alcohol
- CdTeSe合金幻数团簇的室温合成和形成机理研究
- 体相界面导通的复合快离子导体
- Defluoridation of Water Using Active Alumina Derived from Single-Layer Boehmite

