迷迭香酸通过AMPK/mTOR通路减轻新生大鼠缺血缺氧性脑损伤研究
赵玉霞,陈莺倩
迷迭香酸通过AMPK/mTOR通路减轻新生大鼠缺血缺氧性脑损伤研究
赵玉霞,陈莺倩
驻马店市中心医院 儿童康复科,河南 驻马店 463000
探讨迷迭香酸对新生大鼠缺血缺氧脑损伤(hypoxic-ischemic encephalopathy,HIE)的影响,及其对单磷酸腺苷活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路的调控作用,初步探讨其脑保护机制。取7 d龄SD新生大鼠,随机分为对照组、模型组、迷迭香酸(300 mg/kg)组、AMPK/mTOR激动剂MT6378(10 mg/kg)组、AMPK抑制剂GSK-690693(30 mg/kg)组和迷迭香酸(300 mg/kg)+MT6378(10 mg/kg)组,每组20只。建立HIE模型,给予相应药物进行干预,采用TTC染色法检测大鼠脑梗死情况;透射电镜(TEM)观察大鼠海马神经元结构损伤及自噬状况;免疫荧光法检测大鼠海马神经元自噬标记物微管相关蛋白1轻链3B(microtubule-associated protein 1 light chain 3B,LC3B)阳性表达;TUNEL法检测大鼠海马神经元凋亡率;免疫组化法检测大鼠海马神经元磷酸化AMPK(p-AMPK)阳性表达;Western blotting检测大鼠海马组织活化的半胱氨酸蛋白酶3(cleaved Caspase-3)、mTOR及其磷酸化蛋白(p-mTOR)、Unc-51样自噬激活激酶1(uncoordinated-51 like autophagy activating kinase 1,Ulk1)及其磷酸化蛋白(p-Ulk1)、LC3B表达。与对照组相比,模型组大鼠脑梗死严重,海马神经元结构损伤及自噬空泡形成较多,细胞自噬及凋亡水平升高,AMPK/mTOR通路活化(<0.05)。与模型组相比,迷迭香酸组及GSK-690693组大鼠脑梗死、海马神经元结构损伤、凋亡及自噬减弱,AMPK/mTOR通路被抑制(<0.05);MT6378组海马组织AMPK/mTOR通路进一步激活,大鼠脑梗死、海马神经元结构损伤、凋亡及自噬进一步加重(<0.05);MT6378可逆转迷迭香酸的上述作用(<0.05)。迷迭香酸可能通过抑制AMPK/mTOR通路激活,降低海马神经元自噬及凋亡进程,发挥抗HIE脑损伤作用。
迷迭香酸;缺血缺氧性脑损伤;AMPK/mTOR通路;新生大鼠;自噬;凋亡
新生儿缺血缺氧性脑损伤(hypoxic-ischemic encephalopathy,HIE)为围产期因窒息缺氧而引起脑神经损伤性疾病[1]。HIE具有较高的致死率及致残率,严重影响新生儿的生命健康[2]。寻找安全有效的药物及治疗方法,来保护HIE并促进HIE神经系统康复,一直是临床研究的重点任务之一。迷迭香酸为酚酸类物质,广泛分布于唇形科、紫草科、葫芦科等多种植物中,为薄荷、丹参、迷迭香、紫苏叶等多种药材中的有效活性成分[3]。研究发现,迷迭香酸能通过抗氧化、抗炎、抗凋亡途径,缓解脑缺血再灌注损伤[4]。但迷迭香酸是否也能在HIE疾病过程中发挥脑保护作用尚未见报道。自噬在缺血缺氧性神经元损伤、凋亡、神经胶质活化等生理活动过程中发挥重要调控作用,并越来越受到HIE研究的重视[5]。单磷酸腺苷活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)可抑制下游调控因子哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)蛋白激活,抑制Unc-51样自噬激活激酶1(uncoordinated-51 like autophagy activating kinase 1,Ulk1)磷酸化,来诱导自噬复合体的形成,并参与自噬调控过程[6],且已有研究证实,AMPK在HIE大鼠脑组织中处于持续激活状态[7-8],提示AMPK/mTOR通路可能在HIE神经元凋亡及自噬过程中发挥重要调控作用。本研究建立HIE大鼠模型,考察迷迭香酸是否能通过AMPK/mTOR介导的自噬途径来缓解HIE脑损伤,以期为迷迭香酸的开发及应用提供实验依据。
1 材料
1.1 动物
清洁级雄性SD大鼠120只,7 d龄,体质量10~12 g,购自福州海王福药制药有限公司,动物许可证号SCXK(闽)2020-0001。动物于驻马店市中心医院动物房常规饲养,动物实验经驻马店市中心医院动物使用伦理委员会批准(批准号IACUC-101093),符合3R原则。
1.2 药品与试剂
迷迭香酸对照品(批号20190312003,质量分数≥98%)购自上海宝曼生物科技有限公司;AMPK抑制剂GSK-690693(批号20190419001)、AMPK/mTOR激动剂MT6378(批号20190329002)购自美国MCE公司;2,3,5-氯化三苯基四氮唑(TTC)染色试剂盒(批号20190321001)购自上海瓦兰生物科技有限公司;TUNEL染色试剂盒(批号20190227004)购自北京伊塔生物科技有限公司;DAPI染色试剂盒(批号20190225006)购自北京百奥莱博科技有限公司;微管相关蛋白1轻链3B(microtubule-associated protein1light chain3,LC3B)抗体、磷酸化AMPK(p-AMPK)抗体、活化的半胱氨酸蛋白酶3(cleaved Caspase-3)抗体、mTOR抗体、磷酸化mTOR(p-mTOR)抗体、β-actin抗体、HRP标记的羊抗兔IgG抗体、FITC标记的羊抗兔IgG抗体(批号分别为20190124001、20190222001、20190303002、20190403002、20190208004、20190302001、20190314005、20190204008)购自美国Abcam公司;Ulk1抗体(批号20190223002)购自武汉博欧特生物科技有限公司;磷酸化Ulk1(p-Ulk1)抗体(批号20190131001)购自上海邦景实业有限公司。
1.3 仪器
Q250型透射电镜(TEM,美国Thermo Fisher Scientific公司);LF200型荧光显微镜(广州莱特光电技术有限公司);JS-1070P型化学发光成像仪(上海向帆仪器有限公司);Hettich MIKRO220型离心机(德国Hettich公司);PowerPac HV Power Supply高电压电泳仪(美国Bio-Rad公司)。
2 方法
2.1 大鼠HIE模型的建立、分组与给药
新生SD大鼠麻醉,手术暴露左侧颈主动脉并结扎缝合伤口后,放回原饲养环境,恢复3 h,置于常压缺氧舱内(温度37 ℃、湿度45%~55%、8%氧气-92%氮气)缺氧处理2.5 h,若大鼠出现左旋即为造模成功[9],共造模成功100只,随机分为模型组、迷迭香酸(300 mg/kg)[10]组、AMPK/mTOR激动剂MT6378(10 mg/kg)组、AMPK抑制剂GSK-690693(30 mg/kg)[11-12]组和迷迭香酸(300 mg/kg)+MT6378(10 mg/kg)组,每组20只;另取20只大鼠,相同方法暴露左侧颈主动脉,但不结扎,常规饲养后作为对照组。于造模成功后,各给药组ig迷迭香酸(10 mL/kg),尾iv MT6378或GSK-690693(10 mL/kg);对照组及模型组ig等体积0.9%氯化钠溶液,1次/d,连续3d。
2.2 TTC法检测大鼠脑梗死面积
给药结束后,各组随机取6只大鼠,断头处死,取左脑,用切片机由前往后切成厚度为5 μm的组织切片。取切片,于2% TTC溶液中室温孵育35 min,PBS溶液洗涤、10%中性甲醛固定后,用数码相机采集图片,梗死部分为白色,正常为红色,用Image J软件分析并计算梗死面积百分比。
梗死面积百分比=梗死部分面积/总面积
2.3 TEM观察大鼠海马神经元超微结构
给药结束后,各组随机取6只大鼠,断头取左脑,于冰上用解剖镜迅速剥离取完整海马组织,剪下组织块(0.3 cm×0.3 cm),于2.5%戊二醛及1%锇酸溶液中固定后,送于电镜室镜检。剩余组织迅速置于4%多聚甲醛中固定24 h,常规透明、浸蜡、包埋后切成5 μm切片,备用。
2.4 免疫荧光法检测大鼠海马神经元自噬标记物表达情况
取“2.3”项下海马组织石蜡切片,脱蜡、水化、曲拉通透化后,加入LC3B抗体(1∶400),4 ℃孵育过夜;避光加入FITC标记的羊抗兔IgG抗体(1∶200),DAPI染核、甘油封片后,于荧光显微镜下观察并拍照,用Image Pro Plus 5.0软件分析。
2.5 TUNEL法检测大鼠海马神经元凋亡
取“2.3”项下海马组织石蜡切片,按TUNEL染色液说明书方法染色、封片后,于显微镜下观察并拍照,凋亡细胞被染成棕黄色,用Image-pro plus软件检测凋亡细胞数目,计算细胞凋亡率。
细胞凋亡率=凋亡细胞数/细胞总数
2.6 免疫组化法检测大鼠海马组织p-AMPK表达
取“2.3”项下海马组织石蜡切片,复温、透化及抗原修复后,加入p-AMPK抗体(1∶500),4 ℃孵育过夜,加入HRP标记的羊抗兔抗体(1∶500),室温孵育1 h,DAB显色、苏木精复染封片后,于显微镜下观察并拍照,采用Image Pro Plus 5.0软件分析。
2.7 Western blotting法检测海马组织cleaved Caspase-3、LC3B、mTOR、p-mTOR、Ulk1、p-Ulk1蛋白表达
取剩余大鼠,断头处死,于冰上解剖取左半球海马组织,加入裂解液,于冰上匀浆后提取蛋白,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,封闭后分别加入cleaved Caspase-3、LC3B、mTOR、p-mTOR、Ulk1、p-Ulk1抗体(1∶800)以及β-actin抗体(1∶1000),4 ℃孵育过夜,加入HRP标记的羊抗兔IgG抗体(1∶1000),室温孵育2.5 h,加入化学发光试剂显色,采用化学发光成像仪曝光条带并拍照,Image J软件分析。
2.8 统计学分析
3 结果
3.1 迷迭香酸对HIE大鼠脑梗死面积的影响
如图1和表1所示,与对照组相比,模型组大鼠脑梗死面积显著增加(<0.05);与模型组相比,迷迭香酸组及GSK-690693组大鼠脑梗死面积显著减少(<0.05),MT6378组脑梗死面积进一步增加(<0.05);与迷迭香酸组相比,迷迭香酸+MT6378组脑梗死面积显著增加(<0.05),GSK-690693组脑梗死面积差异无统计学意义。
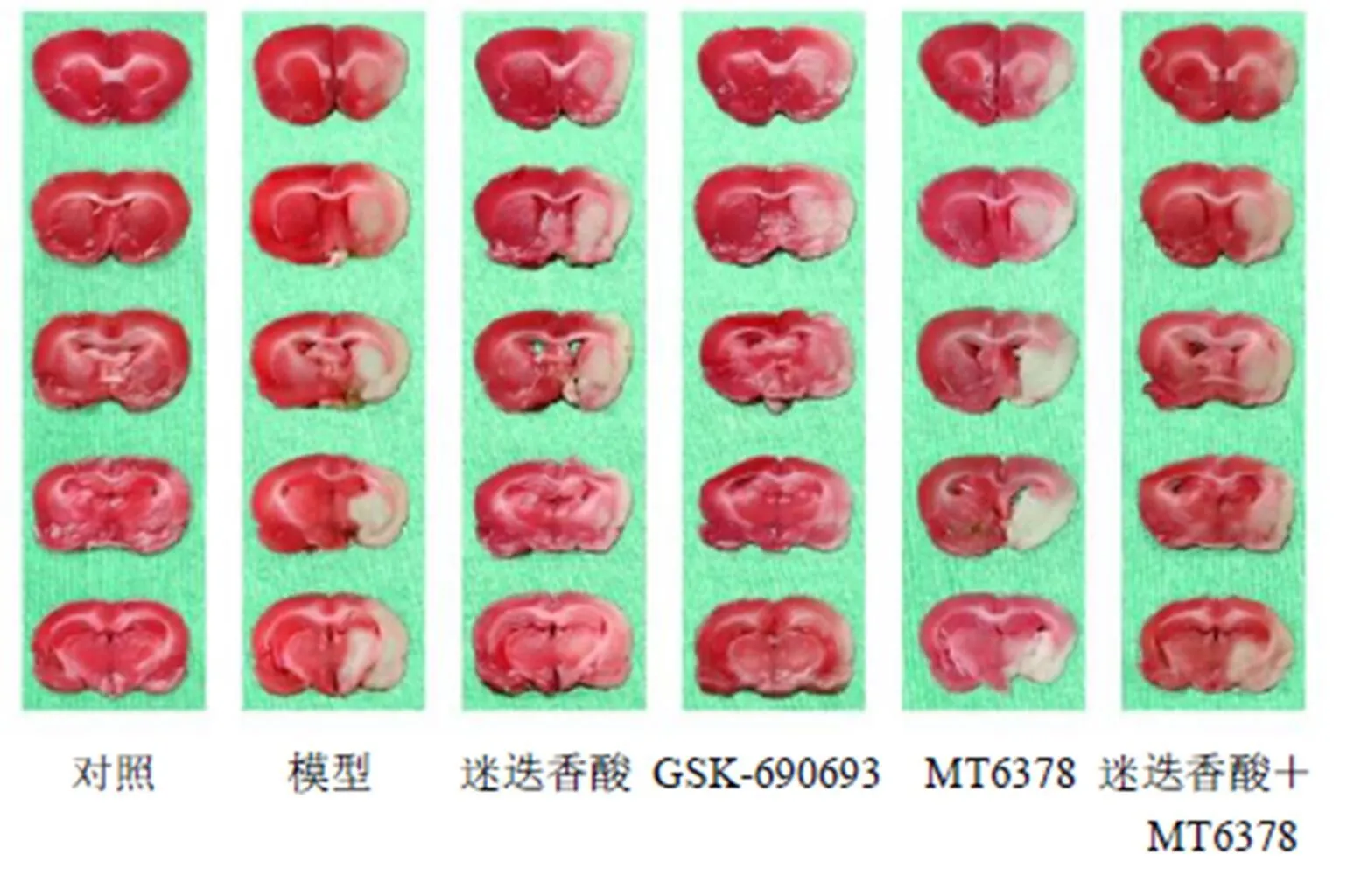
图1 迷迭香酸对HIE大鼠脑梗死面积的影响
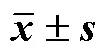
表1 迷迭香酸对HIE大鼠脑梗死面积的影响(, n =6)
与对照组比较:#<0.05;与模型组比较:*<0.05;与迷迭香酸组比较:▲<0.05,下表同
#< 0.05control group;*< 0.05model group;▲< 0.05rosmarinic acid group, same as below tables
3.2 迷迭香酸对HIE大鼠海马神经元超微结构及自噬标记物表达的影响
LC3B是自噬形成的标记物,其表达高低可反映自噬通量的强弱。如图2和表2所示,对照组大鼠海马组织神经元结构正常,线粒体、高尔基体及内质网结构清晰,有少量溶酶体形成;LC3B在海马神经元胞质中弱阳性表达。与对照组相比,模型组及迷迭香酸+MT6378组大鼠海马神经元胞质及胞核固缩,线粒体肿胀,高尔基体及内质网结构模糊甚至消失,泡状自噬体及自噬溶酶体形成较多,部分自噬泡中包裹有未消化的细胞质,海马神经元胞质中LC3B阳性染色,LC3B阳性表达显著升高(<0.05)。与模型组相比,迷迭香酸组及GSK-690693组大鼠海马神经元核固缩减少,线粒体肿胀缓解,自噬空泡及自噬溶酶体形成减少,LC3B阳性表达显著减少(<0.05);MT6378组可见自噬空泡及自噬融酶体形成进一步增加,LC3B阳性表达进一步升高(<0.05)。

白色箭头:自噬小体;黑色箭头:自噬溶酶体
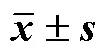
表2 迷迭香酸对HIE大鼠海马神经元LC3B阳性表达的影响(, n = 6)
3.3 迷迭香酸对HIE大鼠海马神经元凋亡的影响
如图3和表3所示,对照组海马神经元少量细胞呈棕黄色,与对照组相比,模型组大鼠细胞染色加深,细胞凋亡率显著升高(<0.05)。与模型组相比,迷迭香酸组及GSK-690693组细胞凋亡率显著降低(<0.05);MT6378组细胞凋亡率进一步升高(<0.05)。与迷迭香酸组相比,迷迭香酸+MT6378组大鼠海马神经元凋亡率显著升高(<0.05),GSK-690693组海马神经元凋亡率差异无统计学意义。
3.4 迷迭香酸对HIE大鼠海马神经元p-AMPK表达的影响
如图4和表4所示,p-AMPK在对照组大鼠海马神经元胞质中呈弱阳性表达。与对照组相比,模型组大鼠海马神经元胞质中p-AMPK阳性表达升高(<0.05)。与模型组相比,迷迭香酸组及GSK-690693组大鼠海马神经元p-AMPK阳性表达降低(<0.05)。与迷迭香酸组相比,迷迭香酸+MT6378组大鼠海马神经元p-AMPK阳性表达升高(<0.05),GSK-690693组p-AMPK阳性表达差异无统计学意义。

图3 迷迭香酸对HIE大鼠海马神经元凋亡的影响 (×200)
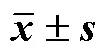
表3 迷迭香酸对HIE大鼠海马神经元凋亡率的影响(, n = 6)
3.5 迷迭香酸对HIE大鼠海马组织cleaved Caspase-3、LC3B、mTOR、p-mTOR、Ulk1、p-Ulk1蛋白表达的影响
如图5和表5所示,与对照组相比,模型组大鼠海马组织cleaved Caspase-3、LC3B-II/I蛋白表达水平显著升高(<0.05),p-mTOR/mTOR、p-Ulk1/Ulk1蛋白表达水平显著降低(<0.05)。与模型组相比,迷迭香酸组及GSK-690693组大鼠海马组织cleaved Caspase-3、LC3B-II/I蛋白表达水平显著降低(<0.05),p-mTOR/mTOR、p-Ulk1/Ulk1蛋白表达水平显著升高(<0.05)。与迷迭香酸组相比,迷迭香酸+MT6378组大鼠海马组织cleaved Caspase-3、LC3B-II/I蛋白表达水平显著升高(<0.05),p-mTOR/mTOR、p-Ulk1/Ulk1蛋白表达水平显著降低(<0.05),GSK-69063组上述蛋白表达差异均无统计学意义。
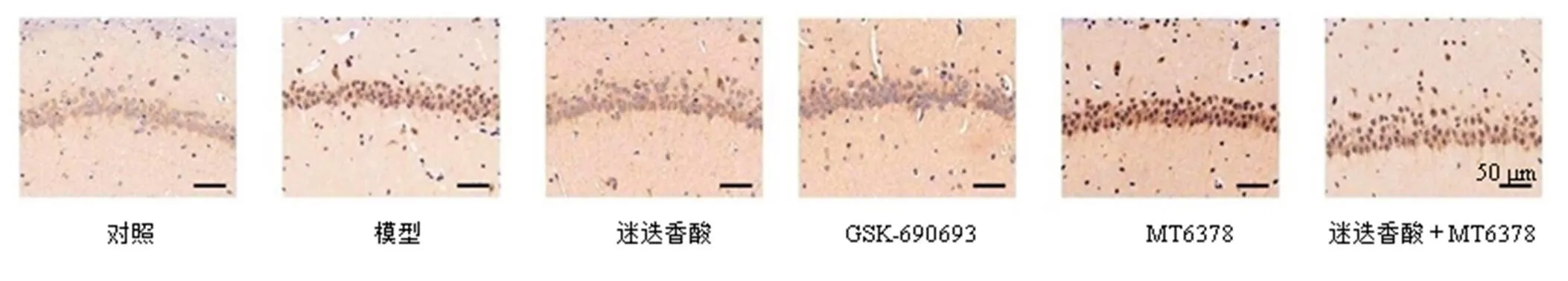
图4 迷迭香酸对HIE大鼠海马神经元p-AMPK表达的影响(×200)
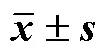
表4 迷迭香酸对HIE大鼠海马神经元p-AMPK表达的影响(, n = 6)
4 讨论
据流行病学分析,发展中国家每1000个新生儿中,有8~26个罹患HIE[2]。HIE是新生儿危害最大的常见疾病之一,目前临床上尚无有效的治疗方法[13]。新生儿脑组织对缺血缺氧最为敏感,本研究采用7日龄大鼠建立HIE模型后发现,大鼠脑梗死面积增加,海马神经元肿胀、核固缩坏死严重,神经元细胞凋亡率升高,提示造模成功。大鼠ig迷迭香酸后,迷迭香酸在脑、心脏等多个脏器中均有分布[14];姚润心等[15]研究发现迷迭香酸可通过抗炎、抗氧化应激、抗凋亡途径发挥对脑缺血再灌注损伤的保护作用。本研究发现,给予迷迭香酸干预后,大鼠脑梗死面积下降20%,海马神经元细胞凋亡率显著降低,神经元肿胀及坏死明显缓解,提示迷迭香酸可减轻HIE脑损伤及神经元凋亡症状,在HIE领域有潜在的应用价值。

A-对照组 B-模型组 C-迷迭香酸组 D-GSK-690693组 E-MT6378组 F-迷迭香酸+MT6378组
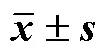
表5 迷迭香酸对HIE大鼠海马组织cleaved Caspase-3、LC3B、mTOR、p-mTOR、Ulk1、p-Ulk1蛋白表达的影响(, n = 8)
细胞自噬可清除受损的细胞器,降解并再利用相关细胞器、蛋白质等维护细胞内环境稳态、避免细胞凋亡,产生能量以避免离子失衡和细胞坏死,从而发挥神经保护作用[16]。但细胞内分子和细胞器损伤及功能损害进一步增强,自噬过度活化后,神经细胞难以通过自噬使细胞回归正常状态而诱导神经细胞死亡,发挥神经破坏作用[17]。自噬在HIE过程中的调控作用一直是临床研究的热点之一,但自噬激活在HIE过程中发挥神经保护作用,还是神经破坏作用,还一直存在争议[5]。Li等[18]用氯喹抑制脑缺血缺氧24 h的新生10日大鼠自噬后,脑损伤加重,神经元凋亡增加,推测自噬激活在HIE过程中发挥保护作用。Wang等[19]发现抑制HIE大鼠脑皮质神经自噬后,大鼠脑损伤及神经元凋亡减少,推测HIE过程中存在自噬过度激活,损害神经。本研究发现HIE大鼠海马神经元中自噬体及自噬溶酶体形成较多,自噬标记蛋白LC3B表达升高,提示HIE大鼠海马神经元中存在自噬激活现象;迷迭香酸组大鼠海马神经元中自噬溶酶体及自噬标记蛋白表达降低,提示迷迭香酸发挥抗HIE脑损伤作用,可能与抑制自噬有关,与Wang等[19]研究结果一致。
AMPK及mTOR均可直接磷酸化Ulk1,调控自噬。研究证实,缺血缺氧条件下,脑组织糖氧消耗量增大,而脑组织糖元储备不足,神经元能量耗竭严重时,AMPK激活,一方面能抑制能量消耗,刺激能量产生来降低脑部能量消耗[20],另一方面能抑制mTOR活化,减轻Ulk1磷酸化,促进AMPK-Ulk1相互作用而激活自噬,清除受损细胞器来发挥脑保护作用[21]。本研究发现,模型组大鼠海马组织神经元胞质中p-AMPK表达升高,p-Ulk1、p-mTOR表达异常降低;MT6378进一步激活AMPK后,p-AMPK表达升高,p-Ulk1、p-mTOR表达进一步降低,大鼠死亡及脑梗死严重,神经元自噬及凋亡进一步加重,与容志惠等[7]报道的AMPK过度激活会促进Caspase-3蛋白表达而加重脑损伤观点相一致,也与Wang等[19]报道的激活自噬加重HIE脑损伤观点相一致。迷迭香酸与AMPK抑制剂GSK-690693组作用一致,p-AMPK表达降低,p-Ulk1、p-mTOR表达升高,自噬及凋亡降低,提示迷迭香酸抑制HIE海马神经元自噬及凋亡作用,可能与抑制AMPK/mTOR通路激活有关,而MT6378可逆转迷迭香酸的上述作用。
综上所述,迷迭香酸可能通过抑制AMPK/mTOR通路激活,降低海马神经元自噬及凋亡进程,发挥抗HIE脑损伤作用。但HIE海马神经元凋亡及损伤的调控网络复杂,涉及多种途径多条调控机制,迷迭香酸发挥抗HIE脑损伤的其他机制还有待深入探究。
利益冲突 所有作者均声明不存在利益冲突
[1] Kamino D, Almazrooei A, Pang E W,.Abnormalities in evoked potentials associated with abnormal glycemia and brain injury in neonatal hypoxic-ischemic encephalopathy [J]., 2021, 132(1): 307-313.
[2] Cinelli D, Lacroix C, Myers K A.Rhythmic sawtooth electroencephalograph waveforms in neonatal hypoxic- ischemic/hypoglycemic encephalopathy [J]., 2019, 91: 70-71.
[3] 甘亚, 何钢, 刘嵬, 等.迷迭香酸及其衍生物的合成研究进展 [J].成都大学学报: 自然科学版, 2020, 39(2): 131-137.
[4] 曹雯, 张文娟, 潘金凤, 等.迷迭香酸药理作用的研究进展 [J].广西中医药, 2019, 42(1): 54-58.
[5] 黄林, 鲁利群.细胞自噬与缺氧缺血性脑损伤的研究进展 [J].中国医药导报, 2019, 16(35): 40-43.
[6] Holczer M, Hajdú B, Lőrincz T,.Fine-tuning of AMPK-ULK1-mTORC1 regulatory triangle is crucial for autophagy oscillation [J]., 2020, 10(1): 17803.
[7] 容志惠, 刘伟, 李文斌, 等.单磷酸腺苷激活的蛋白激酶在新生大鼠缺氧缺血性脑损伤中的动态变化 [J].中华围产医学杂志, 2016, 19(8): 603-607.
[8] Cai C C, Zhu J H, Ye L X,.protects against hypoxic-ischemic brain injury by regulating mitochondria-mediated autophagy via the AMPK pathway [J]., 2019, 2019: 4248529.
[9] 朱波, 杨艳, 苏仁意, 等.丹参酮IIA注射液对缺血缺氧性脑损伤新生大鼠皮质神经元自噬及Akt-mTOR通路的影响 [J].中国中医急症, 2019, 28(2): 204-208.
[10] 郭少波, 徐露露, 蒋丽娟, 等.迷迭香酸的大鼠体内代谢产物及代谢途径分析 [J].中国中药杂志, 2019, 44(21): 4704-4712.
[11] Zadra G, Photopoulos C, Tyekucheva S,.A novel direct activator of AMPK inhibits prostate cancer growth by blocking lipogenesis [J]., 2014, 6(4): 519-538.
[12] Liu T T, Ding T L, Ma Y,.Selective α1B-and α1D-adrenoceptor antagonists suppress noradrenaline- induced activation, proliferation and ECM secretion of rat hepatic stellate cells[J]., 2014, 35(11): 1385-1392.
[13] 黄文卿, 张巍, 刘巍巍.新生儿缺氧缺血性脑病相关药物治疗的研究进展 [J].医学综述, 2020, 26(22): 4457-4461.
[14] 张磊, 雷玲, 杨薇, 等.迷迭香酸灌胃给予后在大鼠主要脏器组织中分布及排泄的初步研究 [J].中药药理与临床, 2020, 36(5): 79-83.
[15] 姚润心, 王歆烨, 杨瑞瑞.迷迭香酸对脑缺血再灌注损伤保护作用的研究 [J].农垦医学, 2020, 42(5): 448-452.
[16] Maiti P, Peruzzaro S, Kolli N,.Transplantation of mesenchymal stem cells overexpressing interleukin-10 induces autophagy response and promotes neuroprotection in a rat model of TBI [J]., 2019, 23(8): 5211-5224.
[17] Wang Z F, Gao C, Chen W,.Salubrinal offers neuroprotection through suppressing endoplasmic reticulum stress, autophagy and apoptosis in a mouse traumatic brain injury model [J]., 2019, 161: 12-25.
[18] Li P, Hao L, Guo Y Y,.Chloroquine inhibits autophagy and deteriorates the mitochondrial dysfunction and apoptosis in hypoxic rat neurons [J]., 2018, 202: 70-77.
[19] Wang S, Xue H, Xu Y,.Sevoflurane postconditioning inhibits autophagy through activation of the extracellular signal-regulated kinase cascade, alleviating hypoxic-ischemic brain injury in neonatal rats [J]., 2019, 44(2): 347-356.
[20] Li W, Chaudhari K, Shetty R,.Metformin alters locomotor and cognitive function and brain metabolism in normoglycemic mice [J]., 2019, 10(5): 949-963.
[21] Chen S J, Guo D D, Lei B B,.Biglycan protects human neuroblastoma cells from nitric oxide-induced death by inhibiting AMPK-mTOR mediated autophagy and intracellular ROS level [J]., 2020, 42(4): 657-668.
Rosmarinic acid attenuates hypoxic-ischemic encephalopathy in neonatal rats through AMPK/mTOR pathway
ZHAO Yu-xia, CHEN Ying-qian
Children’s Rehabilitation Department, Zhumadian Central Hospital, Zhumadian 463000, China
To investigate the effect of rosmarinic acid on neonatal rats with hypoxic ischemic encephalopathy (HIE) and regulation on adenosine monophosphate activated protein kinase (AMPK)/mammalian target of rapamycin (mTOR) pathway, and preliminarily explore its brain protection mechanism.Seven-day-old SD neonatal rats were randomly divided into control group, model group, rosmarinic acid (300 mg/kg) group, AMPK/mTOR agonist MT6378 (10 mg/kg) group, AMPK inhibitor GSK-690693 (30 mg/kg) group and rosmarinic acid (300 mg/kg) + MT6378 (10 mg/kg) group, with 20 rats in each group.HIE model was established, corresponding drugs were given for intervention, TTC staining method was used to detect cerebral infarction; Transmission electron microscope (TEM) was used to observe the structure damage and autophagy of hippocampal neurons; Immunofluorescence method was used to detect the positive expression level of autophagy marker protein microtubule-associated protein 1 light chain 3B (LC3B); TUNEL method was used to detect neuronal cell apoptosis rate; Immunohistochemistry was used to detect the positive expression level of phosphorylated AMPK (p-AMPK); Western blotting was used to detect the expressions of cleaved Caspase-3, mTOR and its phosphorylated protein (p-mTOR), uncoordinated-51 like autophagy activating kinase 1 (Ulk1) and its phosphorylated protein (p-Ulk1), LC3B in hippocampal tissue.Compared with control group, rats in model group had severe cerebral infarction, hippocampal neuron structure damage and autophagy vacuoles were more formed, autophagy and apoptosis levels were increased, AMPK/mTOR pathway was activated (< 0.05).Compared with model group, rats in rosmarinic acid group and GSK-690693 group had cerebral infarction, hippocampal neuron structural damage and apoptosis and autophagy were weakened, and AMPK/mTOR pathway was inhibited (< 0.05); AMPK/mTOR pathway was further activated in hippocampal tissue of rats in MT6378 group, cerebral infarction, hippocampal neuron structural damage, apoptosis and autophagy were further aggravated (< 0.05); MT6378 reversed the above effects of rosmarinic acid (< 0.05).Rosmarinic acid may play an anti-HIE brain injury effect through inhibiting the activation of AMPK/mTOR pathway and reducing the autophagy and apoptosis of hippocampal neurons.
rosmarinic acid; hypoxic-ischemic encephalopathy; AMPK/mTOR pathway; neonatal rats; autophagy; apoptosis
R285.5
A
0253 - 2670(2021)22 - 6897 - 07
10.7501/j.issn.0253-2670.2021.22.015
2021-06-29
赵玉霞(1983—),女,硕士,主治医师,主要从事儿童康复方面研究。E-mail: zyx09871@163.com
[责任编辑 李亚楠]

