丹参酮IIA对阿霉素耐药人乳腺癌细胞的多药耐药逆转作用及机制研究
宁玉明,潘一帆,李范珠
丹参酮IIA对阿霉素耐药人乳腺癌细胞的多药耐药逆转作用及机制研究
宁玉明1,潘一帆1,李范珠2
1.杭州市富阳区妇幼保健院,浙江 杭州 311400 2.浙江中医药大学药学院,浙江 杭州 311400
研究丹参酮IIA对阿霉素耐药人乳腺癌细胞MCF-7/ADR的多药耐药逆转作用及相关机制。分别用丹参酮IIA、阿霉素、阿霉素联合丹参酮IIA处理人乳腺癌MCF-7细胞和MCF-7/ADR细胞,采用MTT法检测细胞增殖率;流式细胞术检测丹参酮IIA干预后MCF-7/ADR细胞内阿霉素蓄积量的变化;检测丹参酮IIA干预后MCF-7/ADR细胞三磷酸腺苷(adenosine triphosphate,ATP)消耗量的变化;采用qRT-PCR、Western blotting法检测丹参酮IIA干预后MCF-7/ADR细胞ATP结合转运蛋白B1(ATP-binding cassette transporter B1,)、和基因和蛋白表达的变化。丹参酮IIA显著抑制MCF-7及MCF-7/ADR细胞增殖(<0.05),呈剂量相关性;丹参酮IIA能够逆转MCF-7/ADR细胞的多药耐药性(<0.05),增加MCF-7/ADR细胞内阿霉素的蓄积(<0.05),减少MCF-7/ADR细胞的ATP消耗(<0.05),显著下调和基因和蛋白表达(<0.05)。丹参酮IIA能够通过调控ABCG2、ABCC1介导的转运,逆转MCF-7/ADR细胞的多药耐药性。
丹参酮IIA;阿霉素;乳腺癌;多药耐药;ABC转运蛋白
乳腺癌是全世界女性最常见的癌症之一,也是女性癌症死亡的主要原因[1]。化疗是治疗乳腺癌的主要临床手段之一。自20世纪30年代后期引入化疗以来,已经有200多种化合物被批准用于肿瘤治疗。然而癌细胞不断发展的多药耐药性严重限制了化疗药物的作用,显著降低了其临床疗效。乳腺癌细胞的耐药性往往具有多重机制,其中基因表达导致的多药耐药最受关注,特别是三磷酸腺苷结合盒(adenosine triphosphate-binding cassette,ABC)家族成员如ABCB1、ABCG2和ABCC1的过表达,增加了细胞毒性药物的外排,导致化疗药物细胞内积累减少,疗效降低甚至发生耐药。因此,抑制或下调ABC转运蛋白的表达成为逆转多药耐药的策略之一[2-3]。自1981年第1个ABCB1抑制剂维拉帕米被报道以来,多种ABC转运体抑制剂相继被研究开发,但由于其亲和力较低、药物间不可预测的相互作用和毒性,很少用于临床常规治疗[2,4-5]。此外,大多数已被报道的ABC转运蛋白抑制剂在体内并没有表现出预期的抗癌效果[6]。因此,开发新型ABC转运蛋白抑制剂的研究仍在进行中。
阿霉素属于蒽环类药物,是目前治疗乳腺癌最有效的化疗药物之一[7]。心脏毒性是其主要不良反应之一。阿霉素是ABCB1、ABCG2及ABCC1的反应底物[8-9]。丹参酮IIA是丹参的脂溶性有效成分,《中国药典》2020年版将其作为丹参提取物的质量控制指标之一[10-12]。丹参酮IIA具有心血管保护、抗肿瘤的作用[13-20]。研究发现,丹参酮IIA可以增加阿霉素在阿霉素耐药人乳腺癌细胞MCF-7/ADR中的蓄积,提示丹参酮IIA可能有逆转人乳腺癌获得性多药耐药的作用[21]。本研究考察丹参酮IIA对MCF-7/ADR细胞的多药耐药逆转作用及相关机制,以期为乳腺癌治疗提供一定的理论依据。
1 材料
1.1 细胞株
人乳腺癌MCF-7细胞及MCF-7/ADR细胞由浙江大学药学院应晓英研究员惠赠。
1.2 药品与试剂
丹参酮IIA(批号I14010E8,质量分数≥98%)、盐酸维拉帕米(批号K1417048,质量分数≥99%)购自上海阿拉丁生化科技股份有限公司;盐酸阿霉素(批号1050-C190901,质量分数≥98%)购自浙江海正药业股份有限公司;ABCG2选择性抑制剂Ko143(质量分数≥98%)、二甲基亚砜(DMSO)、Triton X-100、cocktail蛋白酶抑制剂购自美国Sigma-Aldrich公司;DMEM培养基(批号10566-016)、0.25%胰酶-0.02%EDTA、胎牛血清、双抗购自美国Gibco公司;HBSS、PBS购自杭州吉诺生物制品有限公司;MTT购自美国Amresco公司;三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒、RIPA裂解液(批号P0013)、PMSF(批号ST506)、SDS-PAGE蛋白上样缓冲液(批号P0015)购自碧云天生物技术有限公司;BCA蛋白检测试剂盒(批号CW0014S)购自北京康为世纪生物科技有限公司;TRIzol®Reagent购自英国Invitrogen公司;The first strand cDNA synthesis kit购自美国Thermo Fisher Scientific公司;GoTaq®Qpcr Master Mix购自美国Promega公司;引物由上海生工生物工程有限公司设计并合成;ABCB1单克隆抗体(批号ab170904)、ABCC1单克隆抗体(批号ab180960)、ABCG2单克隆抗体(批号ab108312)购自英国Abcam公司;GAPDH单克隆抗体(批号E021010-01)购自美国ImmunoWay公司;山羊抗兔抗体(926-68071)、山羊抗鼠抗体(926-32210)购自美国LI-COR公司;其他试剂购自国药集团有限公司,均为分析纯或色谱纯。
1.3 仪器
CP225D电子天平(德国Sartorius公司);Mill-Q超纯水仪(美国Millipore公司);倒置显镜(Nikon公司);低温离心机、5% CO2培养箱、生物安全柜、Nano Drop分光光度计(美国Thermo Fisher Scientific公司);SpectraMax M2酶标仪、FACSCalibur流式细胞仪(美国MD公司);PCR仪(德国Eppendorf公司);qRT-PCR仪、蛋白质电泳及电转移装置(美国Bio-Rad公司);奥德赛红外荧光成像分析系统(美国LI-COR公司)。
2 方法
2.1 细胞培养
MCF-7细胞用含10%胎牛血清、1%双抗、1%-谷氨酰胺的DMEM培养基,于37 ℃、5% CO2培养箱培养,MCF-7/ADR细胞另加入1.840 μmol/L盐酸阿霉素维持耐药性。当细胞融合度达到80%~90%,用胰酶消化后传代。
2.2 MTT法考察丹参酮IIA对MCF-7和MCF-7/ADR细胞存活率的影响
取对数生长期的MCF-7和MCF-7/ADR细胞,PBS漂洗2次,胰酶消化后,1000 r/min离心5 min,用DMEM培养基重悬,以1×104/mL接种于96孔板,培养24 h。吸去培养基,每孔加入150 μL终浓度为0.034、0.170、0.340、0.680、1.700、3.400、17.000、34.000、68.000 μmol/L的丹参酮IIA溶液,另设空白组加入不含药物的培养基,孵育48 h,弃去培养基,每孔加入100 μL MTT溶液(0.5 mg/mL),继续培养4 h,弃去上清液,加入150 μL DMSO,摇床振摇10 min,用多功能酶标仪测定570 nm处的吸光度()值,计算细胞存活率。
细胞存活率=(实验-空白)/(对照-空白)
2.3 MTT法考察丹参酮IIA对MCF-7和MCF-7/ADR细胞阿霉素敏感性的影响
取对数生长期的MCF-7和MCF-7/ADR细胞,PBS漂洗2次,胰酶消化后,1000 r/min离心5 min,用DMEM培养基重悬,以1×104/mL接种于96孔板,培养24 h。吸去培养基,每孔加入150 μL终浓度为0.023、0.230、2.300、11.499、22.998、45.996、91.993、183.986 μmol/L的阿霉素溶液,或各浓度阿霉素联合丹参酮IIA(0.034、0.340 μmol/L)、各浓度阿霉素联合盐酸维拉帕米(2.200 μmol/L)、各浓度阿霉素联合Ko143(1.065 μmol/L),继续孵育48 h。按“2.2”项下方法测定值,并计算半数抑制浓度(half inhibitory concentration,IC50)、耐药逆转倍数及耐药指数。
耐药逆转倍数=阿霉素IC50/联合用药IC50
耐药指数=MCF-7细胞IC50/(MCF-7/ADR细胞IC50)
2.4 流式细胞术检测丹参酮IIA对MCF-7/ADR细胞内阿霉素蓄积的影响
MCF-7/ADR细胞以3×105/孔接种于6孔板,培养24 h。吸去培养基,PBS漂洗1次,设置对照组、丹参酮IIA(0.034、0.340 μmol/L)组、维拉帕米(2.200 μmol/L)组和Ko143(1.065 μmol/L)组,各给药组加入1 mL含相应药物的DMEM培养基,预孵育1或3 h,弃去培养基,另加入1 mL含18.400 μmol/L阿霉素的上述各培养基继续孵育4 h,对照组只加入含18.400 μmol/L阿霉素的培养基,吸去培养基,PBS洗3次,用250 μL胰酶消化2 min后,加入DMEM培养基终止消化,1000 r/min离心5 min,弃上清,冰PBS吹匀,1000 r/min离心5 min,PBS洗涤3次,过70 μm滤膜,加至96孔板,采用流式细胞仪测定阿霉素荧光强度。
2.5 丹参酮IIA对MCF-7/ADR细胞ATP消耗的影响
取对数生长期的MCF-7/ADR细胞,以1×105/孔接种于24孔板,培养48 h,PBS洗3次,设置对照组、丹参酮IIA(0.340、1.700、3.400 μmol/L)组和维拉帕米(2.200 μmol/L)组,各组加入0.5 mL含相应药物的DMEM培养基,对照组加入不含药物的培养基,培养48 h。按ATP检测试剂盒说明书处理细胞,用酶标仪化学发光模块检测相对光单位值,通过ATP标准曲线换算成ATP浓度,用BCA蛋白试剂盒检测每孔细胞蛋白水平校正ATP浓度。
2.6 丹参酮IIA对MCF-7/ADR细胞相关基因表达的影响
MCF-7/ADR细胞以2.5×105/mL接种于6孔板,2 mL/孔,培养48 h,吸去培养基,PBS漂洗2次,设置对照组、丹参酮IIA(0.340、1.700、3.400 μmol/L)组和维拉帕米(2.200 μmol/L)组,各组加入1.5 mL含相应药物的DMEM培养基,对照组加入不含药物的培养基,培养48 h。PBS洗3次,按照试剂盒说明书提取细胞总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。
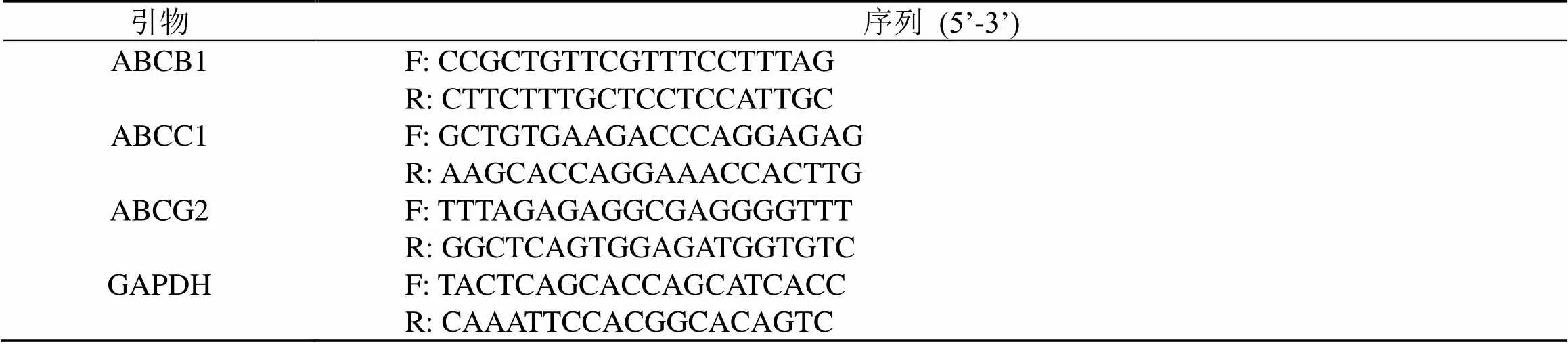
表1 引物序列
2.7 丹参酮IIA对MCF-7/ADR细胞相关蛋白表达的影响
MCF-7/ADR细胞以2.5×105/mL接种于25 cm2培养瓶,4 mL/瓶,培养48 h后,吸去培养基,PBS漂洗2次,设置对照组、丹参酮IIA(0.340、0.680、1.700、3.400 μmol/L)组和维拉帕米(2.200 μmol/L)组,各组加入4 mL含相应药物的DMEM培养基,对照组加入不含药物的培养基,培养48 h。收集细胞,4 ℃、3000 r/min离心5 min,弃上清,加入150 μL RIPA裂解液(含cocktail蛋白酶抑制剂及PMSF),于冰上裂解30 min,4 ℃、12 000 r/min离心15 min,取上清,采用BCA蛋白定量试剂盒测定蛋白质量浓度,100 ℃煮沸10 min,于−70 ℃保存。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%牛血清蛋白封闭1~2 h,分别加入ABCB1、ABCG2、ABCC1抗体(1∶1000)和GAPDH抗体(1∶5000),4 ℃摇床孵育过夜;加入荧光二抗(1∶5000),室温避光孵育2 h,TBST缓冲液漂洗5次,8 min/次,采用红外荧光成像分析系统扫描。
2.8 统计学方法
3 结果
3.1 丹参酮IIA对MCF-7和MCF-7/ADR细胞存活率的影响
如图1所示,丹参酮IIA(17.000、34.000、68.000 μmol/L)作用于MCF-7细胞48 h后,MCF-7细胞存活率明显降低;丹参酮IIA(0.680、1.700、3.400、17.000、34.000、68.000 μmol/L)作用于MCF-7/ADR细胞48 h后,MCF-7/ADR细胞存活率明显降低。因此后续丹参酮IIA分别选取不高于0.340、3.400 μmol/L的浓度对MCF-7和MCF-7/ADR进行实验。
3.2 丹参酮IIA对MCF-7和MCF-7/ADR细胞阿霉素敏感性的影响
如表2所示,阿霉素分别作用于MCF-7和MCF-7/ADR细胞48 h后,IC50值分别为(1.799±0.109)μmol/L和(34.865±2.383)μmol/L,表明MCF-7/ADR细胞具备耐药性。与阿霉素组比较,ABCB1经典抑制剂维拉帕米、ABCG2选择性抑制剂Ko143及丹参酮IIA均能引起MCF-7/ADR细胞阿霉素的IC50值显著降低(<0.05),0.034、0.340 μmol/L丹参酮IIA对MCF-7/ADR细胞多药耐药的逆转倍数分别为1.473、2.510倍。维拉帕米、Ko143对MCF-7和MCF-7/ADR细胞活性的影响已在前期实验经过考察,本研究中所用浓度均为无毒剂量。结果提示丹参酮IIA可显著增强MCF-7/ADR细胞对阿霉素的敏感性。

图1 丹参酮IIA对MCF-7和MCF-7/ADR细胞增殖的影响(, n = 3)

表2 丹参酮IIA对MCF-7/ADR细胞的多药耐药逆转作用(, n = 3)
与阿霉素组比较:*<0.05**<0.01
*<0.05**<0.01doxorubicin group
3.3 丹参酮IIA对MCF-7/ADR细胞内阿霉素蓄积的影响
如图2所示,孵育时间为1 h时,维拉帕米、Ko143均能显著增加MCF-7/ADR细胞内阿霉素蓄积(<0.05),丹参酮IIA对MCF-7/ADR细胞内阿霉素蓄积作用不明显。当孵育时间延长至3 h时,各给药组MCF-7/ADR细胞内阿霉素蓄积量均显著升高(<0.05、0.01),维拉帕米对MCF-7/ADR细胞内阿霉素蓄积作用最明显,Ko143的作用最弱,结果与多药耐药逆转实验基本一致。
3.4 丹参酮IIA对MCF-7/ADR细胞ATP消耗的影响
ABC转运蛋白利用ATP作为能量来源介导转运,细胞内ATP消耗结果见图3,丹参酮IIA(0.340、1.700、3.400 μmol/L)处理MCF-7/ADR细胞后,胞内ATP消耗量显著降低(<0.05),呈剂量相关性,提示丹参酮IIA可能对包括ABCB1在内的多种ABC转运蛋白均有抑制作用。
3.5 丹参酮IIA对MCF-7/ADR细胞ABCB1、ABCC1和ABCG2基因表达的影响
如图4所示,与对照组比较,丹参酮IIA(3.400 μmol/L)组MCF-7/ADR细胞mRNA表达水平显著降低(<0.05),丹参酮IIA(0.340、1.700、3.400 μmol/L)组MCF-7/ADR细胞mRNA表达水平显著降低(<0.01),丹参酮IIA(1.700、3.400 μmol/L)组MCF-7/ADR细胞mRNA表达水平显著降低(<0.01),提示丹参酮IIA对MCF-7/ADR细胞多药耐药的逆转作用可能与下调和mRNA表达有关。
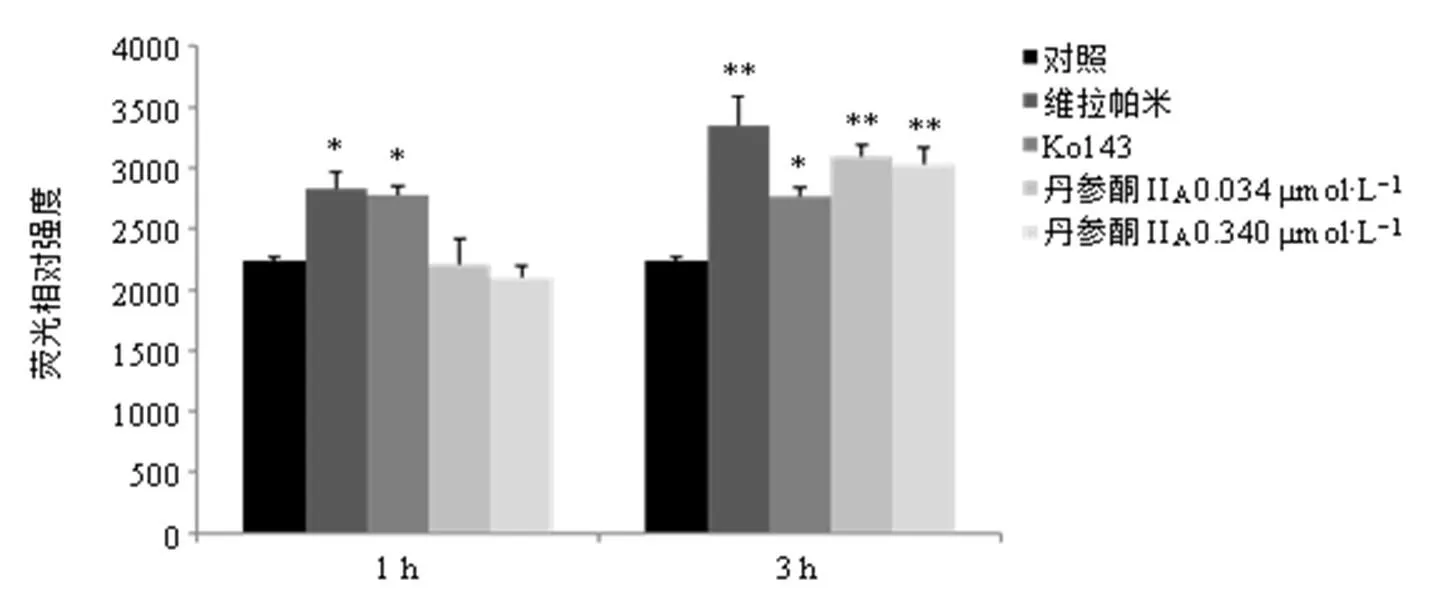
与对照组比较:*P<0.05 **P<0.01,下图同
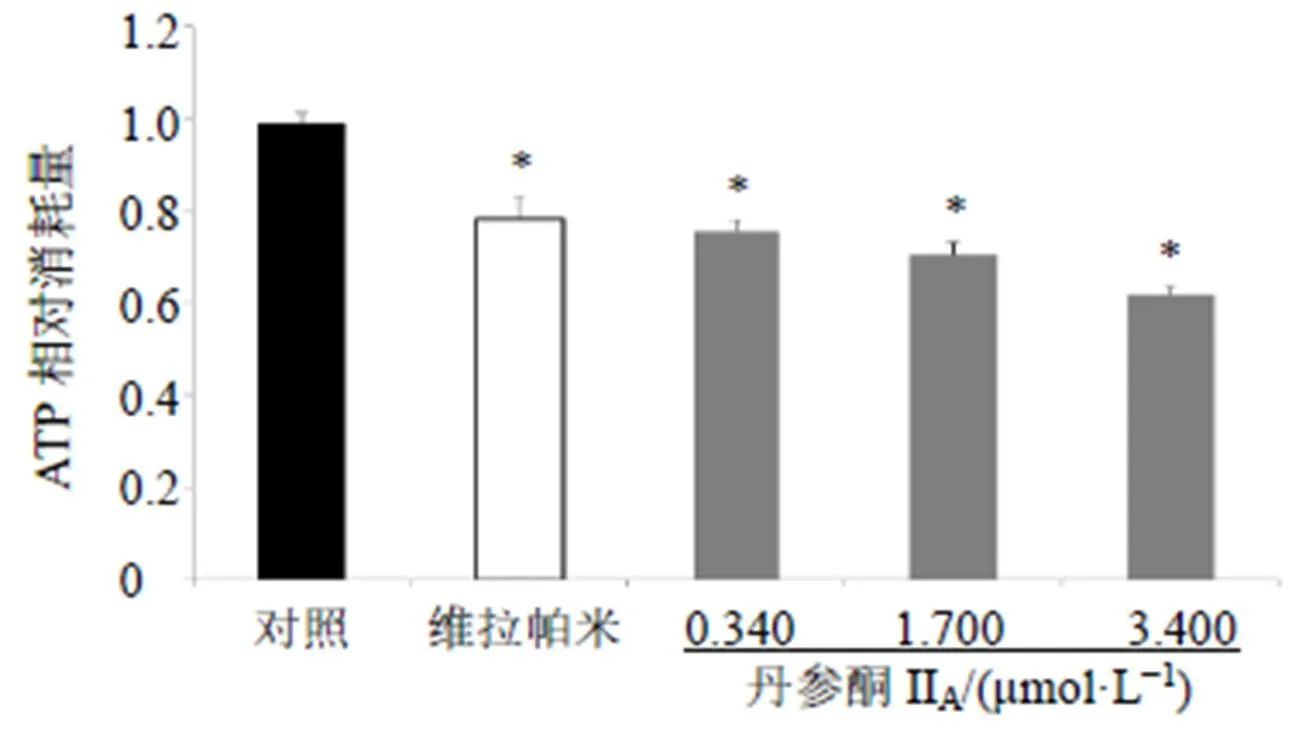
图3 丹参酮IIA对MCF-7/ADR细胞内ATP消耗的影响(, n = 3)
3.6 丹参酮IIA对MCF-7/ADR细胞ABCB1、ABCC1和ABCG2蛋白表达的影响
如图5所示,与对照组比较,丹参酮IIA(0.340、0.680、1.700、3.400 μmol/L)组MCF-7/ADR细胞ABCG2蛋白表达水平显著降低(<0.05),丹参酮IIA(1.700、3.400 μmol/L)组MCF-7/ADR细胞ABCC1蛋白表达水平显著降低(<0.05),丹参酮IIA对MCF-7/ADR细胞ABCB1蛋白表达无明显影响,提示丹参酮IIA逆转MCF-7/ADR细胞的多药耐药作用与抑制ABCG2和ABCC1蛋白表达有关。
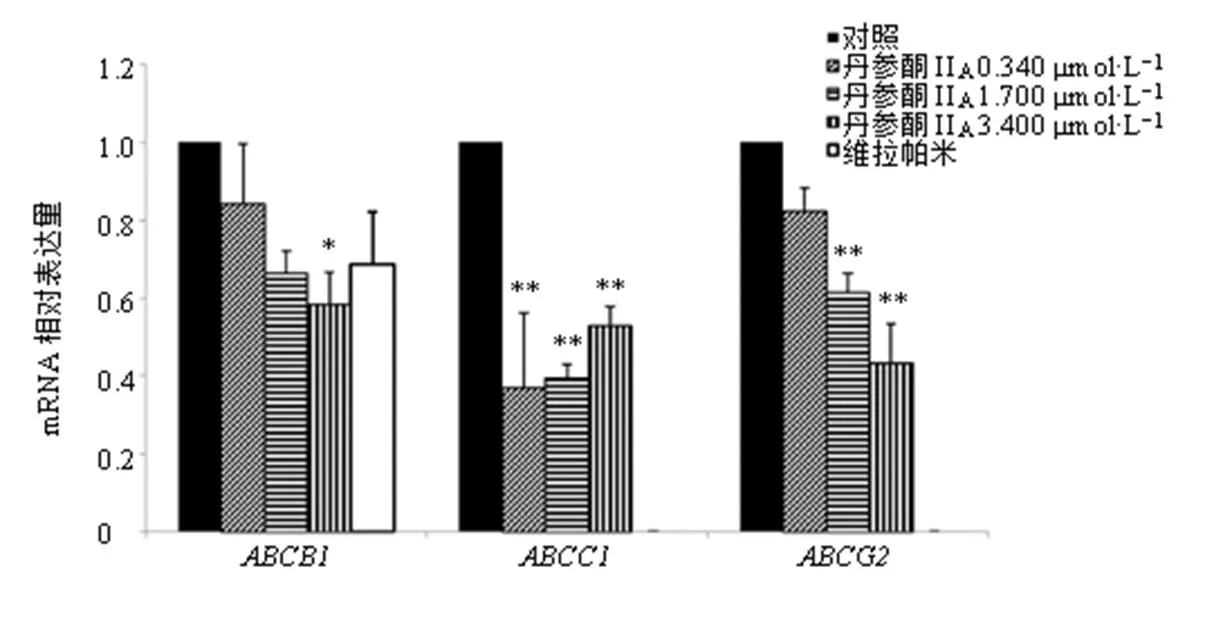
图4 丹参酮IIA对MCF-7/ADR细胞ABCB1、ABCG2和ABCC1mRNA表达的影响(, n = 3)
4 讨论
随着我国对中医药传承创新发展的重视,探索中药联合化疗药物的疗效及作用机制将是抗肿瘤的发展方向之一。研究表明,丹参酮IIA对阿霉素诱导的心脏毒性具有保护作用[17];阿霉素与丹参酮IIA可协同抑制肝癌HepG2细胞[22];丹参酮IIA具有一定的多药耐药逆转作用,可通过下调结肠癌细胞ABCB1表达从而增强5-氟尿嘧啶的抗癌活性[23];丹参酮IIA能够通过抑制胎盘ABCB1的表达而降低其外排功能[24],降低ABCB1、DNA拓扑异构酶II(topoisomerase II,TOPO II)的表达逆转小鼠Lewis肺癌获得性多药耐药性(耐阿霉素)[25]。丹参酮IIA对人ER阴性乳腺癌细胞具有多药耐药逆转作用,其作用机制可能与下调多药耐药基因表达有关[26]。丹参酮IIA可通过抑制ABCC1的活性增强阿霉素对耐药胃癌细胞的抗癌作用[27]。本研究通过联用丹参酮IIA与阿霉素,考察其对MCF-7/ADR细胞多药耐药的逆转作用及机制。
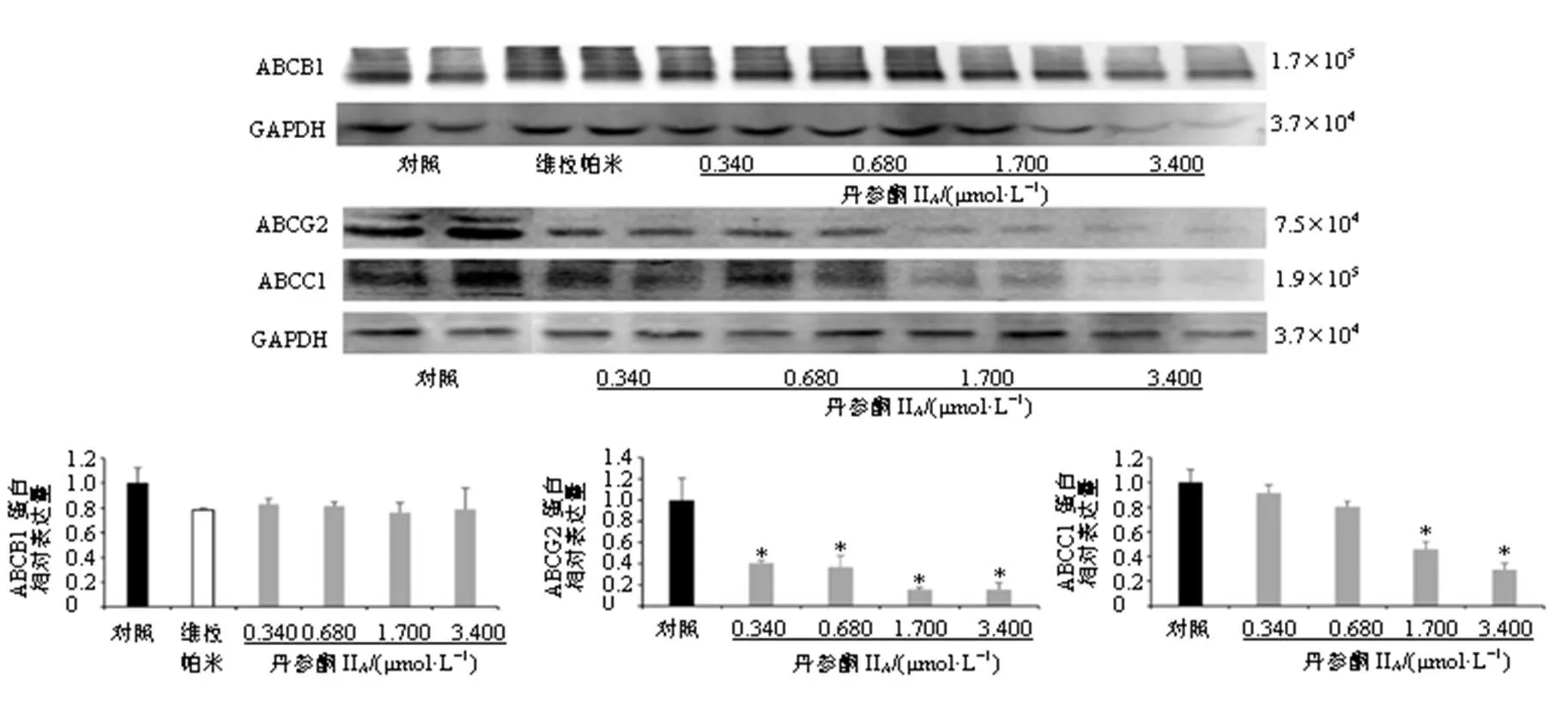
图5 丹参酮IIA对MCF-7/ADR细胞ABCB1、ABCG2和ABCC1蛋白表达的影响(, n = 3)
本研究发现,丹参酮IIA对MCF-7和MCF-7/ADR细胞具有一定的抗肿瘤活性,并且丹参酮IIA联合阿霉素能够有效逆转MCF-7/ADR细胞的多药耐药性。维拉帕米是ABCB1转运蛋白的底物,能够与抗癌药物竞争ABCB1转运蛋白,抑制其外排,从而逆转多药耐药[28],Ko143是ABCG2的抑制剂[29],因此在MCF-7/ADR细胞耐药逆转实验中分别选择维拉帕米和Ko143作为阳性对照药物,结果显示,维拉帕米的耐药逆转倍数最高,Ko143的耐药逆转倍数最低,而丹参酮IIA的逆转倍数界于二者之间。阿霉素摄取实验结果与耐药逆转实验基本一致,提示阿霉素虽然是多种ABC转运蛋白的底物,但MCF-7/ADR细胞对其耐药的最主要原因可能是ABCB1介导的转运作用,丹参酮IIA逆转MCF-7/ADR细胞阿霉素耐药的主要作用机制可能与其竞争性抑制ABCB1对阿霉素的外排作用有关,但也不排除丹参酮IIA对多种ABC转运蛋白均有一定的综合下调作用。
为了进一步探讨丹参酮IIA逆转MCF-7/ADR细胞多药耐药的作用机制,考察丹参酮IIA对MCF-7/ADR细胞、、基因和蛋白表达的影响,发现MCF-7/ADR细胞中、、基因和蛋白表达显著升高,丹参酮IIA对和mRNA和蛋白表达均有明显的下调作用,但对ABCB1的下调作用不明显。对于ABCB1介导的调控,推测丹参酮IIA可能发挥了维拉帕米类似的与抗癌药物竞争ABCB1引起外排抑制的作用。以上研究表明,丹参酮IIA能够通过调控多种ABC转运体尤其是和基因和蛋白表达,逆转MCF-7/ADR细胞的多药耐药性。
丹参酮IIA是中药丹参中天然的抗肿瘤成分[30],本研究表明,丹参酮IIA对于有效逆转化疗中出现的多药耐药现象提供了一种新的策略,其有可能作为一种潜在化疗增敏剂用于治疗乳腺癌,对于肿瘤的临床治疗具有重要意义。
利益冲突 所有作者均声明不存在利益冲突
[1] Torre L A, Bray F, Siegel R L,.Global cancer statistics, 2012 [J]., 2015, 65(2): 87-108.
[2] Gottesman M M, Lavi O, Hall M D,.Toward a better understanding of the complexity of cancer drug resistance [J]., 2016, 56: 85-102.
[3] Ozben T.Mechanisms and strategies to overcome multiple drug resistance in cancer [J]., 2006, 580(12): 2903-2909.
[4] Gottesman M M, Fojo T, Bates S E.Multidrug resistance in cancer: Role of ATP-dependent transporters [J]., 2002, 2(1): 48-58.
[5] Tsuruo T, Iida H, Tsukagoshi S,.Overcoming of vincristine resistance in P388 leukemiaandthrough enhanced cytotoxicity of vincristine and vinblastine by verapamil [J]., 1981, 41(5): 1967-1972.
[6] Yin Q, Shen J N, Zhang Z W,.Multifunctional nanoparticles improve therapeutic effect for breast cancer by simultaneously antagonizing multiple mechanisms of multidrug resistance [J]., 2013, 14(7): 2242-2252.
[7] Shi Y H, Bieerkehazhi S, Ma H.Next-generation proteasome inhibitor oprozomib enhances sensitivity to doxorubicin in triple-negative breast cancer cells [J]., 2018, 11(5): 2347-2355.
[8] Chen T, Wang C Y, Liu Q,.Dasatinib reverses the multidrug resistance of breast cancer MCF-7 cells to doxorubicin by downregulating P-gp expression via inhibiting the activation of ERK signaling pathway [J]., 2015, 16(1): 106-114.
[9] 刘源, 倪渐凤芳, 刘丽娜, 等.丹参酮IIA抑制胃癌细胞的阿霉素耐药 [J].中国病理生理杂志, 2019, 35(12): 2208-2214.
[10] Jiao J W, Wen F.Tanshinone IIAacts via p38 MAPK to induce apoptosis and the down-regulation of ERCC1 and lung-resistance protein in cisplatin-resistant ovarian cancer cells [J]., 2011, 25(3): 781-788.
[11] Li G B, Shan C Y, Liu L,.Tanshinone IIAinhibits HIF-1α and VEGF expression in breast cancer cells via mTOR/p70S6K/RPS6/4E-BP1 signaling pathway [J]., 2015, 10(2): e0117440.
[12] 中国药典 [S].一部.2020: 77.
[13] Liu Z P, Wang J J, Huang E W,.Tanshinone IIAsuppresses cholesterol accumulation in human macrophages: Role of heme oxygenase-1 [J]., 2014, 55(2): 201-213.
[14] Hong H J, Liu J C, Chen P Y,.Tanshinone IIAprevents doxorubicin-induced cardiomyocyte apoptosis through Akt-dependent pathway [J]., 2012, 157(2): 174-179.
[15] Chan P, Liu J C, Lin L J,.Tanshinone IIAinhibits angiotensin II-induced cell proliferation in rat cardiac fibroblasts [J]., 2011, 39(2): 381-394.
[16] Hong H J, Liu J C, Cheng T H,.Tanshinone IIAattenuates angiotensin II-induced apoptosis via Akt pathway in neonatal rat cardiomyocytes [J]., 2010, 31(12): 1569-1575.
[17] Jiang B H, Zhang L, Wang Y C,.Tanshinone IIAsodium sulfonate protects against cardiotoxicity induced by doxorubicinand[J]., 2009, 47(7): 1538-1544.
[18] Gao J, Yang G Q, Pi R B,.Tanshinone IIAprotects neonatal rat cardiomyocytes from adriamycin-induced apoptosis [J]., 2008, 151(2): 79-87.
[19] Weng Y S, Wang H F, Pai P Y,.Tanshinone IIAprevents Leu27IGF-II-induced cardiomyocyte hypertrophy mediated by estrogen receptor and subsequent Akt activation [J]., 2015, 43(8): 1567-1591.
[20] Zhang Y, Jiang P, Ye M,.Tanshinones: Sources, pharmacokinetics and anti-cancer activities [J]., 2012, 13(10): 13621-13666.
[21] 吴春霞, 樊晨星, 王秀艳, 等.丹参酮IIA对乳腺癌细胞阿霉素化疗敏感性的影响及相关机制研究[J].中草药, 2019, 50(7): 1657-1663.
[22] Kan S D, Cheung W M, Zhou Y L,.Enhancement of doxorubicin cytotoxicity by tanshinone IIAin HepG2 human hepatoma cells [J]., 2014, 80(1): 70-76.
[23] Su C C.Tanshinone IIApotentiates the efficacy of 5-FU in Colo205 colon cancer cellsthrough downregulation of P-gp and LC3-II [J]., 2012, 3(3): 555-559.
[24] Wang C, Li H Y, Zhou K Y,.Sodium tanshinone IIAsulfonate and sodium danshensu open the placental barrier through down-regulation of placental P-glycoprotein in mice: Implications in the transplacental digoxin treatment for fetal heart failure [J]., 2014, 176(3): 1331-1333.
[25] 何欣, 曾柏荣, 刘华.丹参酮IIA对小鼠Lewis肺癌获得性多药耐药及相关酶系影响的实验研究 [J].中医药导报, 2010, 16(9): 89-91.
[26] 敬静, 郑鸿, 王静, 等.丹参酮IIA对人ER阴性乳腺癌细胞的生长抑制和多耐药逆转作用 [J].四川大学学报: 医学版, 2007, 38(3): 391-395.
[27] Xu Z Y, Chen L, Xiao Z G,.Potentiation of the anticancer effect of doxorubicinin drug-resistant gastric cancer cells by tanshinone IIA[J]., 2018, 51: 58-67.
[28] 叶玲, 叶娟, 鲁继光, 等.共载多西他赛和维拉帕米脂质体逆转肿瘤耐药性的研究 [J].药学学报, 2020, 55(5): 1035-1041.
[29] Westover D, Ling X, Lam H,.FL118, a novel camptothecin derivative, is insensitive to ABCG2 expression and shows improved efficacy in comparison with irinotecan in colon and lung cancer models with ABCG2-induced resistance [J]., 2015, 14: 92.
[30] 孙环宇, 许晴, 张燕欣,等.丹参类制剂及丹参活性成分改善脑循环作用机制的研究进展[J].药物评价研究, 2020, 43(8): 1496-1500.
Reversal effect and mechanism of tanshinone IIA on multidrug resistance of doxorubicin-resistant human breast cancer cells
NING Yu-ming1, PAN Yi-fan1, LI Fan-zhu2
1.Hangzhou Fuyang Women and Children Hospital, Hangzhou 311400, China 2.College of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou 311400, China
To study the reversal effect of tanshinone IIAon multidrug resistance of doxorubicin-resistant human breast cancer cells MCF-7/ADR and related mechanisms.Human breast cancer MCF-7 cells and MCF-7/ADR cells were respectively treated with tanshinone IIA, doxorubicin, doxorubicin + tanshinone IIA, cell proliferation rate was detected by MTT method; Doxorubicin accumulation in MCF-7/ADR cells after tanshinone IIAintervention was detected by flow cytometry; Change of adenosine triphosphate (ATP) consumption in MCF-7/ADR cells after tanshinone IIAintervention was detected; qRT-PCR and Western blotting were used to detect ATP-binding cassette transporter B1 (),andgenes and protein expressions in MCF-7/ADR cells after tanshinone IIAintervention.Tanshinone IIAsignificantly inhibited the cell proliferation of MCF-7 and MCF-7/ADR cells (< 0.05), with dose-dependent; Tanshinone IIAreversed the multidrug resistance of MCF-7/ADR cells (< 0.05), increased the accumulation of doxorubicin in MCF-7/ADR cells (< 0.05), reduced the ATP consumption of MCF-7/ADR cells (< 0.05), down-regulated the expressions ofandgenes and proteins (< 0.05).Tanshinone IIAcan reverse the multidrug resistance of MCF-7/ADR cells by regulating the transport mediated by ABCG2 and ABCC1.
tanshinone IIA; doxorubicin; breast cancer; multidrug resistance; ABC transporter
R285.5
A
0253 - 2670(2021)22 - 6890 - 07
10.7501/j.issn.0253-2670.2021.22.014
2021-06-17
杭州市科技计划项目(20171226Y187)
宁玉明(1976—),女,博士,研究方向为药物新剂型及药物临床应用研究。Tel: 13968190002 E-mail: cndnym@163.com
[责任编辑 李亚楠]

