穴位电刺激辅助麻醉对腹腔镜直肠癌根治术患者免疫功能及术后并发症的影响*
蔡清香,王 勇,王佳南,黎 峰,黄彦逵,张广防
(广州中医药大学第一附属医院,广东 广州510405)
恶性肿瘤的发生与进展是多阶段逐渐演变的过程,其原因在于患者免疫力下调、T淋巴细胞活性下降、活化的自然杀伤(NK)细胞数目减少,导致机体抗肿瘤能力低下[1]。外科手术是治疗直肠癌的有效手段,虽然腹腔镜手术相比于传统开腹手术的创伤更小,患者术后恢复速度较快,但疾病病理因素与手术麻醉应激均可导致机体免疫抑制,不仅可增加患者出现术后感染的风险,还可能导致肿瘤转移复发[2],可见围手术期对患者免疫功能的保护和患者远期预后具有重要意义。穴位电刺激(TEAS)是将神经电刺激与针灸相结合的新型针刺疗法,研究表明TEAS可以对体液免疫、细胞免疫进行双向调节,在术后镇痛、调节机体内分泌及免疫功能方面均有突出的疗效[3]。本次研究旨在探讨TEAS辅助麻醉对腹腔镜直肠癌根治术患者免疫功能及术后并发症的影响,规范TEAS辅助麻醉的实施方案。现报告如下。
1 资料与方法
1.1 纳入标准(1)确诊为直肠癌[4],并行腹腔镜直肠癌根治术的患者;(2)美国麻醉医师协会(ASA)分级[5]为Ⅰ~Ⅱ级;(3)年龄<80岁,体质量45~80 kg;(4)自愿加入本次研究,并签署知情同意书。
1.2 排除标准(1)近期使用过免疫抑制剂者;(2)合并神经系统、免疫系统疾病者;(3)合并冠心病、高血压、糖尿病者;(4)刺激部位的穴位感染或对电极片过敏者。
1.3 研究对象 选取2018年1月至2019年9月在本院接受腹腔镜直肠癌根治术治疗的96例患者作为研究对象,对患者进行随机编号,采用随机数字表法将入选患者分为A组、B组和C组,每组32例。本次研究经本院伦理委员会批准同意进行,批准号:NO.K(2018)169。
1.4 治疗方法
1.4.1 麻醉方法 麻醉诱导:3组患者均行全凭静脉麻醉,缓慢静脉注射舒芬太尼(0.3 μg/kg),维库溴铵(0.1 mg/kg),异丙酚(2 mg/kg)。麻醉维持:氧气流量2 L/min,静脉持续泵注丙泊酚[4~10 mg/(kg·h)],瑞芬太尼[0.1~0.2 μg/(kg·min)]。采用定压控制通气模式行机械通气,二氧化碳分压维持在35~45 mm Hg(1 mm Hg=0.133 kPa)。术中连续监测Narcotrend指数(NTI)值维持在D0~D2之间。
1.4.2 TEAS方案A组患者于麻醉诱导前行TEAS,持续30 min;B组患者于麻醉诱导前30 min进行TEAS并维持至手术完毕。取足三里穴、内关穴。连接经皮穴位刺激仪进行穴位电刺激,电流强度从1 mA开始逐渐增至8~12 mA,以患者耐受为宜。C组患者仅在穴位处贴电极贴片,不采取TEAS。术毕,患者采用电子镇痛泵进行自控硬膜外镇痛。
1.5 观察指标(1)疼痛评分:采用视觉模拟评分法(VAS)评估患者术后1、12、24、48 h疼痛情况,0分表示无痛,10分表示剧痛,患者评分越高,表示疼痛程度越严重。(2)镇痛药用量:记录患者术后12、24、48 h舒芬太尼用量,并进行分析比较。(3)记录患者术后肠鸣音恢复、首次排气及排便时间,并进行分析比较。(4)生化指标检测:3组患者于术前和术后1、3、5 d抽取5 mL外周静脉血,采用流式细胞仪检测CD3+、CD4+、CD8+、NK细胞水平,采用酶联免疫吸附法检测血清胃动素(MTL)水平与白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)水平,试剂盒均购自上海晶抗生物工程有限公司,严格按照试剂盒说明书执行各项操作。(5)并发症比较:记录3组患者术后并发症发生情况,包括恶心呕吐、腹胀、头晕、是否出现呼吸抑制等,对3组患者的并发症发生率进行对比分析。
1.6 统计学方法 采用SPSS 22.0统计软件分析。计量资料用(±s)表示,呈正态分布且方差齐,3组比较采用多因素方差分析,重复测量资料采用重复测量方差分析。计数资料采用例和率表示,3组比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料3组患者基线资料比较,差异均无统计学意义(P>0.05),具有可比性。(见表1)

表1 3组患者基线资料比较
2.2 3组患者术后各时间段VAS评分比较 时间因素与分组因素存在交互效应(F=48.976,P=0.000);所有患者术后不同时间段VAS评分比较,差异有统计学意义(F=9.582,P=0.000),即存在时间效应,A组、B组患者均如此,A组、B组患者术后VAS评分均呈先升高然后降低的趋势,均在术后12 h达到峰值;3组患者VAS评分整体比较,差异有统计学意义(F=12.743,P=0.000),即存在分组效应,B组患者VAS评分低于A组,A组患者VAS评分低于C组。(见表2)
表2 3组患者术后各时间段VAS评分比较(±s,分)

表2 3组患者术后各时间段VAS评分比较(±s,分)
注:F时间主效应=9.582,P时间主效应=0.000;F分组主效应=12.743,P分组主效应=0.000;F交互效应=48.976,P交互效应=0.000;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术后1 h 术后12 h 术后24 h 术后48 h F P A组 32 2.42±0.41 2.58±0.60 2.37±0.48 2.27±0.35 3.371 0.039 B组 32 2.37±0.44 2.41±0.63a 2.15±0.28a 1.77±0.26a 18.319 0.000 C组 32 2.59±0.36 2.81±0.62ab 2.69±0.51ab 2.53±0.37ab 2.424 0.094 F 2.599 3.390 12.442 43.802 P 0.080 0.038 0.000 0.000
2.3 3组患者术后各时间段舒芬太尼用量比较 时间因素与分组因素存在交互效应(F=44.631,P=0.000);所有患者术后不同时间段舒芬太尼用量比较,差异有统计学意义(F=31.875,P=0.000),即存在时间效应,3组患者均如此,均呈逐渐升高的趋势;3组患者舒芬太尼用量整体比较,差异有统计学意义(F=28.523,P=0.000),即存在分组效应,B组患者舒芬太尼用量少于A组,A组患者舒芬太尼用量少于C组。(见表3)
表3 3组患者术后各时间段舒芬太尼用量比较(±s,μg)
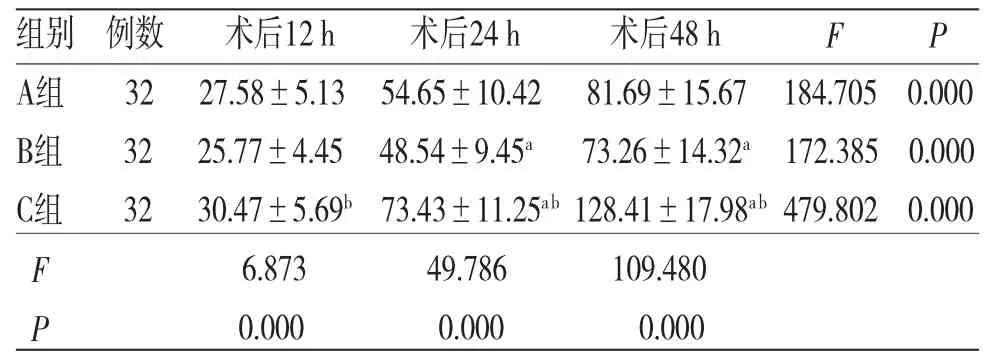
表3 3组患者术后各时间段舒芬太尼用量比较(±s,μg)
注:F时间主效应=31.875,P时间主效应=0.000;F分组主效应=28.523,P分组主效应=0.000;F交互效应=44.631,P交互效应=0.000;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术后12 h 术后24 h 术后48 h F P A组 32 27.58±5.13 54.65±10.42 81.69±15.67 184.705 0.000 B组 32 25.77±4.45 48.54±9.45a 73.26±14.32a 172.385 0.000 C组 32 30.47±5.69b 73.43±11.25ab 128.41±17.98ab 479.802 0.000 F 6.873 49.786 109.480 P 0.000 0.000 0.000
2.4 3组患者术后胃肠功能恢复情况比较3组患者术后肠鸣音恢复、首次排气及排便时间比较,B组<A组<C组,差异均有统计学意义(P<0.05)。(见表4)
表4 3组患者术后胃肠功能恢复情况比较(±s,d)
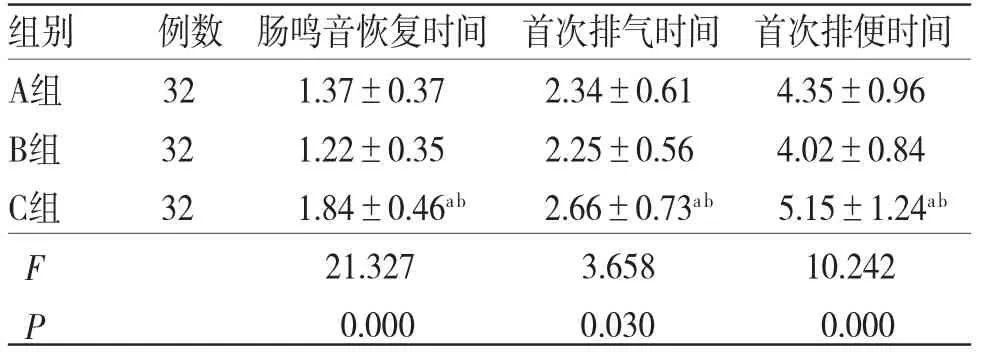
表4 3组患者术后胃肠功能恢复情况比较(±s,d)
注:与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 肠鸣音恢复时间 首次排气时间 首次排便时间A组 32 1.3 7±0.37 2.34 2±0.35 2.25±0.61 4.35±0.96 B组 32 1.2±0.56 4.02±0.84 C组 32 1.84±0.46ab 2.66±0.73ab 5.15±1.24ab F 21.327 3.658 10.242 P 0.000 0.030 0.000
2.5 3组患者各时间段T淋巴细胞亚群及NK细胞水平比较 时间因素与分组因素对CD3+、CD4+及NK细胞水平的影响存在交互效应(P<0.05);所有患者不同时间段CD3+、CD4+及NK细胞水平比较,差异均有统计学意义(P<0.05),即存在时间效应,3组均如此,3组患者CD3+、CD4+及NK细胞水平均呈先降低然后升高的趋势,均在术后1 d达到最低值;所有患者不同时间段CD4+/CD8+比较,差异无统计学意义(P>0.05),不存在时间效应;3组患者CD3+、CD4+、CD4+/CD8+及NK细胞水平整体比较,差异均有统计学意义(P<0.05),即存在分组效应,B组患者CD3+、CD4+及NK细胞水平均高于A组,A组患者CD3+、CD4+及NK细胞水平均高于C组。3组患者CD4+/CD8+整体比较,差异无统计学意义(P<0.05),不存在分组效应。(见表5~9)
表5 3组患者各时间段CD3+细胞水平比较(±s,%)

表5 3组患者各时间段CD3+细胞水平比较(±s,%)
注:F时间主效应=8.976,P时间主效应=0.000;F分组主效应=14.257,P分组主效应=0.000;F交互效应=9.472,P交互效应=0.000;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 58.21±6.88 52.47±5.74 55.68±6.76 61.25±6.37 15.892 0.000 B组 32 58.25±6.93 54.36±5.86 57.84±7.05 63.55±6.43 16.483 0.000 C组 32 59.41±5.33 50.12±4.75ab 53.68±5.84ab 58.86±7.40ab 16.483 0.000 F 0.360 4.821 3.209 3.863 P 0.698 0.010 0.045 0.024
表6 3组患者各时间段CD4+细胞水平比较(±s,%)

表6 3组患者各时间段CD4+细胞水平比较(±s,%)
注:F时间主效应=21.754,P时间主效应=0.000;F分组主效应=13.942,P分组主效应=0.000;F交互效应=34.856,P交互效应=0.000;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 34.36±3.87 28.94±3.42 31.86±3.57 35.43±3.42 28.067 0.000 B组 32 34.33±4.85 30.57±3.04 34.63±4.26 37.54±3.78 28.229 0.000 C组 32 34.27±3.41 27.32±4.15ab 30.23±2.91ab 33.91±3.37ab 28.261 0.000 F 0.004 6.643 12.069 8.544 P 0.995 0.002 0.000 0.000
表7 3组患者各时间段CD8+细胞水平比较(±s,%)

表7 3组患者各时间段CD8+细胞水平比较(±s,%)
注:F时间主效应=0.054,P时间主效应=0.946;F分组主效应=2.641,P分组主效应=0.092;F交互效应=0.094,P交互效应=0.906
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 27.06±3.85 26.94±4.22 27.04±3.31 27.02±3.47 0.007 0.993 B组 32 27.12±3.34 26.87±4.47 27.05±2.95 26.98±3.26 0.020 0.980 C组 32 26.97±4.29 27.06±3.89 27.12±4.25 27.01±3.59 0.005 0.995 F 0.012 0.017 0.005 0.001 P 0.988 0.983 0.995 0.999
表8 3组患者各时间段CD4+/CD8+比值比较(±s)
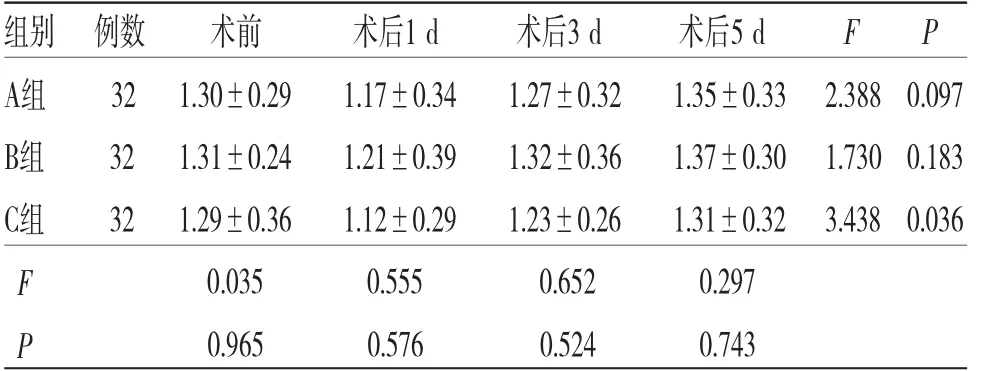
表8 3组患者各时间段CD4+/CD8+比值比较(±s)
注:F时间主效应=0.063,P时间主效应=0.937;F分组主效应=0.051,P分组主效应=0.949;F交互效应=0.097,P交互效应=0.903
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 1.30±0.29 1.17±0.34 1.27±0.32 1.35±0.33 2.388 0.097 B组 32 1.31±0.24 1.21±0.39 1.32±0.36 1.37±0.30 1.730 0.183 C组 32 1.29±0.36 1.12±0.29 1.23±0.26 1.31±0.32 3.438 0.036 F 0.035 0.555 0.652 0.297 P 0.965 0.576 0.524 0.743
表9 3组患者各时间段NK细胞水平比较(±s,%)
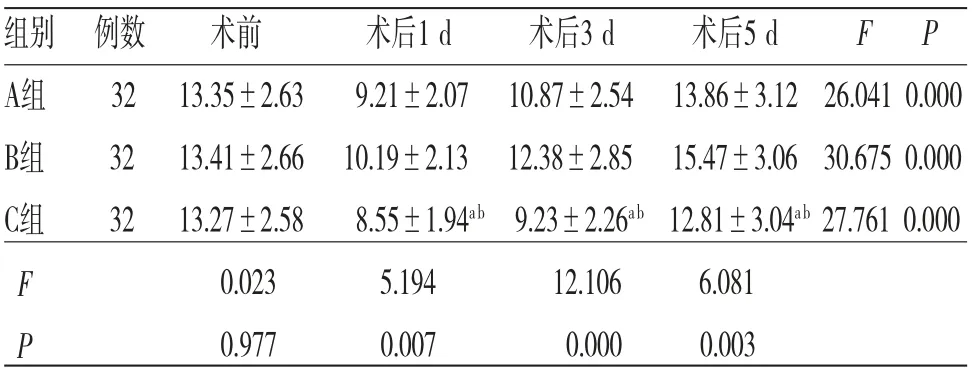
表9 3组患者各时间段NK细胞水平比较(±s,%)
注:F时间主效应=9.365,P时间主效应=0.000;F分组主效应=15.819,P分组主效应=0.000;F交互效应=17.391,P交互效应=0.000;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 13.35±2.63 9.21±2.07 10.87±2.54 13.86±3.12 26.041 0.000 B组 32 13.41±2.66 10.19±2.13 12.38±2.85 15.47±3.06 30.675 0.000 C组 32 13.27±2.58 8.55±1.94ab 9.23±2.26ab 12.81±3.04ab 27.761 0.000 F 0.023 5.194 12.106 6.081 P 0.977 0.007 0.000 0.003
2.6 3组患者各时间段血清MTL水平比较 时间因素与分组因素存在交互效应(F=3.753,P=0.029);所有患者术后不同时间段血清MTL水平比较,差异无统计学意义(F=2.564,P=0.078),不存在时间效应;3组患者不同时间段血清MTL水平比较,差异均有统计学意义(P<0.05),3组患者血清MTL水均呈先降低然后升高的趋势,均在术后1 d达到最低值,并于术后5 d恢复至术前相近水平;3组患者血清MTL水平整体比较,差异无统计学意义(F=2.754,P=0.106),不存在分组效应。(见表10)
表10 3组患者各时间段血清MTL水平比较(±s,pg/mL)
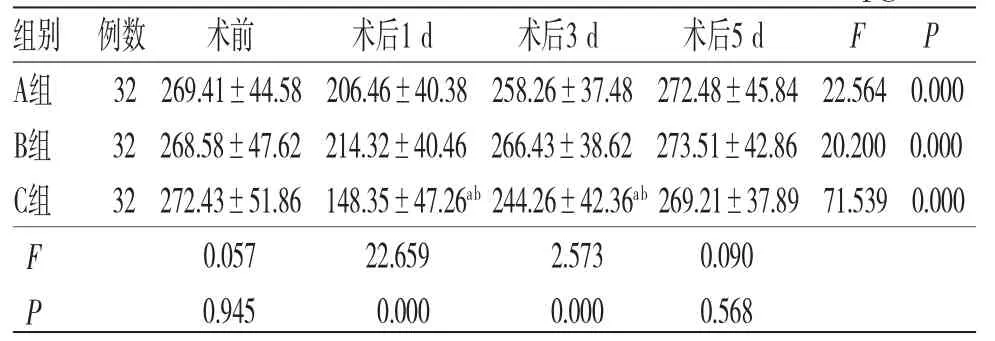
表10 3组患者各时间段血清MTL水平比较(±s,pg/mL)
注:F时间主效应=2.564,P时间主效应=0.078;F分组主效应=2.754,P分组主效应=0.106;F交互效应=3.753,P交互效应=0.029;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 269.41±44.58 206.46±40.38 258.26±37.48 272.48±45.84 22.564 0.000 B组 32 268.58±47.62 214.32±40.46 266.43±38.62 273.51±42.86 20.200 0.000 C组 32 272.43±51.86 148.35±47.26ab 244.26±42.36ab 269.21±37.89 71.539 0.000 F 0.057 22.659 2.573 0.090 P 0.945 0.000 0.000 0.568
2.7 3组患者各时间段血清细胞因子水平比较 时间因素与分组因素对血清IL-2、IL-6、IL-10水平的影响存在交互效应(P<0.05)。所有患者不同时间段血清IL-2、IL-6、IL-10水平比较,差异均有统计学意义(P<0.05),即存在时间效应,3组均如此;3组患者血清IL-2水平均呈先降低然后升高的趋势,均在术后1 d达到最低值;3组患者血清IL-6水平均呈先升高然后降低的趋势,均在术后3 d达到最峰值;A组患者血清IL-10水平呈逐渐升高的趋势;B组患者血清IL-10水平呈先降低然后升高的趋势,在术后1 d达到最低值;C组患者血清IL-10水平呈先升高然后降低的趋势,在术后1 d达到峰值。3组患者血清IL-2、IL-6、IL-10水平整体比较,差异均有统计学意义(P<0.05),即存在分组效应,A组、B组患者血清IL-2、IL-10水平均高于C组,血清IL-6水平均低于C组。(见表11~13)
表11 3组患者各时间段IL-2水平比较(±s,pg/mL)

表11 3组患者各时间段IL-2水平比较(±s,pg/mL)
注:F时间主效应=27.613,P时间主效应=0.000;F分组主效应=10.948,P分组主效应=0.000;F交互效应=41.854,P交互效应=0.000;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 53.62±6.47 46.53±5.88 51.26±5.42 53.54±6.65 11.346 0.000 B组 32 54.16±7.28 50.41±7.57 53.58±6.92 56.19±6.43 5.489 0.006 C组 32 53.24±6.19 24.96±4.34ab 30.42±4.57ab 51.28±8.65b 161.713 0.000 F 0.154 163.016 159.119 3.615 P 0.857 0.000 0.000 0.031
表12 3组患者各时间段血清IL-6水平比较(±s,pg/mL)

表12 3组患者各时间段血清IL-6水平比较(±s,pg/mL)
注:F时间主效应=131.537,P时间主效应=0.000;F分组主效应=113.748,P分组主效应=0.000;F交互效应=147.864,P交互效应=0.000;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 23.87±6.28 40.69±5.28 59.82±4.74 52.63±6.94 90.991 0.000 B组 32 24.72±6.64 36.94±5.16 58.23±7.28 50.26±8.14 76.138 0.000 C组 32 23.46±5.24 52.28±5.71ab 60.38±4.97 56.37±5.26ab 18.532 0.000 F 0.357 70.479 1.192 6.411 P 0.701 0.000 0.308 0.002
表13 3组患者各时间段血清IL-10水平比较(±s,pg/mL)

表13 3组患者各时间段血清IL-10水平比较(±s,pg/mL)
注:F时间主效应=49.585,P时间主效应=0.000;F分组主效应=54.263,P分组主效应=0.000;F交互效应=99.852,P交互效应=0.000;与A组比较,aP<0.05;与B组比较,bP<0.05
组别 例数 术前 术后1 d 术后3 d 术后5 d F P A组 32 34.26±4.56 36.82±5.63 43.86±6.72 45.63±5.81 18.850 0.000 B组 32 33.46±4.73 32.08±4.88 47.26±6.78 48.03±5.71 75.858 0.000 C组 32 34.57±4.18 35.42±5.87ab 32.64±5.68ab 31.52±5.96ab 3.786 0.026 F 0.519 6.328 45.540 74.978 P 0.597 0.003 0.000 0.000
2.8 3组患者术后并发症情况比较3组患者术后均未出现呼吸抑制,A组1例患者出现腹胀,2例患者出现恶心呕吐,2例出现头晕症状,并发症发生率为15.63%(5/32);B组患者2例出现恶心呕吐,1例出现头晕症状,并发症发生率为9.38%(3/32);C组患者2例出现腹胀,4例出现恶心呕吐,4例出现头晕症状,并发症发生率为31.25%(10/32)。B组并发症发生率明显低于C组(χ2=4.730,P=0.030);A组与B组比较,差异无统计学意义(χ2=0.571,P=0.450);A组与C组比较,差异无统计学意义(χ2=2.177,P=0.140)。
3 讨 论
直肠癌是一种常见的消化道恶性肿瘤,多数患者存在免疫抑制现象。腹腔镜直肠癌根治术可以有效消除肿瘤负荷,减轻免疫抑制状态。但受到手术创伤、麻醉刺激等影响,患者可能出现免疫功能失衡并引起机体应激反应,表现出腹胀、排气时间延长、恶心呕吐等不适症状,严重时还可能出现全身炎症反应综合征、水电解质紊乱、肠梗阻等[6]。为了促进患者术后康复,提高手术治疗效果,人们对手术麻醉提出了更高的要求。如何促进患者术后恢复,减少麻醉相关药物并发症成为医学界关注的焦点问题。传统医学中,针灸被运用到许多疾病的治疗之中,尤其是镇痛方面[7],TEAS是经皮神经电刺激与传统针灸疗法结合的产物,研究证实TEAS辅助麻醉有利于增强手术麻醉效果,减少镇痛药物的使用剂量。其镇痛机制可能在于激活内源性镇痛系统,并增加中枢水平内源性阿片肽释放量[8]。其调节免疫机制可能在于TEAS可以促进内源性阿片肽释放,β-内啡肽可以促进IL-2合成并降低IL-2受体表达水平,从而改善患者的免疫功能[9]。根据中医经络理论,足三里、内关穴是镇痛相关穴位[10],针灸刺激可以激活肥大细胞释放趋化因子、缓激肽、5-羟色胺、P物质等化学物质,并介导神经-内分泌-免疫系统信号传递过程,最终作用于靶器官发挥针刺效应。动物实验证实了针刺大鼠“足三里”可以诱发散落的肥大细胞颗粒释放5-羟色胺、组织胺等化学物质,有效抑制大鼠炎性疼痛[11]。内关穴属手阙阴心包经,常用于胸部手术镇痛之中,因其止痛效果明显,现也广泛应用于下腹部手术麻醉[12]。故本次研究选取足三里、内关穴行TEAS,观察其对直肠癌患者术后免疫功能及并发症的影响。
CD3+是成熟T淋巴细胞,反映机体细胞免疫状态。CD4+是辅助性T淋巴细胞,可分泌IL-2等细胞因子,IL-2可刺激CD4+、CD8+等细胞增殖分化过程,可增强机体免疫[13]。CD8+水平上调可促进肿瘤生长,通常情况下CD4+、CD8+相互制约、相互协调,维持着动态平衡,一旦比值降低,提示机体处于免疫抑制状态[14]。NK细胞可杀灭靶细胞,具有抗感染、抗肿瘤等作用。宋宇龙等[15]研究表明,术后1 d,患者CD3+、CD4+、NK细胞水平及CD4+/CD8+比值较术前降低,但术后3、5 d逐渐升高,且行TEAS组患者上升更加明显,说明TEAS能够有效调节机体免疫功能。本次研究表明,术后1 d,3组患者CD3+、CD4+、NK细胞水平及CD4+/CD8+比值较术前均有所下降,说明手术刺激可导致患者出现暂时性免疫抑制,术后患者免疫抑制状态会逐渐减轻。A组、B组患者术后CD3+、CD4+、NK细胞水平及CD4+/CD8+比值均高于手术前,提示TEAS可以调节腹腔镜直肠癌根治术患者的免疫功能。3组患者术后血清IL-2水平均下降,后逐渐回升也提示患者在术后会出现短暂的免疫抑制,术后IL-2水平逐渐恢复至术前水平,且各时间段B组>A组>C组,也说明TEAS具有调节机体免疫功能,减轻患者免疫抑制的效果。IL-6是由单核细胞、T细胞产生的调节因子,具有调节全身炎症反应的作用,可以作为反映机体炎症反应的主要指标[16]。3组患者术后IL-6水平均上调,但A组、B组术后各时间段IL-6水平均低于C组,提示TEAS可以在一定程度上下调机体的炎症反应。IL-10具有抑制T细胞分泌IL-2的作用,是一种重要的抗炎因子[17],A组、B组术后3、5 d的IL-10水平高于C组,提示TEAS有助于患者术后免疫功能恢复。3组患者术后1 d血清MTL水平均明显下调,MTL是内源性胃肠激素,可以刺激胃肠蠕动,加速胃排空[18]。术后患者可能出现自主神经功能紊乱,导致胃电节律失常从而引起恶心、呕吐、腹胀等一系列胃肠道反应。中医学认为,胃肠功能紊乱在于经气不畅、经络受损,针灸治疗可起到行气止痛、通经活络之效[19]。其中针刺足三里可以调节胃肠平滑肌功能,当胃肠蠕动减慢时,刺激足三里有助于提高其收缩力。胃肠平滑肌痉挛时,刺激足三里能够使胃肠平滑肌松弛,从而保证了胃肠平滑肌的正常功能[20]。刺激内关可增强胃动力,加速胃排空[21]。3组患者术后1 d MTL水平均明显下调,但B组>A组>C组(P<0.05)。说明TEAS可以有效改善患者胃肠功能,促进患者术后胃肠功能恢复。3组患者术后肠鸣音恢复、首次排气及排便时间比较,B组<A组<C组(P<0.05),证实了这一点。研究[22]指出,TEAS能促进内源性阿片肽释放从而发挥镇痛作用,故预先穴位刺激可以有效减少中枢神经受到的伤害性刺激,避免中枢敏化。本次研究表明,与C组比较,A组、B组患者术后各时间段VAS评分均低于C组,舒芬太尼用量均明显少于C组,提示TEAS具有一定的镇痛效果。
关于TEAS时机选择,本次研究结果表明,B组患者各时间段CD3+、CD4+、NK细胞水平及CD4+/CD8+比值均高于A组,术后各时间段VAS评分、舒芬太尼用量均低于A组,胃肠功能恢复时间均短于A组,提示全程TEAS效果优于麻醉诱导前行TEAS。但两组间并发症发生率比较,差异无统计学意义(P>0.05)。马金孝等[23]指出,行开腹手术时间较长、创伤性大,无法迅速调节机体炎症反应,推荐术前1 d行TEAS预处理。本次研究行腹腔镜手术创伤较小,但患者年龄普遍较大,可能也存在无法迅速调节的情况,故笔者推荐后续研究中设置术前1 d TEAS组并扩大研究样本,保障研究结果的准确性。根据本次研究结果,笔者推荐全程行TEAS辅助麻醉。
综上所述,TEAS辅助麻醉可以有效调节腹腔镜直肠癌根治术患者免疫功能,促进患者胃肠功能恢复,减少腹腔镜直肠癌根治术患者术后疼痛程度与镇痛药用量。

