加味桃核承气汤治疗脓毒症胃肠功能障碍的临床研究*
申建国,陈 羽,王 健
(河北省沧州中西医结合医院,河北 沧州 061000)
脓毒症是由感染引起的全身炎症反应综合征,是导致危急重症患者死亡的重要原因,尤其是脓毒症休克患者,病死率高达50%[1]。脓毒症往往伴发胃肠功能障碍,表现为突然或逐渐出现严重腹胀、肠鸣音减弱等体征。肠道是脓毒症影响最早且最后恢复的器官,作为机体内最大的细菌和毒素贮存库,一旦因为任意因素导致肠黏膜完整性和屏障保护能力被打破,会导致肠内毒素或细菌向全身转移,打破内环境的稳定,引起全身不可控制的炎症反应,直接导致多器官功能障碍[2]。保护胃肠道屏障,恢复胃肠道功能能够阻止疾病向多器官功能障碍方向进展。脓毒症最常见的治疗药物是广谱抗菌药物,但长期、大量使用会出现细菌耐药性,导致肠道菌群紊乱和肠道屏障损伤。因此,笔者观察加味桃核承气汤对脓毒症胃肠功能障碍患者外周血细胞因子、血内毒素水平及肠道机械屏障修复的影响,探讨其可能的作用机制。现报告如下。
1 资料与方法
1.1 诊断标准
1.1.1 西医诊断标准(1)脓毒症诊断参照《中国脓毒症/脓毒症休克急诊治疗指南(2018)》[3]。①感染:患者感染或高度疑似感染,并具备以下临床特征。a.发热(体温>38.3℃或<36℃);b.心率>90次/min或超过该年龄段正常心率两个标准差;c.气促,呼吸频率>25次/min。②炎症反应:a.外周血白细胞计数(WBC)>12×109/L或<4×109/L;b.淋巴细胞计数减少;c.血浆C反应蛋白(CRP)、降钙素原(PCT)、内毒素(ET)和血清生物嘌呤大于正常两个标准差;d.高血糖症(血糖超过7.7 mmol/L)且无糖尿病病史。同时满足感染中2项和炎症反应中1项,加上序贯器官功能衰竭评分(SOFA)≥2分,即可确诊。
(2)胃肠功能障碍诊断参照欧洲重症医学会(ESICM)提出的急性胃肠功能损伤(AGI)分级诊断标准[4]。具备以下任一诊断依据即可确诊。①食物不耐受综合征(FI):肠内营养不耐受;②腹腔内高压:腹内压持续增高[6 h内连续2次腹内压≥12 mm Hg(1 mm Hg=0.133 kPa)];③腹泻、应激性溃疡出血、肠蠕动或肠鸣音减弱、呕吐、胃潴留等胃肠道相关症状。AGI分级诊断标准[5],Ⅰ级:胃肠道功能受损,存在衰竭危险;Ⅱ级:胃肠道已发生功能障碍,需要临床干预;Ⅲ级:胃肠功能衰竭,临床干预后仍无法恢复功能;Ⅳ级:胃肠功能衰竭且伴有其他脏器功能障碍或衰竭,危及生命。
1.1.2 中医诊断标准 参照《中药新药临床研究指导原则(试行)》[6]中血瘀证诊断标准,以及《脓毒症的定义、诊断标准、中医证候诊断要点及说明(草案)》[7]中腑气不通证诊断标准,拟定血瘀腑实证诊断标准。主症:腹胀,痞满,刺痛拒按;次症:神疲乏力,恶心呕吐,大便不通或黑便;舌脉:舌质暗红,苔黄腻,脉弦滑。具备主症和次症中2项,结合舌象、脉象即可诊断。
1.2 纳入标准(1)年龄18~80岁,患者知情同意;(2)符合脓毒症西医诊断标准,中医辨证为血瘀腑实证;(3)AGI分级Ⅱ、Ⅲ级。(4)治疗配合度良好,愿意接受中医治疗。
1.3 排除标准(1)合并原发性胃肠道疾病;(2)治疗48 h内死亡或出院;(3)合并恶性肿瘤、精神疾病或HIV感染;(4)合并病毒性肝炎或心肌梗死;(5)合并自身免疫性疾病或血液系统疾病;(6)妊娠或哺乳期患者;(7)过敏体质;(8)已确诊为多器官功能障碍综合征(MODS);(9)不具备膀胱压测量或肠内喂养条件。
1.4 研究对象 本研究获得河北省沧州中西医结合医院伦理委员会审查通过(2019074),将2017年1月至2018年12月期间在我院ICU接受治疗的114例脓毒症胃肠功能障碍患者随机分为治疗组与对照组各57例。
1.5 治疗方法
1.5.1 对照组 针对脓毒症患者进行抗感染和脏器功能支持等治疗措施,必要时呼吸机辅助通气。给予枸橼酸莫沙必利片(商品名:快力;鲁南贝特制药有限公司)促进胃肠动力,5 mg/次,3次/d,胃管注入。
1.5.2 治疗组 在对照组基础上给予加味桃核承气汤,方药组成:枳实15 g,桃仁(去皮、尖)10 g,制大黄10 g,白术10 g,芒硝6 g,炙甘草6 g,桂枝6 g。随证加减:气虚加党参10 g,阴虚加麦冬、石斛各10 g,阳虚加干姜、附子各6 g。汤剂由中药房统一煎制(加清水1 000 mL,头煎20 min,翻煎30 min至400 mL)和配送。1剂/d,分早晚2次胃管注入,200 mL/次。
两组疗程均为1周。
1.6 观察指标(1)治疗前后采集空腹静脉血5 mL,离心分离后低温保存待检;采用双抗夹心免疫化学发光法测定PCT和血清淀粉样蛋白A(SAA)水平,免疫散色比浊法测定CRP水平,酶联免疫吸附法测定D-乳酸、二胺氧化酶(DAO)和肠脂肪酸结合蛋白(I-FABP)水平,动态比浊法检测ET水平,所有步骤严格按照试剂盒说明书进行,试剂盒由武汉优尔生科技股份有限公司提供。(2)治疗前后分别采用间接膀胱压法测定腹内压(IAP)水平,首次测量后,2、4 h后复测,取3次测量结果平均值作为数据记录。(3)治疗前后分别采用急性生理学及慢性健康状况评分系统(APACHEⅡ)评价病情严重程度,序贯器官衰竭评分(SOFA)评价预后情况,胃肠功能障碍评分评价胃肠功能。(4)参考《中药新药临床研究指导原则(试行)》[6]对中医证候进行分级量化评分,证候按严重程度划分为重、中、轻、无4个级别,主症分别记6分、4分、2分和0分,次症分别记3分、2分、1分和0分,舌脉仅作观察,不纳入计分,所得之和为中医证候积分,计算中医证候积分评估中医证候改善情况。(5)记录28 d病死率和不良反应发生情况。
1.7 疗效标准[6]显效:体温、腹内压等指标基本恢复正常,胃肠功能障碍评分和中医证候积分减少≥70%;有效:体温、腹内压等指标明显改善,胃肠功能障碍评分和中医证候积分减少≥30%,<70%;无效:体温、腹内压等指标无明显改变,出现严重并发症,胃肠功能障碍评分和中医证候积分减少<30%。总有效率=[(显效例数+有效例数)/总例数]×100%。
1.8 统计学方法 采用SPSS 22.0统计软件分析,计量资料采用(±s)描述,计数资料采用例和率描述。计量资料比较采用t检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料 两组患者性别、年龄、病程和感染原因比较,差异均无统计学意义(P>0.05),具有可比性。(见表1)
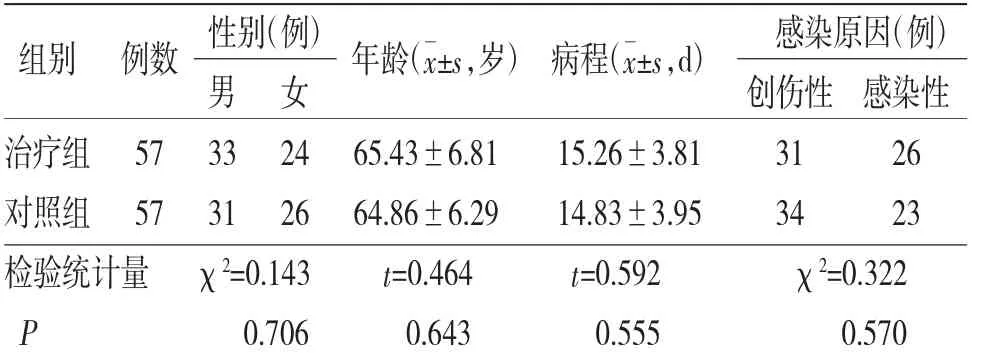
表1 两组患者基线资料比较
2.2 两组患者中医证候积分比较 治疗后两组患者中医证候积分低于治疗前(P<0.05),且治疗组患者治疗后中医证候积分低于对照组(P<0.05)。(见表2)
表2 两组患者中医证候积分比较(±s,分)
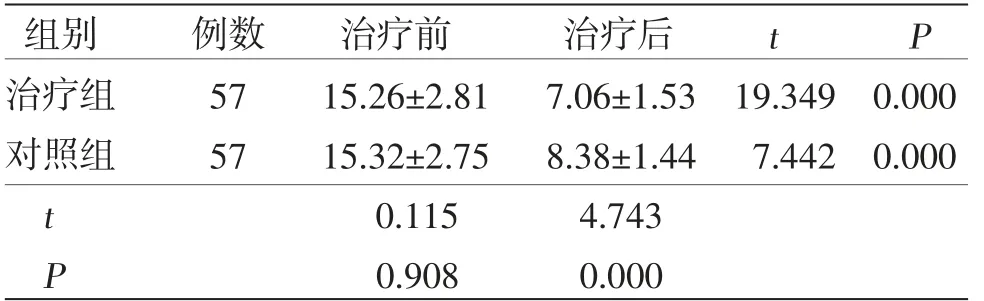
表2 两组患者中医证候积分比较(±s,分)
组别 例数 治疗前 治疗后 t P治疗组 57 15.26±2.81 7.06±1.53 19.349 0.000对照组 57 15.32±2.75 8.38±1.44 7.442 0.000 t 0.115 4.743 P 0.908 0.000
2.3 两组患者血清PCT、SAA、CRP水平比较 治疗后两组患者血清PCT、SAA、CRP均低于治疗前,且治疗组患者治疗后血清PCT、SAA、CRP水平均低于对照组(P<0.05)。(见表3)
表3 两组患者血清PCT、SAA、CRP水平比较(±s)
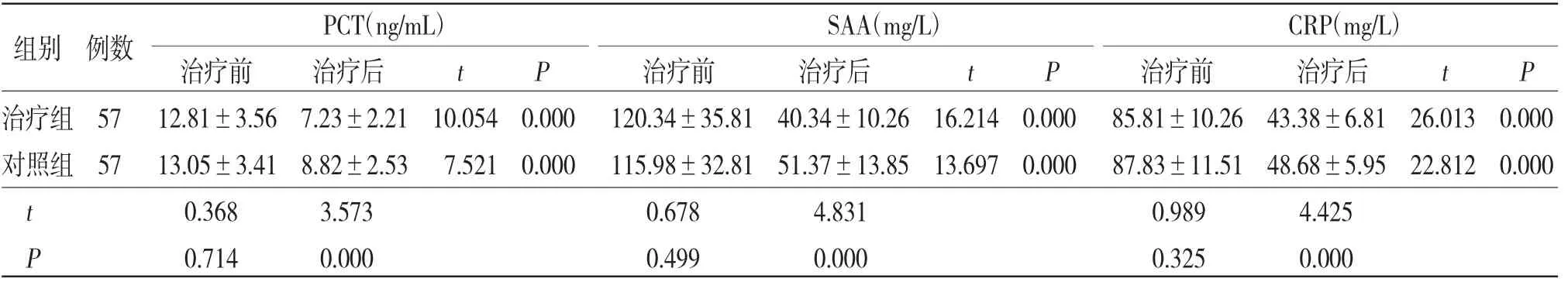
表3 两组患者血清PCT、SAA、CRP水平比较(±s)
PCT(ng/mL) SAA(mg/L) CRP(mg/L)治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P治疗组57 12.81±3.56 7.23±2.21 10.054 0.000 120.34±35.81 40.34±10.26 16.214 0.000 85.81±10.26 43.38±6.81 26.013 0.000对照组57 13.05±3.41 8.82±2.53 7.521 0.000 115.98±32.81 51.37±13.85 13.697 0.000 87.83±11.51 48.68±5.95 22.812 0.000 t 0.368 3.573 0.678 4.831 0.989 4.425 P 0.714 0.000 0.499 0.000 0.325 0.000组别 例数
2.4 两组患者IAP、APACHEⅡ评分、SOFA评分及胃肠功能障碍评分比较 治疗后两组患者IAP、APACHEⅡ评分、SOFA评分及胃肠功能障碍评分均低于治疗前,且治疗组患者治疗后上述指标均低于对照组(P<0.05)。(见表4)
表4 两组患者IAP、APACHEⅡ评分、SOFA评分及胃肠功能障碍评分比较(±s)

表4 两组患者IAP、APACHEⅡ评分、SOFA评分及胃肠功能障碍评分比较(±s)
IAP(mm Hg) APACHEⅡ评分(分) SOFA评分(分) 胃肠功能障碍评分(分)治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P治疗组57 13.87±1.02 9.42±0.85 25.304 0.000 17.64±3.51 11.32±2.21 11.504 0.000 8.41±1.85 4.12±1.13 14.941 0.000 2.02±0.54 0.98±0.21 13.552 0.000对照组57 14.12±1.13 10.34±0.97 19.163 0.000 18.02±3.24 13.05±2.46 9.224 0.000 8.28±1.87 4.88±1.20 11.553 0.000 2.10±0.56 1.20±0.32 10.535 0.000 t 1.240 5.386 0.606 3.950 0.373 3.481 0.776 4.340 P 0.218 0.000 0.549 0.000 0.708 0.000 0.439 0.000组别 例数
2.5 两组患者ET、D-乳酸、DAO、I-FABP水平比较 治疗后两组患者ET、D-乳酸、DAO、I-FABP水平均低于治疗前(P<0.05),且治疗组患者治疗后ET、D-乳酸、DAO、I-FABP水平均低于对照组(P<0.05)。(见表5)
表5 两组患者ET、D-乳酸、DAO、I-FABP水平比较(±s)
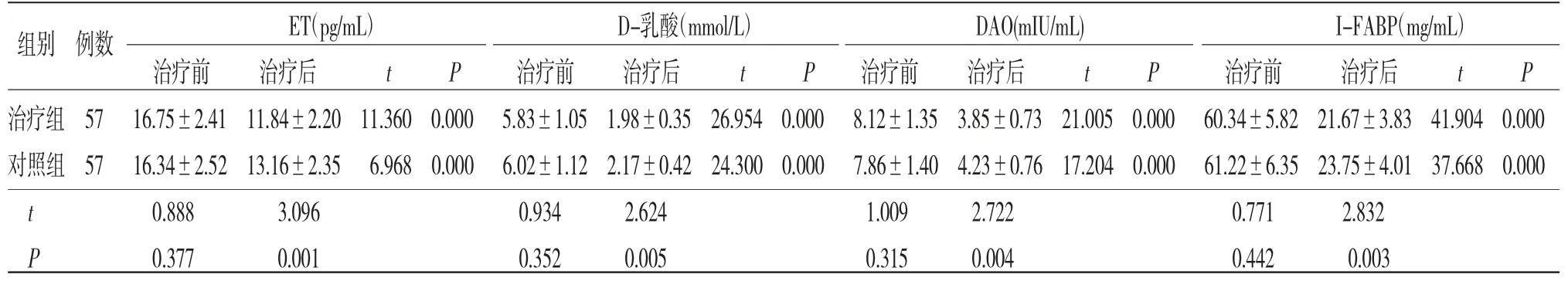
表5 两组患者ET、D-乳酸、DAO、I-FABP水平比较(±s)
ET(pg/mL) D-乳酸(mmol/L) DAO(mIU/mL) I-FABP(mg/mL)治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P 治疗前 治疗后 t P治疗组57 16.75±2.41 11.84±2.20 11.360 0.000 5.83±1.05 1.98±0.35 26.954 0.000 8.12±1.35 3.85±0.73 21.005 0.000 60.34±5.82 21.67±3.83 41.904 0.000对照组57 16.34±2.52 13.16±2.35 6.968 0.000 6.02±1.12 2.17±0.42 24.300 0.000 7.86±1.40 4.23±0.76 17.204 0.000 61.22±6.35 23.75±4.01 37.668 0.000 t 0.888 3.096 0.934 2.624 1.009 2.722 0.771 2.832 P 0.377 0.001 0.352 0.005 0.315 0.004 0.442 0.003组别 例数
2.6 两组患者临床疗效及28 d病死率比较 治疗组患者临床疗效优于对照组(P<0.05);两组28 d病死率比较,差异无统计学意义(P>0.05)。(见表6)
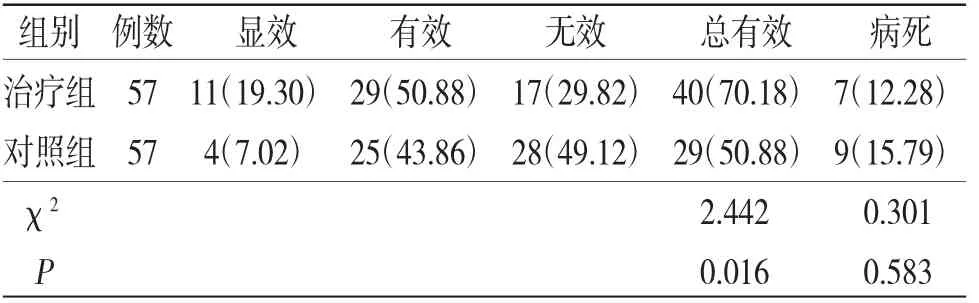
表6 两组患者临床疗效及28 d病死率比较[例(%)]
2.7 不良反应 两组治疗过程中均未见明显不良反应。
3 讨 论
脓毒症与胃肠道功能障碍互为因果,相互影响。脓毒症发生时肠道最易受损,损伤表现为肠黏膜机械屏障损伤、肠道菌群紊乱、胃肠道再灌注损伤等[8],导致胃肠功能障碍,免疫紊乱及炎症因子信号的表达,进一步加重疾病严重程度。一旦发生胃肠功能障碍,则细菌和内毒素易位,刺激大量细胞因子、炎症介质释放,造成机体器官损伤,诱发多器官功能障碍综合征[9]。因此,胃肠功能障碍防治是脓毒症防治的重点,而肠黏膜屏障功能的保护和修复是重中之重。正常情况下,保持完整的肠黏膜屏障功能才能维持机体健康。脓毒症发生后,不但缺氧、炎症反应等状态会影响肠黏膜屏障功能,而且药物的使用也会对其造成负担。郭久冰等[10]研究发现,脓毒症大鼠表现为肠黏膜及黏膜下组织坏死、崩解,上皮细胞凋亡,存在广泛的肠黏膜屏障损伤,血清D-乳酸和DAO水平异常高表达。
近年来中医在脓毒症胃肠功能障碍的治疗中显露出独特优势[11]。中医理论中,脓毒症属于“温病”“伤寒”等范畴,胃肠功能障碍属于“腹胀”“痞满”等范畴。肠道作为脓毒症的启动器官,受外邪侵袭后,糟粕搏结,腑气不通,正虚毒损,瘀滞络脉,肠道损伤之后又成为毒邪入侵之径[12]。肠道功能障碍病因为外感六淫之邪或疠气,加之情志内伤、久卧不动、药食损伤加剧病情,其病位在肠,与脾、胃、肝、胆等其他脏器亦有紧密的联系[13]。笔者在临床中发现脓毒症胃肠功能障碍患者具有“瘀水互结胃肠”的特点,因此以“活血利水,通腑消胀”之法为原则,采用加味桃核承气汤治疗。方中桃仁活血化瘀,大黄通腑泄热、逐瘀通经,二者瘀热并治为君药;芒硝润燥软坚,桂枝既助桃仁活血祛瘀,又可温经通脉,防大黄、芒硝性寒凝血之弊,共为臣药;桂枝与大黄、芒硝同用,相辅相成,桂枝得芒硝、大黄则温通而不助热,芒硝、大黄得桂枝则寒下又不凉遏;枳实破气消积,化痰散痞,白术益气健脾,炙甘草补脾和胃,缓诸药之峻烈以为佐使。全方共奏化瘀通络、消胀通腑之功。现代药理学研究证实,桃仁具有抗凝血、改善血流、抗炎、镇痛等作用[14]。大黄能促进大肠蠕动,防止ET易位,加快毒素排出,改善微循环,有效维持肠黏膜屏障功能,保护胃肠道功能[15]。枳实对消化道功能有促进作用,可促进胃肠自洁,拮抗溃疡,防止机械损伤[16]。多种药物合用能改善肠道缺血再灌注损伤,降低ET水平,促进肠道蠕动,下调炎症因子水平等,可以保护肠屏障和靶器官。
DAO广泛存在于动物肠黏膜、肝脏等组织中,人体中的DAO主要集中在小肠黏膜上皮细胞中。一旦肠黏膜损伤后,DAO会大量进入血液系统,在血液中异常高表达。D-乳酸是肠道细菌的代谢产物,基本上来源于肠道,无法在其他组织中分泌或代谢,是肠黏膜通透性变化指标[17]。因此,肠黏膜损伤后血液中D-乳酸水平亦会呈现异常高表达。二者在血液中含量的变化可以较好地反映肠道黏膜损伤程度和通透性的变化,能够反映肠道机械屏障损伤的程度。I-FABP是一种可溶于细胞质的小分子蛋白,在机体对脂肪酸的吸收中发挥作用,在小肠黏膜中具有特异性的表达[18]。I-FABP是肠黏膜上皮受损的标志。上述3个指标在肠黏膜屏障功能障碍预警和诊断中具有较好的敏感性和特异性。本次研究中,治疗后治疗组患者D-乳酸、DAO、I-FABP水平均低于对照组(P<0.05),提示加味桃核承气汤能够促进肠道机械屏障修复。
PCT是一种次级炎症因子,在脓毒症患者血清中呈现高表达。虽然PCT本身不直接参与启动脓毒症反应,但能够放大并加重病理过程,是脓毒症诊断的重要参考[19]。CRP在感染时会在血液中大量表达。邓佳等[20]研究显示,SAA水平可能与感染的严重程度有关,对脓毒症患者的诊断和预后评估有一定意义。本次研究结果表明,加味桃核承气汤能够抑制炎症因子的表达,促进胃肠功能恢复。过度活化的炎症反应会阻止Th1、Th2细胞的分泌,产生免疫抑制。本次研究中,治疗后治疗组患者PCT、SAA、CRP水平均低于对照组(P<0.05),提示加味桃核承气汤可能通过下调炎症因子水平,抑制炎症反应,保护肠黏膜屏障功能。
IAP是脓毒症诊断关键指标;APACHEⅡ和SOFA评分被广泛用于病情评估和预后预测,胃肠功能障碍评分是评价胃肠功能障碍改善情况的指标,中医证候积分是评价中医证候改善情况的指标。本研究结果显示,治疗后治疗组患者IAP、APACHEⅡ评分、SOFA评分、胃肠功能障碍评分、中医证候积分均低于对照组(P<0.05),且治疗组患者临床疗效优于对照组(P<0.05),证实加味桃核承气汤能够提高脓毒症胃肠功能障碍患者整体疗效。
本次研究中对所有患者进行28 d随访,发现两组患者28 d病死率比较,差异无统计学意义(P>0.05),并未体现出加味桃核承气汤治疗对患者生存和预后的有利影响。
综上所述,加味桃核承气汤能通过抑制外周血炎症因子、内毒素、D-乳酸、DAO、I-FABP的表达,修复肠道机械屏障,抑制炎症反应,提升脓毒症胃肠功能障碍患者整体疗效。但本次研究并未进行多中心大样本的临床研究,且随访时间短,无法评价远期疗效。

