“素养为本”的高中化学教学实践探索
余淞发 申燕 吴红平 徐亚婷

1(1深圳市盐港中学 广东 深圳 518083;2深圳市盐田区教育科学研究院 广东 深圳 518081)
摘要:以电解质冲剂为素材创设真实的教学情境链,推进课堂教学环节。学生在问题驱动中进行实验探究,自主归纳概念;通过构建宏观、微观、符号以及物质类别之间的关联,实现了知识关联和认知方式的结构化。基于学业质量标准解读素养目标,将目标落实于课堂环节中并实施评价反馈,以求实现“教、学、评”一体化。
关键词:素养为本;学科核心素养;电离;电解质
文章编号:1008-0546(2021)04-0042-06 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2021.04.012
《普通高中化学课程标准(2017年版)》[1](以下简称“新课标”)的颁布,标志着以学生学科核心素养发展为导向的高中化学课程改革开始了实践探索。如何开展“素养为本”的高中化学课堂教学是广大一线教师亟待研究和解决的问题。“新课标”凝练了化学学科核心素养,在课程基本理念中提出重视开展“素养为本”的教学,并具体指出“倡导真实问题情境的创设,开展以化学实验为主的多种探究活动,重视教学内容的结构化设计,激发学生学习化学的兴趣,促进学生学习方式的转变,培养他们的创新精神和实践能力”。“素养为本”的化学教学以真实情境为载体、以实验探究为手段、以内容的结构化为框架,并倡导基于学业质量标准评价学生学科核心素养的达成情况,从而实现“教、学、评”一体化。
“电解质的电离”是“新课标”中必修课程主题2“常见的无机物及其应用”中二级标题“电离与离子反应”的内容。本节课的知识承载着帮助学生建构“微粒观”的价值功能,学生在初中阶段已借助物质导电性实验,对溶液导电的原因有了粗浅的认识,即溶液中存在带电的粒子,并基于此了解酸、碱的概念及同类物质性质的相似性。本节课的教学能够促进学生原有认知的发展,为学生“微粒观”的形成奠定基础,为今后学生探究离子反应的实质、分析原电池与电解池的工作原理、认识水溶液中存在的离子平衡等形成有力支撑,也为学生“宏观辨识与微观探析”“变化观念与平衡思想”等学科核心素养的发展提供有力保障。
于是,笔者尝试基于“素养为本”的化学学科教学理念进行“电解质的电离”的教学设计。在教学过程中,以学生熟悉的生活中常见的电解质饮料固体冲剂(以下简称为“电解质冲剂”)为情境载体,设计学生探究实验活动,在任务和问题的驱动下,将电离的概念,常见酸、碱、盐的电离方程式的书写,酸、碱、盐的定义,电解质与非电解质的概念等知识点建立关联,既引导学生完成概念的建构,又确保内在知识的结构化。通过解决“新课标”中关于本节课的学科核心素养描述设定教学目标,将教学目标落实于教学环节中,并基于学科核心素养开展评价。在盐田区“素养为本”的教学实践研究中,该课例被评为优秀课例,现将教学过程整理成文,以期为读者提供有益参考。
二、教学过程设计
1.教学目标
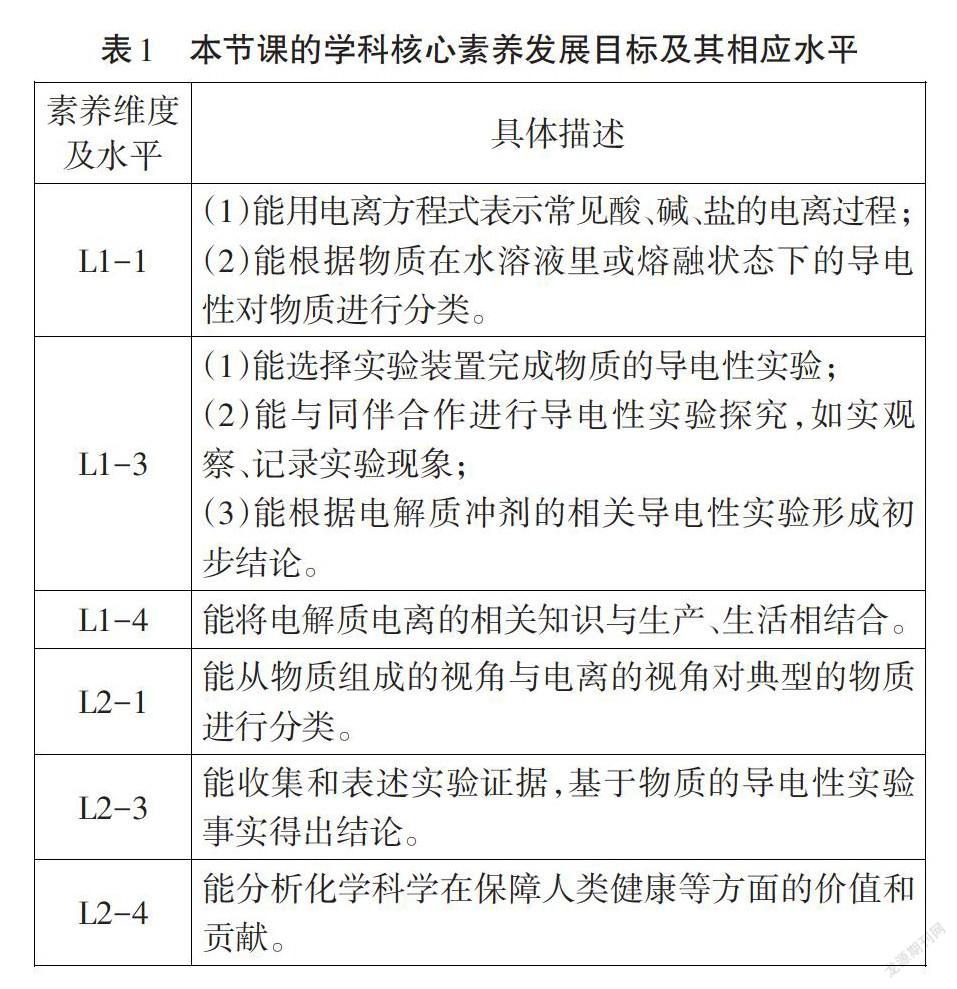
“新课标”提出的本节课的内容要求是“认识酸、碱、盐等电解质在水溶液中或熔融状态下能发生电离”,学业要求为‘能用电离方程式表示某些酸、碱、盐的电离”。结合“新课标”中的“学业质量标准”的具体内容,解读并抽练出本节课学生需发展的学科核心素养目标及其相应水平,具体见表1(其中L1、L2表示素养水平1和水平2;-1表示素养1或3,-3表示素养4,-4表示素养5)。
2.教学流程
本节课围绕学科核心素养目标的落实,设置了4个教学环节,每个环节都由与电解质冲剂相关的问题驱动,引导学生从“电解质冲剂中的‘电是否与导电相关”→“怎样用化学的语言表征电解质冲剂溶于水的变化”→“为什么叫电解质冲剂”→“电解质冲剂的功能是什么”进行探究,环节的设置由“宏观探究”→“微观表征”→“归纳关联”→“拓展应用”实现进阶(图1)。
3.具体过程
(1)环节一:情境探究,认识本质
【师】昨天,在大家上完体育课后,老师从体育老师那里寻到一件宝物。
(教师展示某牌电解质冲剂。)
【生】这是电解质饮料的冲剂。
【师】今天我们就以电解质冲剂为探究对象展开学习。电解质冲剂这个名字中有个“电”字,结合初中所学化学知识,大家能够想到的与“电”相关的实验有哪些?
【生1】电解水实验。
【生2】导电性实验。
【师】在初中,电解水实验验证了水的元素组成,导电性实验又让我们初步从微观粒子的角度认识了酸、碱、盐的分类。今天,我們利用导电性实验来探究电解质冲剂是否和导电有关,请同学们小组合作完成一组(电解质冲剂粉末、纯水、电解质冲剂溶液)导电性对比实验,并观察记录实验现象及其异同。
(学生分组完成实验,记录实验结果。)
【师】请同学们分享你们的实验结果(图2)。
【生1】我们小组发现只有电解质冲剂溶液能够导
【生2】我们小组除了发现测量电解质冲剂溶液时指针明显偏转;测试水时,电流表的指针也有略微的偏转;但是测定电解质冲剂粉末时,指针并未偏转。
【师】同学们观察得非常仔细,此次实验提供给大家的电流表为灵敏电流表,那么相对于电解质冲剂溶液的导电性,水可视为几乎不导电。而电解质冲剂溶液能够导电,请大家回忆:初中所学的溶液导电的原因是什么?
【生】溶液中存在带电的粒子。
【师】实际上,溶液中的带电粒子是什么呢?
【生】阴、阳离子。
【师】结合上述分析,为什么电解质冲剂粉末不导电,水几乎不导电,但两者混合后所得溶液能够导电呢?
【生】电解质冲剂粉末中不含离子,水中的离子较少,但溶液中却含有较多离子。
(教师展示电解质冲剂粉末的配料,为NaCl、KCl、MgSO4等物质。)
【师】了解了电解质冲剂粉末的配料之后,对于刚才的结论,同学们有没有质疑或补充?
【生】电解质冲剂粉末中有NaCl等物质,NaCl中存在Na+和Cl-,因此电解质冲剂粉末中也是存在离子的。
【师】电解质冲剂粉末和电解质冲剂溶液中都存在离子,那为什么前者不导电,后者导电呢?请同学们再来回顾金属的导电原理。
【生】金属中有大量自由电子,它们可以自由运动且方向杂乱无章,但接上电源后,这些电子就做定向移动,从而形成电流。
【生】这就是说电解质冲剂粉末中的离子是不能自由移动的,而电解质冲剂溶液中的离子是能够自由移动的,这样自由移动的离子才能在电场作用下定向移动,从而导电。
【师】是什么促使了電解质冲剂粉末中,原本不能自由移动的离子变得能够自由移动了呢?
【生】水。
【师】水又是怎样促使离子自由移动的?
(教师播放NaCl固体溶于水的微观动画。)
【生】NaCl固体中的Na+和Cl-存在较强的相互作用,当NaCl固体溶于水后,水分子破坏了这种相互作用,将离子分别“带走”,使得Na+和Cl-变得能够自由移动。
【师】除了这种方式可以破坏Na+和Cl-的相互作用之外,是否还有其它方式?
(教师播放熔融NaCl的导电实验视频。)
【师】在刚才的实验中,同学们观察到了什么现象?
【生】在加热至熔融之前,NaCl固体并不导电,但熔融后的NaCI却能够导电。
【师】这个实验现象说明了什么?
【生】熔融后的NaCl中也存在自由移动的Na+和Cl-。
【生】这就说明加热至熔融状态,也可以破坏Na+和Cl-之间的相互作用。
【师】像NaCl这样的物质,解离为自由移动的Na+和Cl-的过程,我们称为电离。请同学们根据电离发生的条件,将此概念补充完整。
【生】像NaCl这样的物质,溶于水或受热融化时,解离为自由移动的离子的过程叫电离。
【师】在刚才的实验过程中,我们都对物质进行了通电,那么电离是否需要通电的条件下才能发生呢?请同学们在刚才的实验中找到证据说明理由。
【生1】刚才的实验都在通电的情况下完成,电离是需要通电的。
【生2】但是在进行电解质冲剂粉末导电性实验时,也是在通电的情况下进行,该粉末并不能导电,也就是说此时其中的物质并没有发生电离。
【生3】我同意这个观点,通电并不是物质发生电离的条件,因为未熔融的NaCl也是不能导电的,这就说明即使通电,NaCl也没有电离。
【师】同学们能够从对比实验中准确地找到支持我们结论的证据。事实上科学家也为此问题曾争论了很多年,起初化学界的主流观点为通电后才产生离子,后来化学家阿伦尼乌斯通过研究电解质稀溶液的导电性,提出了电离模型,即电解质溶于水后会自动地解离成离子,并对电解质的电离进行了定量计算。电离模型很好地解释了酸、碱、盐的某些性质,因此逐渐被认可,阿伦尼乌斯也因此获得1903年诺贝尔化学奖。科学概念、理论的形成是一个不断思辨、证实与证伪的过程。因此,同学们可以根据自己的思考提出大胆的质疑,也许下一个诺贝尔奖得主就是你。
(教师呈现电解质饮料的成分图片,见图3)
【师】现在我们是不是就能理解图中电解质饮料
【生】电解质冲剂粉末溶于后,那些物质就自发解离为离子。
(2)环节二:符号表征,明确分类
【师】化学学科有其专属语言。那么,我们如何用化学语言表示电解质冲剂粉末中NaCl、KCl、MgSO4的电离过程?
(学生根据自己的理解书写电离过程的方程式,教师巡视。)
【师】同学们在书写方程式时是如何配平的呢?
【生】根据质量守恒定律,利用观察法即可配平。
【师】像这样的表示物质电离的方程式叫做电离方程式。请同学们仔细观察电离方程式有哪些特点?
【生】电离方程式等号右边是离子,跟我们以前学的方程式不一样。
【师】既然有离子,离子是带电荷的微粒。那请同学们再观察,方程式左右两边物质所带电荷的关系是怎样的?
【生】是相等的,以MgSO4的电离为例,电离方程式左边MgSO4是化合物,所带电荷为O;右边一个Mg2+带两个单位正电荷,一个SO42-带两个单位负电荷,因此,右边的总电荷数也为Oo
【师】也就是说,我们在书写电离方程式时,除需考虑质量守恒,还需注意电荷守恒。请同学们书写下列物质[Ba(OH)2、Cu(NO3)2、HCl、KOH、HNO3、NH4Cl、NaHSO4、NaOH、H2SO4、Cu2(OH)2CO3]的电离方程式。
(学生书写电离方程式,相互批改,教师讲解典型问题。)
【师】同学们刚才书写的电离方程式所涉及的物质涵盖了酸、碱、盐3类物质,根据书写的电离方程式,同学们能不能从微观粒子的角度再次认识酸、碱、盐呢?
【生】酸在电离时都有H+产生,碱在电离时都有OH-产生。
【师】这样的描述是否严谨呢?
【生1】NaHSO4电离时也会产生H+。
【生2】盐类物质的电离有时也会产生OH-或H+。
【师】请同学们再次仔细观察酸、碱以及电离能产生OH-或H+的盐的区别。
【生】酸在电离时,产生的阳离子全部是H+,碱在电离时,产生的阴离子全部是OH-。而部分盐电离时,阳离子部分是H+,或者阴离子部分是OH-。
【师】这就是我们从电离的角度对酸、碱、盐进行的概括和分类。
(3)环节三:辨别明晰,归纳概念
【师】我们了解了电解质冲剂粉末在水中发生了电离,其水溶液能够导电,但是“电解质”是一个固有名词,那到底什么是电解质呢?下面,我们通过分析电解质冲剂粉末中所含物质的特点(表2),尝试归纳出电解质的概念。
【生】溶于水能导电,且在熔融状态下也能导电的物质。
【师】那这一组物质(表3)应该称作什么?
【生】非电解质。
【师】请大家尝试总结非电解质的概念。
【生】溶于水和熔融状态下都不导电的物质。
【师】同学们刚才已经初步概括出电解质和非电解质的概念,那我们所归纳出的概念是否完善?请同学们再来分析一组信息(表4)。
【生1】H2SO4和BaSO4并不是在两种状态下都导电,但它们也是电解质。
【生2】满足一种条件下能导电就可以了,是“或”的关系,不是“且”的关系。
【生3】所以,电解质的概念应该是溶于水能导电,或者在熔融状态下能导电的物质。
【师】同学们已经进一步完善了对电解质概念的认识,我们再来分析(表5),为什么这些物质可以导电,却既不是电解质也不是非电解质呢?同学们可以尝试从初中所学的物质的分类的角度进行分析。
【生1】物质分为纯净物和混合物,纯净物又分为单质和化合物。
【生2】最开始老师呈现的电解质、非电解质的物质都是化合物。
【生3】Fe是单质,H2SO4溶液是混合物。
【师】我们接着再完善电解质和非电解质的概念。
【生】在水溶液里或熔融状态能导电的化合物,称为电解质;在水溶液里和熔融状态下都不能导电的化合物,称为非电解质。
【师】那我们就可以在初中所学分类的基础上,进一步将化合物分为电解质和非电解质。分类依据是什么?
【师】水溶液或在熔融状态下能否导电。
(4)环节四:回扣主题,拓展应用
【师】请大家结合今天的学习,谈谈对电解质冲剂的认识。
【生】电解质冲剂含有电解质,如NaCl、KCl、MgSO4这些物质,所以称为电解质冲剂或电解质饮料等。这些电解质在水中发生电离,自发解离为离子,进入人体后,就能很快补充人体运动过程中大量出汗所引起的离子缺失。
【师】那么电解质在生活中还有哪些应用呢?
【生1】植物水培用的营养液就含有电解质。
【生2】我之前在网上看到电池中也含有电解质。
【师】人手出汗了不能接触电源以防止触电,这些都是生活中有关电解质的例子。大家要善于观察、勤于思考,用我们学过的知识来解决(或解释)生活中的问题。只要留心观察,生活处处是化学。
三、教学成效反馈
化学学科核心素养的培育,不仅需要精心设计教学活动以转变学习方式、发展学生思维,而且还要有效开展学习评价以诊断、促进学生核心素养的达成与发展[2]。评价的主体、内容、方式等多种多样,本文根据评价主体的不同,将本节课的教学评价分为教师点评、学生互评及学生自评,每種评价涉及到的内容与方式详见下文。
1.教师点评
教师是学业评价的主要承担者和责任人[3]。本节课的教师点评主要体现为:当学生能合理分析并回答问题或表达出有价值的观点时,教师予以肯定或鼓励;当学生考虑不周时,教师能根据学生的回答来引导其进一步思考(譬如,在学习酸、碱、盐的定义时,学生一开始认为“酸在电离时都有H+产生,碱在电离时都有OH-产生”,教师需要引导学生分析该说法的不严谨之处,从而得出更合理的定义)。
2.学生互评
学生之间互相评价可以增强学业评价的客观性和可靠性。本节课学生以小组为单位进行问题讨论与实验探究,学生在这个过程中的一系列交流均涉及对彼此的评价(譬如,某位同学操作不当,其他同学发现后会提醒或指正)。此外,在书写电离方程式时,同伴之间互相批改,既保证结果能如实反映出学生的水平,又使得学生在批改的过程中更加认真严谨。
3.学生自评
(1)自评方式
学生个体对自身学习现状的分析、判断和反思是学业评价的重要基础。本节课采用学生填写教学调查问卷的形式了解教学效果,并使学生通过自我评价提升对学科核心素养的认识。该问卷由“素养目标达成情况”和“课堂教学满意情况[4]”两个维度组成,学生完成相应的题目即可形成反馈。采用李克特式5点量表计分法,“完全不同意”记为1,以此类推,“完全同意”记为5。笔者在3个平行班中开展本节课的教学,累计发放并回收125份量表式问卷,其中有效问卷数目为121份。
(2)结果反馈
采用SPSS 24.0统计软件对问卷的数据做探索性因子分析,结果显示两个相互独立的因子分别解释了总方差的44%与26%,它们共同解释了总方差的70%,即该量表的2维度结构得到数据支持。此外,所有题目的因子负荷值均高于0.50,且两个因子的Cron-bach a值分别为0.95与0.86,以上结果共同说明该问卷具有较好的信效度。
如表6所示,学生在“素养目标达成情况”维度的整体得分均值为4.51,说明学生的素养水平尚可。其中1-6题、7-9题分别对应“学业质量标准”中的水平1、水平2,随素养水平的进阶,学生的均分由4.56降为4.43,这与“素养水平越高,其相应的学习任务要求就越高”是一致的,能够真实反映学生的实际情况。
从学科核心素养的不同方面来看,题目1、2、7(均分为4.53)对应了素养1与素养3,题目3、4、5、8(均分4.54)对应了素养4,题目6、9(均分为4.43)对应了素养5。由此可见,学生对“宏观辨识与微观探析”“证据推理与模型认识”“科学探究与创新精神”这3方面素养发展较为理想,而在“科学态度与社会责任”素养方面的发展略显薄弱。这就需要教师在今后的教学中更加关注学生学科观念的建构与发展、科学精神与态度的培养以及社会责任意识的提升,如利用科技前沿中的研究报道、社会性重大议题、科学家的感人事迹等创设真实教学情境,充分发挥其教育价值,让学生的科学精神、责任意识通过不断渗透而内化于心、外显于行。
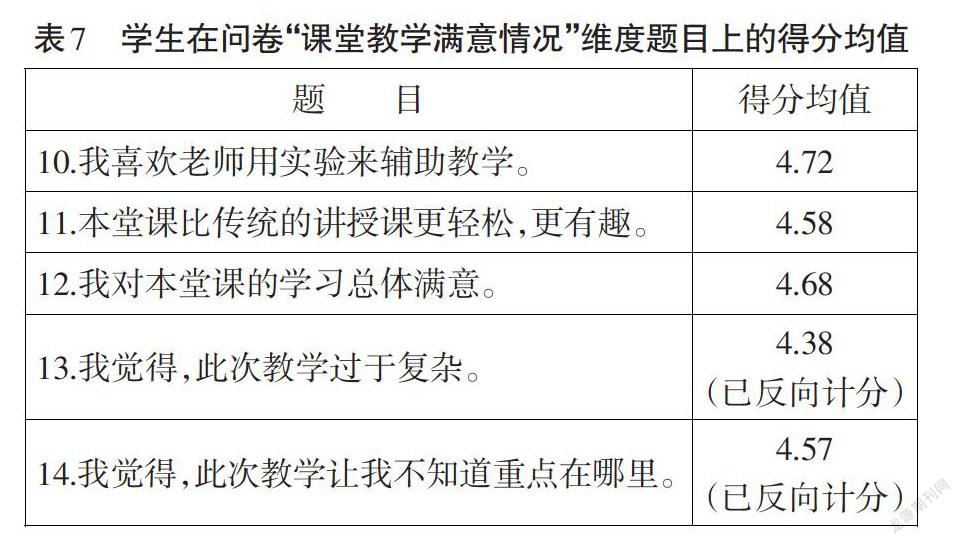
如表7所示,学生在“课堂教学满意情况”维度的平均得分为4.59,说明学生对本堂课的教学较为满意。然而有少部分学生认为本节课的教学存在一定的复杂性(均值为4.38),这就表明一部分学生已习惯依照教师预设推理、教材呈现知识得出结论的学习方式,对于通过实验探究,由实验事实证据推理得出结论、建构相关概念的学习方式接受较为迟缓;在今后的教学中,教师需加强“素养为本”的教学实践探索,逐步引导学生适应新课改背景下的角色转变。
四、总结与反思
1.创建真实情境,关联知识与应用
真实情境是“素养为本”的教学与评价的必备要素[5]。生活情境的创设,有利于增加学生的亲切感、探究欲望,也让学生能够准确了解知识如何应用,生活中的现象如何解释,问题如何解决等。在本节课中,电解质冲剂这个真实的生活情境调动了学生的学习积极性,每个环节都由与电解质冲剂相关的问题驱动,有效地引导学生将化学知识应用到生产生活中。
2.合理安排内容,促使知识结构化
在2019版的高中化学新教材中,不同版本的教材对“电离”“电解质”两部分内容编排的先后顺序是不同的,这就需要教师根据创设的情境、课堂内容的推进以及学生思维逻辑的发展予以灵活处理。在本节课中,学生对电解质冲剂导电性实验的宏观现象、导电原因的微观解释与符号表征形成了整体性认识,并在此基础上探讨物质的所属类别,让本節课的核心概念悄然有序地融为一体,既保证了知识关联的结构化,又达成了认识思路的结构化。
3.设计多维评价,真实反馈教与学
为确保教学评价的公正和合理,基于化学学科核心素养的教学评价,应从不同维度全面收集学生在评价任务中的真实表现。本节课中除开展教师点评、学生互评等常规过程性评价之外,还基于“新课标”中的学业质量标准开发学科核心素养维度的评价量表,通过学生自评了解学生的素养发展水平,以检测教学目标的达成情况,并在如何改进和完善教学过程以及今后教学应重点关注的问题等方面为教师提供了参考依据。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017版)[S].北京:人民教育出版社,2018
[2]杨梓生,吴菊华.“素养发展为本”的学习评价设计——以“离子反应”为例[J].中学化学教学参考,2017(6):20-22
[3]普通高中化学课程标准修订组.普通高中化学课程标准(2017年版)解读[M].北京:高等教育出版社,2018
[4]申燕,杨显江,李迪.在实验探究中发展化学核心素养和关键能力——以“金属的化学性质”为例[J].化学教学,2019(2):46-50
[5]孙敏.基于真实情境开展化学学科核心素养为本的教学案例[J].化学教育(中英文),2019(11):41-47
*本文系教育科学2019年度规划课题《“素养为本”的高中化学必修课程教学设计案例研究》(课题编号:ybzz19107)的阶段性研究成果之一。
**通讯联系人,E-mail:515651894@qq.com

