连续施用生物炭对花生不同生育时期叶绿素荧光特性的影响
顾博文,杨劲峰,鲁晓玲,吴怡慧,李娜,刘宁,安宁,韩晓日
连续施用生物炭对花生不同生育时期叶绿素荧光特性的影响
顾博文1,杨劲峰1,鲁晓玲2,吴怡慧1,李娜1,刘宁1,安宁1,韩晓日1
1沈阳农业大学土地与环境学院/土壤肥料资源高效利用国家工程实验室/农业农村部东北玉米营养与施肥科学观测实验站,沈阳 110866;2山东大学海洋学院,山东威海 264209
【】通过测定花生不同生育时期功能叶片的叶绿素荧光特性,探讨连续9年施用不同用量生物炭对花生叶片光系统Ⅱ的电子传递、光能吸收和氧化还原性能影响规律,同时观测叶片放氧复合体(OEC)受损程度变化趋势,为指导花生施肥提供理论支撑。于2011年建立的田间定位试验,设3个处理:CK(不施肥);C15(生物炭225 kg·hm-2);C50(生物炭750 kg·hm-2)。2019年分别采集不同生育时期花生功能叶,利用M-PEA-2仪器测定暗处理后的叶片光合指标。通过分析不同生育时期花生功能叶叶绿素荧光参数发现,连续施用不同用量生物炭对快速叶绿素荧光动力学曲线(OJIP曲线)有显著影响。C15处理的K点的相对可变荧光强度差(ΔVT)在花生苗期和开花下针期分别为-0.002和-0.020,在结荚期和成熟期分别为-0.024和-0.053,与CK处理相比花生各生育时期功能叶K点的相对可变荧光强度显著降低;随着生物炭用量的增加,开花下针期与成熟期K点降低幅度有不同程度增大。花生功能叶叶绿素荧光参数在开花下针期和成熟期对生物炭的连续施用有积极响应,其具体表现为:在开花下针期,与CK处理相比C15处理的J点相对可变荧光强度(VJ)降低23.9%,初级醌受体(QA)被还原速率(MO)降低32.1%,捕获的激电子将电子传递到电子传递链中QA下游的其他电子受体的速率(ΨO)增加25.0%,以吸收光能为基础的光化学性能指数(PIABS)增加154.6%。缓解了花生功能叶片的放氧复合体(OEC)受损程度,提高电子由初级醌受体(QA)向电子传递链下游的其他电子受体传递的能力,随着生物炭用量的增加,效果越明显。在成熟期,施用不同量生物炭对花生叶片叶绿素荧光特性指标的影响与开花下针期基本一致,具体表现为:C15处理较CK处理J点相对可变荧光强度(VJ)和初级醌受体(QA)被还原速率(MO)显著降低,分别减少12.5%和16.0%,捕获的激电子将电子传递到电子传递链中QA下游的其他电子受体的速率(ΨO)增加7.8%,以吸收光能为基础的光化学性能指数(PIABS)增加73.7%;C50处理与CK处理相比J点相对可变荧光强度(VJ)减少13.2%,初级醌受体(QA)被还原速率(MO)减少19.4%,捕获的激电子将电子传递到电子传递链中QA游的其他电子受体的速率(ΨO)增加8.2%,以吸收光能为基础的光化学性能指数(PIABS)增加79.7%。连续施用生物炭能显著提高花生功能叶片在开花下针期和成熟期光系统Ⅱ电子传递效率,缓解OEC损伤程度,从而提高花生功能叶的光合性能。
生物炭;花生;叶绿素荧光;快速叶绿素荧光动力学曲线
0 引言
【研究意义】花生是我国重要的油料作物和经济作物之一,是国民经济发展和维护国家粮食安全的重要保障[1]。叶片的光合作用是植物进行物质积累的重要过程[2],是影响花生产量的关键因素之一。在自然条件下,叶绿素荧光和光合作用之间有着十分密切的联系,能在降低强光伤害的同时,通过与光合速率之间存在相互负联系反映光合速率的大小[3]。施用生物炭能够显著提高花生产量[4],明确生物炭对花生光合性能影响的作用机理至关重要。【前人研究进展】快速叶绿素荧光诱导动力学是研究光合原初反应的无损伤探针,能够在反映PSII的原初光化学反应和光合机构状态的变化的同时敏锐地反应环境变化对于植物生理的影响,并且能够应用于多个研究方面[5]。如化学条件(除草剂、化肥等)对植物的影响,赵丽娟等[6]的研究表明土壤中有氯吡嘧磺隆残留时红芸豆幼苗叶片中的QA、QB和质体醌之间的电子传递会受到阻碍,光合系统Ⅱ(PSⅡ)活性被抑制,PIABS可以灵敏地反映植物叶片受到氯吡嘧磺隆胁迫下的损伤程度。KALTRINA等[7]的研究表明,在土壤氮含量较低时相同物种之间会出现营养胁迫现象,具体表现为初级醌受体(QA)快速减少,光系统II(PSII)供体位点的能力降低和以吸收光能为基础的性能指数(PIABS)降低。尹赜鹏等[8]研究表明盐胁迫会导致PSII电子供体侧放氧复合体(OEC)的活性降低及PSII电子受体侧电子由初级醌受体QA向次级醌受体QB的传递过程受阻。在环境物理因素方面,强光会造成植物叶片光系统功能的抑制[9],如秦立琴等[1]在研究强光高温胁迫(HH)和干旱高温胁迫(DH)对花生光合作用影响时发现,PSII反应中心的受体侧更容易受到高温和干旱的影响。水分状况对光合系统也有影响,如长期淹水胁迫会导致紫丁香幼苗有活性PSⅡ反应中心数量降低,叶片PSⅡ电子受体侧由QA向QB的传递受阻,QA被过度还原,QA-大量积累,导致紫丁香幼苗叶片PS Ⅱ发生明显的光抑制[10]。生物炭是农林废弃物等有机材料在缺氧或低氧环境中经热裂解产生的固体产物[11],其表面含有羧基、羟基和芳香环等官能团[12-13],具有自身容重小、孔隙多、比表面积大、呈碱性和高CEC等特性[14-15]。研究表明[16-17]生物炭能从多方面改良土壤性状,因生物炭自身特性,当生物炭施入土壤后能达到疏松土壤、降低土壤板结程度的效果,促进作物生长等。研究表明添加80 g·kg-1生物炭能有效提高海棠的株高、鲜重和光合参数。施用高量生物炭能促进小麦群体叶面积指数增大[18-19]。JEFFERY等[20]的研究也表明在土壤中施用生物炭能提高作物产量,且增幅可达10%。作物产量的提高,光合作用是关键的促进因子。【本研究切入点】目前关于生物炭在农业上的研究多集中在研究其对土壤性质的影响,植物生长的响应等方面,而其对植物光合特性的影响研究比较罕见。课题组在前期的研究中发现[21],施用生物炭可以引起花生开花下针期叶片叶绿素荧光诱导曲线显著变化,提高电子传递和光能吸收效率,进而促进光合作用。但对于是否会对花生整个生育时期叶片光合效率产生影响,施用的年限长短是否会持续产生正效应或负效应均不是十分清楚。【拟解决的关键问题】本研究利用大田长期定位试验,研究了连续9年施用不同用量生物炭后,花生在主要生育时期叶片光合效率的变化规律,为生物炭及其衍生产品在抵抗外界环境胁迫、促进光合性能提升等方面提供理论依据。
1 材料与方法
1.1 试验区概况
田间试验位于沈阳农业大学肥料长期定位试验科研基地(123°33′ E,40°48′N)。该基地地处松辽平原南部中心地带,属于温带湿润-半湿润季风气候,年均气温为7.0—8.1℃,10℃以上积温3 300—3 400℃,无霜期为148—180 d,生长季平均降雨量为547 mm;试验地为旱地棕壤,属于发育在第四纪黄土性母质上的简育湿润淋溶土[21]。
1.2 试验设计
长期定位试验始建于2011年,采用一年一熟花生连作的种植制度,2011—2014年品种为花育33,2015—2016年品种为阜花12号150GY,2017—2019年品种为岛222-1。种植密度均为15 万穴/hm2,每穴种植2株。试验设3个处理:CK(不施肥)、C15(生物炭225 kg·hm-2)、C50(生物炭750 kg·hm-2)。生物炭作基肥一次施入,施入深度为15—20 cm,覆土。每个处理重复3次,小区面积 27 m2,随机排列。生物炭(C 33.3%、N 0.3%、P2O50.2%、K2O 2.4%)的制备:采用玉米芯为主要原料,在450℃裂解并通过80—100目筛子后造粒。
1.3 样本采集
植物样本于2019年花生不同生育时期(苗期、开花下针期、结荚期、成熟期)采集,每个小区随机选取5片花生功能叶(最新完全展开叶片),放入自封袋,保存于0℃冰盒中迅速带回实验室。所有叶片依次采用叶片夹夹住叶片中部,进行30 min暗适应,然后采用M-PEA-2型植物效率仪(Hansatech,英国)进行测定。
1.4 测定项目与方法
1.4.1 快速叶绿素荧光诱导动力学曲线的测定 采集的叶片先暗适应30 min,然后应用连续激发式荧光仪M-PEA-2(Hansatech,英国)测定叶片快速叶绿素荧光诱导动力学曲线(OJIP曲线)。OJIP曲线由3 000 μmo1·m-2·s-1的脉冲光诱导,荧光信号仪记录是从10 μs开始,至1 s结束,记录的初始速率为每秒钟118个数据。
1.4.2 JIP-test分析 根据王帅等[22]和李鹏民[23]的方法,对获得的OJIP荧光诱导曲线进行分析。分析时需明确OJIP曲线上的K点相对可变荧光强度差ΔVt,J点的相对可变荧光VJ;QA被还原速率MO;捕获的激电子将电子传递到电子传递链中QA下游的其他电子受体的速率Ψo;以吸收光能为基础的光化学性能指数PIABS等。
1.5 统计分析方法
试验数据采用Microsoft Excel 2010处理,SPSS19.0软件进行单因素方差分析和邓肯检验(<0.05)。
2 结果
2.1 不同处理对OJIP曲线的影响
图1是以不施肥的CK处理OJIP曲线为参照,将C15和C50处理的OJIP曲线标准化后得到的花生功能叶片在不同生育时期的相对可变荧光强度差(ΔVt)曲线。如图所示,C15处理的K点的相对可变荧光强度差(ΔVt)在各生育时期分别为-0.002、-0.020、-0.024和-0.053,表明施用少量生物炭能降低K点相对可变荧光强度。当增加生物炭的用量时(C50处理),开花下针期(图1-b)和成熟期(图1-d)K点相对可变荧光强度持续降低,K点相对可变荧光强度差为-0.021和-0.071,与同时期的C15处理相比K点下降幅度增加了5%和34.0%。但在苗期(图1-a)和结荚期(图1-c),K点的ΔVt分别为0.013和0.026,表明增施生物炭(C50处理)使K点相对可变荧光强度值增加。

图1 施用不同量生物炭不同生育时期的花生功能叶片相对可变荧光强度差(ΔVt)曲线(a.苗期;b.开花下针期;c.结荚期;d.成熟期)
2.2 不同施肥处理对花生功能叶VJ的影响
VJ反映了2 ms时有活性的反应中心的关闭程度,其大小变化能够反映电子传递体QA的被还原量,即QA-的积累程度,是衡量OEC受损程度的指标之一[24]。如图2所示,在花生苗期与结荚期,施用不同量的生物炭对花生功能叶片的VJ值均无显著影响。在开花下针期,C15处理的VJ值远低于CK处理,降低幅度达23.9%,随着生物炭用量的增加,C50处理的VJ值继续降低,与CK相比降低了26.9%,但与C15相比二者差异不显著。进入成熟期后,施用低量生物炭的花生叶片的VJ值显著降低,与CK相比减少12.5%,当采用高量生物炭投入时,C50的VJ值与CK处理相比降低了13.2%,C50和C15相比,VJ降低的幅度增大,但二者无显著差异。
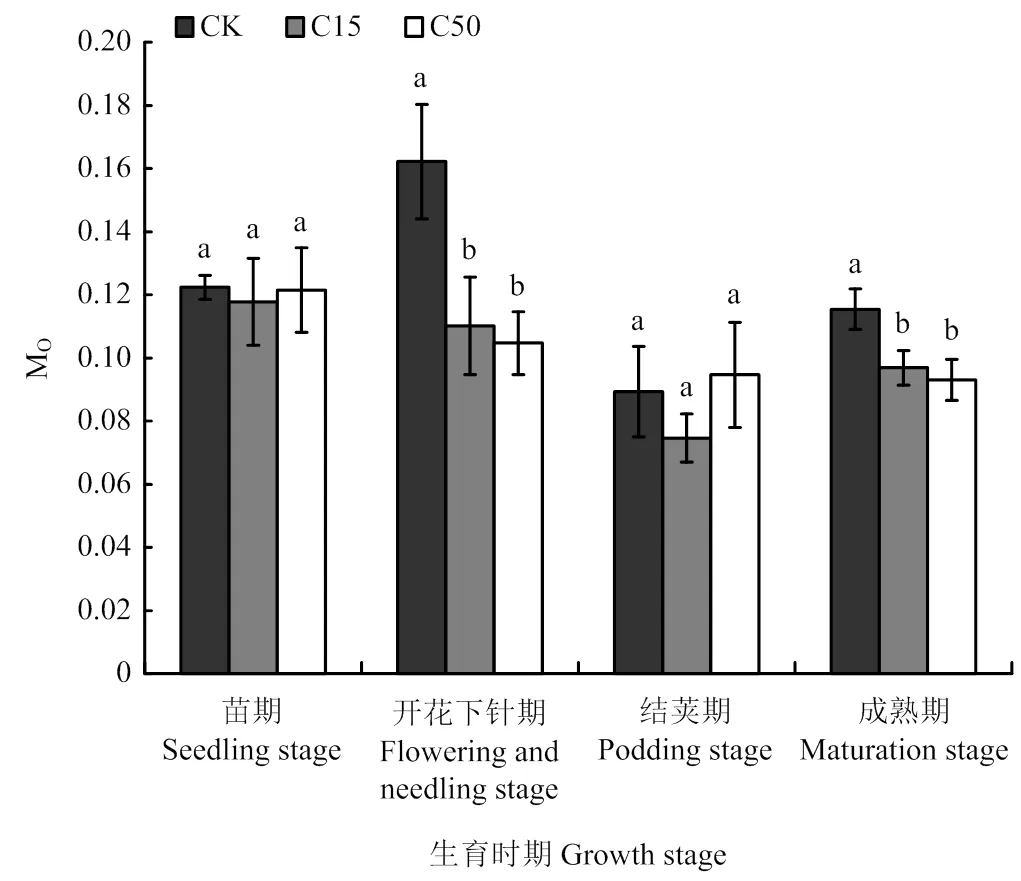
2.3 不同处理对花生功能叶片MO的影响
MO为相对荧光的曲线的原初斜率,即O-J过程中QA被还原的速率,它与反应中心色素、捕光色素和QA所处的状态有关,反映QA被还原的相对速率[23]。如图3所示,在花生苗期和结荚期施用不同量的生物炭对花生叶片的MO值没有显著影响。在开花下针期和成熟期,不同生物炭用量的花生功能叶片的MO值与CK相比均有降低,施用低量生物炭的C15处理的Mo值与CK相比在两个生育时期分别降低了32.1%和16.0%,施用生物炭量较高的C50的Mo值与CK相比分别降低了35.4%和19.4%,C50与C15处理相比Mo值降低的幅度增加,但两种处理间无明显的差异。

不同字母表示差异显著(P<0.05)
不同字母表示差异显著(P<0.05)
2.4 不同处理对花生功能叶PIABS的影响
PIABS是以吸收光能为基础的性能指数,是反映PSⅡ光化学效率的重要指标之一[10]。如图4可知,在苗期、结荚期,施用生物炭对花生功能叶片的PIABS值无显著影响。在开花下针期,C15处理的PIABS值比CK处理提高了154.6%,随着生物炭用量的增加,叶片光化学效率有增加趋势,C50比CK的值提高了178.9%,但C15与C50之间无显著差异。到花生成熟期时,观察到相同规律, 施用生物炭均可以显著提高PIABS值,与CK相比提升幅度分别为73.7%和79.7%,随着生物炭用量的增加,提高幅度增强但并不显著。
2.5 不同处理对花生功能叶ψo值的影响
ψo反映了反应中心捕获的激子能将电子传递到电子传递链中超过QA的其他电子受体的概率,即2 ms时有活性的反应中心的开放程度[25]。如图5所示在苗期和结荚期,施用生物炭对花生功能叶片的ψo值没有显著的影响。在开花下针期和成熟期,施用生物炭能显著增加花生功能叶片的ψo值,施用低量生物炭的C15处理比同时期的不施肥的CK处理高出25.0%和7.8%,施用高量生物炭的C50处理比同时期的不施肥的CK处理高出25.5%和8.2%,增施生物炭有提高花生功能叶片在开花下针期和成熟期ψo值的增幅的趋势。

不同字母表示差异显著(P<0.05)

不同字母表示差异显著(P<0.05)
3 讨论
肥料长期定位试验以长期固定的施肥模式按不同的方向持续改变土壤性质,能够增大各处理间生产特性的差距,有利于系统研究作物演变特性[26]。而叶绿素荧光的变化能够在一定程度上反映植物对环境的响应,当植物处于不同环境条件时,通过分析快速叶绿素荧光诱导动力学曲线,能深入了解环境对植物光合机构主要是PSⅡ反应中心的影响以及光合机构对环境的适应机制[27]。有研究表明[21],施用一定量的生物炭能提高花生营养生长时期(开花下针期)叶片光系统中电子的传递、光能的吸收、氧化还原性能,同时降低叶片放氧复合体(OEC)受损程度,但随着生物炭用量逐渐增大效果减弱。
3.1 施用生物炭对花生功能叶片OEC的影响
K点是OJIP曲线上照光后大约 0.3 ms处的特征位点,作为OEC受损的一个特殊标记,K点被广泛关注[23,28]。研究表明,当PSII的供体侧受到非生物环境胁迫如温度、干旱等,会造成放氧复合体(OEC)结构和功能的改变,导致水光解受到抑制,OEC向PSII提供的电子减少,导致光合电子传递链效率降低,引起光合速率下降,使OJIP曲线上K点上升[29-30]。本研究中花生功能叶片在各个生育时期的OJIP曲线均出现K相,表明OEC的活性受到损伤,PSII反应中心供应电子的能力和传递电子的能力失衡[31]。施用少量生物炭能降低各生育时期K点相对可变荧光强度(ΔVt<0),缓解花生叶片PSII水裂解系统的抑制,表明施用少量生物炭能缓解逆境对放氧复合体的损伤。当增加生物炭用量,开花下针期和成熟期K点相对可变荧光强度值降低程度较C15处理有所增加,但苗期和结荚期施用高量生物炭K点的相对可变荧光强度差为正值,表明该时期高生物炭用量对OEC的受损无缓解作用。研究表明[1]高温是导致OJIP曲线K点出现的原因之一,而施用生物炭会加深土壤颜色,增加土壤温度,这可能是C50处理增加苗期和结荚期K点相对可变荧光强度的原因。
3.2 施用生物炭对花生功能叶片电子传递的影响
逆境下,PSⅡ受体侧电子传递受阻导致光合电子链上电子过剩,其原因主要是植物被光照后,被激发的电子由Pheo传给QA生成QA-时间极短,仅为250—300 ps,由QA-传递到QB的时间却需要100—200 μs,因此逆境条件下QA向QB电子传递容易受阻,造成QA-的积累,而OJIP曲线上2 ms时J点相对荧光强度(VJ)恰好反映QA-的积累量,即可以间接反映 PSⅡ反应中心受体侧电子由QA向QB的传递能力[25,32]。本试验中,连续施用生物炭能显著降低了开花下针期和成熟期OJIP曲线上2 ms时的VJ值、荧光曲线初始上升斜率MO值,表明生物炭的施用能提高反应中心活性,降低开花下针期和成熟期2 ms时PSⅡ有活性反应中心关闭程度,提高QA-被还原的速率。与此同时Ψo升高,Ψo值受PSⅡ供体侧的电子供应能力和受体侧(包括PSI)接受电子的能力制约。李书鑫等[33]研究表明,当遇到低温胁迫时,叶片反应中心光能捕获及分配发生变化,甚至会造成 PSⅡ反应中心失活,这进一步表明生物炭的施用能缓解环境逆境带来的损伤,提高花生功能叶片PSⅡ受体侧QB接受电子的能力,提高电子由QA传递到 QB的速率。
PIABS包含大量关于SPⅡ反应中心原初光化学反应的信息,不仅能反映 PSⅡ反应中心对光能的捕获情况,还可以反映PSⅡ反应中心下游的电子传递情况[33-34]。原佳乐等[35]研究表明PIABS对干旱敏感,干旱会降低植物叶片的PIABS值。施用生物炭能显著提高开花下针期和成熟期的花生叶片的PIABS性能指数,表明施用生物炭能提高花生该时期的抗旱性,使花生叶片最大光化学效率提高,增强PSⅡ潜在活性和光合作用原初反应,促使其整体的光合性能增强,显著提高花生叶片的光合效率。
4 结论
连续施用生物炭可以有效地缓解花生开花下针期和成熟期叶片放氧复合体的受损程度,且随着生物炭用量增加,效果有增加趋势。提高花生叶片光合效率的关键时期主要出现在开花下针期和成熟期,有效降低了开花下针期和成熟期2 ms叶片反应中心关闭程度(VJ值)和活性(MO值),提高了该时期吸收光能为基础的性能指数(PIABS)和电子传递速率(Ψo),降低了OEC受损程度。
[1] 秦立琴, 张悦丽, 郭峰, 万书波, 孟庆伟, 李新国. 强光下高温与干旱胁迫对花生光系统的伤害机制. 生态学报, 2011, 31(7): 1835-1843.
QIN L Q, ZHANG Y L, GUO F, WAN S B, MENG Q W, LI X G. Damaging mechanisms of peanut(L.)photosystems caused by high-temperature and drought under high irradiance. Acta Ecologica Sinica, 2011, 31(7): 1835-1843. (in Chinese)
[2] 万素梅, 贾志宽, 杨宝平. 苜蓿光合速率日变化及其与环境因子的关系. 草地学报, 2009, 17(1): 27-31. doi:10.3969/j.issn.1007-0435. 2009.01.006.
WAN S M, JIA Z K, YANG B P. Relationship between diurnal changes of alfalfa net photosynthetic rate and environmental factors. Acta Agrectir Sinica, 2009, 17(1): 27-31. doi:10.3969/j.issn.1007- 0435.2009.01.006. (in Chinese)
[3] 李晓, 冯伟, 曾晓春. 叶绿素荧光分析技术及应用进展. 西北植物学报, 2006, 26(10): 2186-2196. doi:10.3321/j.issn:1000-4025.2006. 10.037.
LI X, FENG W, ZENG X C. Advances in chlorophyll fluorescence analysis and its uses. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(10): 2186-2196. doi:10.3321/j.issn:1000-4025.2006.10.037. (in Chinese)
[4] 战秀梅, 彭靖, 王月, 刘轶飞, 陈坤, 韩晓日, 王恒飞, 蔺文成, 李喜研. 生物炭及炭基肥改良棕壤理化性状及提高花生产量的作用. 植物营养与肥料学报, 2015, 21(6): 1633-1641. doi:10.11674/ zwyf.2015.0631.
ZHAN X M, PENG J, WANG Y, LIU Y F, CHEN K, HAN X R, WANG H F, LIN W C, LI X Y. Influences of application of biochar and biochar-based fertilizer on brown soil physiochemical properties and peanut yields. Plant Nutrition and Fertilizer Science, 2015, 21(6): 1633-1641. doi:10.11674/zwyf.2015.0631. (in Chinese)
[5] 宋婷, 张谧, 高吉喜, 韩永伟. 快速叶绿素荧光动力学及其在植物抗逆生理研究中的应用. 生物学杂志, 2011, 28(6): 81-86. doi:10. 3969/j.issn.2095-1736.2011.06.081.
SONG T, ZHANG M, GAO J X, HAN Y W. Fast chlorophyll fluorescence kinetics and its application in plant physiology research. Journal of Biology, 2011, 28(6): 81-86. doi:10.3969/j.issn.2095- 1736.2011.06.081. (in Chinese)
[6] 赵丽娟, 李欢, 张洪, 王创云. 土壤中残留氯吡嘧磺隆对红芸豆幼苗光合作用的影响. 山西农业科学, 2019, 47(1): 75-77. doi:10. 3969/j.issn.1002-2481.2019.01.19.
ZHAO L J, LI H, ZHANG H, WANG C Y. Effects of halosulfuron-methyl residues in soil on photosynthesis of red kidney bean seedlings. Journal of Shanxi Agricultural Sciences, 2019, 47(1): 75-77. doi:10.3969/j.issn.1002-2481.2019.01.19. (in Chinese)
[7] KALTRINA R, KRISTI B, DEA Z, LULEZIM S, RENÉ H S, JAKOB S, REINHARD B. Alpine ecology, plant biodiversity and photosynthetic performance of marker plants in a nitrogen gradient induced bybushes. BMC Ecology, 2020, 20(1): 23. doi:10. 1186/s12898-020-00292-9.
[8] 尹赜鹏, 王珍琪, 齐明芳, 孟思达, 李天来. 外施褪黑素对盐胁迫下番茄幼苗光合功能的影响. 生态学杂志, 2019, 38(2): 467-475. doi:10.13292/j.1000-4890.201902.023.
YIN Z P, WANG Z Q, QI M F, MENG S D, LI T L. Effects of melatonin application on photosynthetic function in tomato seedlings under salt stress. Chinese Journal of Ecology, 2019, 38(2): 467-475. doi:10.13292/j.1000-4890.201902.023. (in Chinese)
[9] 刘超, 袁野, 盖树鹏, 张玉喜, 刘春英, 郑国生. 强光高温交叉胁迫对牡丹叶片PSⅡ和PSⅠ之间能量传递的影响. 园艺学报, 2014, 41(2): 311-318. doi:10.16420/j.issn.0513-353x.2014.02.006.
LIU C, YUAN Y, GAI S P, ZHANG Y X, LIU C Y, ZHENG G S. Effects of strong light coupled with high temperature treatment on energy transfer between PSⅡ and PSⅠ in tree peony leaves. Acta Horticulturae Sinica, 2014, 41(2): 311-318. doi:10.16420/j.issn.0513- 353x.2014.02.006. (in Chinese)
[10] 李冬梅, 葛云花. 淹水胁迫对紫丁香幼苗叶片PSⅡ光化学活性的影响. 安徽农业科学, 2014, 42(13): 3787-3790. doi:10.13989/j.cnki. 0517-6611.2014.13.098.
LI D M, GE Y H. Effects of flooding stress on PSⅡ photochemistry activity in leaves ofseedlings. Journal of Anhui Agricultural Sciences, 2014, 42(13): 3787-3790. doi:10.13989/j.cnki. 0517-6611.2014.13.098. (in Chinese)
[11] 陈温福, 张伟明, 孟军. 农用生物炭研究进展与前景. 中国农业科学, 2013, 46(16): 3324-3333.
CHEN W F, ZHANG W M, MENG J. Advances and prospects in research of biochar utilization in agriculture. Scientia Agricultura Sinica, 2013, 46(16): 3324-3333. (in Chinese)
[12] GLASER B, HAUMAIER L, GUGGENBERGER G, ZECH W. Black carbon in soils: The use of benzenecarboxylic acids as specific markers. Organic Geochemistry, 1998, 29(4): 811-819. doi:10.1016/S0146- 6380(98)00194-6.
[13] 张阿凤, 潘根兴, 李恋卿. 生物黑炭及其增汇减排与改良土壤意义. 农业环境科学学报, 2009, 28(12): 2459-2463. doi:10.3321/j.issn: 1672-2043.2009.12.004.
ZHANG A/E/E F, PAN G X, LI L Q. Biochar and the effect on C stock enhancement, emission reduction of greenhouse gases and soil reclaimafion. Journal of Agro-Environment Science, 2009, 28(12): 2459-2463. doi:10.3321/j.issn: 1672-2043.2009.12.004. (in Chinese)
[14] GERARD C, ZOFIA K, STAVROS K, KIMON C, ORJAN G. Relations between environmental black carbon sorption and geochemical sorbent characteristics. Environmental Science & Technology, 2004, 38(13): 3632-3640. (in Chinese)
[15] CHENG C H, LEHMANN J, THIES J E, BURTON S D, ENGELHARD M H. Oxidation of black carbon by biotic and abiotic processes. Organic Geochemistry, 2006, 37(11): 1477-1488. doi:10. 1016/j.orggeochem.2006.06.022.
[16] 李明, 李忠佩, 刘明, 江春玉, 吴萌. 不同秸秆生物炭对红壤性水稻土养分及微生物群落结构的影响. 中国农业科学, 2015, 48(7): 1361-1369. doi:10.3864/j.issn.0578-1752.2015.07.11.
LI M, LI Z P, LIU M, JIANG C Y, WU M. Effects of different straw biochar on nutrient and microbial community structure of a red paddy soil. Scientia Agricultura Sinica, 2015, 48(7): 1361-1369. doi:10. 3864/j.issn.0578-1752.2015.07.11. (in Chinese)
[17] 袁帅, 赵立欣, 孟海波, 沈玉君. 生物炭主要类型、理化性质及其研究展望. 植物营养与肥料学报, 2016, 22(5): 1402-1417. doi:10. 11674/zwyf.14539.
YUAN S, ZHAO L X, MENG H B, SHEN Y J. The main types of biochar and their properties and expectative researches. Journal of Plant Nutrition and Fertilizer, 2016, 22(5): 1402-1417. doi:10.11674/ zwyf.14539. (in Chinese)
[18] WANG Y, PAN F, WANG G, ZHANG G, WANG Y, CHEN X, MAO Z. Effects of biochar on photosynthesis and antioxidative system ofRehd. seedlings under replant conditions. Elsevier, 2014, 175: 9-15.doi:10.1016/j.scienta.2014.05.029.
[19] 曾爱. 生物炭对塿土土壤理化性质及小麦生长的影响[D]. 杨凌: 西北农林科技大学, 2013.
ZENG A. Effects of biochar on soil physical and chemical properties and the growth of wheat in manural loessial soil[D]. Yangling: Northwest A & F University, 2013. (in Chinese)
[20] JEFFERY S, VERHEIJEN F G A, VELDE M V D, BASTOS A C. A quantitative review of the effects of biochar application to soils on crop productivity using meta-analysis. Agriculture, Ecosystems & Environment, 2011, 144(1): 175-187. doi:10.1016/j.agee.2011. 08.015.
[21] 杨劲峰, 鲁豫, 刘小华, 王月, 李娜, 黄玉茜, 韩晓日. 施用炭基缓释肥对花生光合功能的影响. 植物营养与肥料学报, 2017, 23(2): 408-415. doi:10.11674/zwyf.16120.
YANG J F, LU Y, LIU X H, WANG Y, LI N, HUANG Y Q, HAN X R. Effects of biochar-based slow-release fertilizer on photosynthetic characters of peanut functional leaves. Plant Nutrition and Fertilizer Science, 2017, 23(2): 408-415. doi:10.11674/zwyf.16120. (in Chinese)
[22] 王帅, 韩晓日, 战秀梅, 杨劲峰, 王月, 刘轶飞, 李娜. 氮肥水平对玉米灌浆期穗位叶光合功能的影响. 植物营养与肥料学报, 2014, 20(2): 280-289. doi:10.11674/zwyf.2014.0203.
WANG S, HAN X R, ZHAN X M, YANG J F, WANG Y, LIU Y F, LI N. Effect of nitrogenous fertilizer levels on photosynthetic functions of maize ear leaves at grain filling stage. Plant Nutrition and Fertilizer Science, 2014, 20(2): 280-289. doi:10.11674/zwyf.2014.0203. (in Chinese)
[23] 李鹏民. 快速叶绿素荧光诱导动力学在植物逆境生理研究中的应用[D]. 泰安: 山东农业大学, 2007.
LI P M. Application of chlorophyll a fluorescence transient in study of plant physiology under stress conditions[D]. Taian: Shandong Agricultural University, 2007. (in Chinese)
[24] 张谧, 王慧娟, 于长青. 超旱生植物沙冬青高温胁迫下的快速叶绿素荧光动力学特征. 生态环境学报, 2009, 18(6): 2272-2277. doi:10.16258/j.cnki.1674-5906.2009.06.007.
ZHANG M, WANG H J, YU C Q. The examination of high temperature stress ofby chlorophyll fluorescence induction parameters. Ecology and Environmental Sciences, 2009, 18(6): 2272-2277. doi:10.16258/j.cnki.1674-5906. 2009.06.007. (in Chinese)
[25] 李鹏民, 高辉远, Reto J.Strasser. 快速叶绿素荧光诱导动力学分析在光合作用研究中的应用. 植物生理与分子生物学学报, 2005, 31(6): 559-566.
LI P M, GAO H Y, STRASSER R. Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study. Acta Photophysiologica Sinica, 2005, 31(6): 559-566. (in Chinese)
[26] 高晓宁, 韩晓日, 战秀梅, 孙振涛, 姜琳琳, 陈赫. 长期不同施肥处理对棕壤氮储量的影响. 植物营养与肥料学报, 2009, 15(3): 567-572. doi:10.3321/j.issn: 1008-505X.2009.03.011
GAO X N, HAN X R, ZHAN X M, SUN Z T, JIANG L L, CHEN H. Effect of long-term fertilization on total nitrogen storage in a brown soil. Plant Nutrition and Fertilizer Science, 2009, 15(3): 567-572. doi:10.3321/j.issn: 1008-505X.2009.03.011 (in Chinese)
[27] SRIVASTAVA A, STRASSER R J. Stress and stress management of land plants during a regular day. Journal of Plant Physiology, 1996, 148(3/4): 445-455. doi:10.1016/S0176-1617(96)80278-1.
[28] SRIVASTAVA A, GUISSÉ B, GREPPIN H, STRASSER R J. Regulation of antenna structure and electron transport in Photosystem II ofunder elevated temperature probed by the fast polyphasic chlorophyll a fluorescence transient: OKJIP. Biochimica et Biophysica Acta (BBA) - Bioenergetics, 1997, 1320(1): 95-106. doi:10.1016/S0005-2728(97)00017-0.
[29] 刘倩倩, 马寿宾, 冯希环, 孙艳, 衣艳君, 刘维信. 嫁接对高温和低温胁迫下辣椒幼苗快速叶绿素荧光诱导动力学特性的影响. 园艺学报, 2016, 43(5): 885-896. doi:10.16420/j.issn.0513-353x.2015- 0970.
LIU Q Q, MA S B, FENG X H, SUN Y, YI Y J, LIU W X. Effects of grafting on the fast chlorophyll fluorescence induction dynamics of pepper seedlings under temperature stress. Acta Horticulturae Sinica, 2016, 43(5): 885-896. doi:10.16420/j.issn.0513-353x.2015-0970. (in Chinese)
[30] 张会慧, 龙静泓, 王均睿, 吴绪叶, 马松良, 宁强, 许楠. 不同种类盐胁迫对高粱幼苗生长及叶片光合机构功能的影响. 生态学杂志, 2019, 38(1): 161-172. doi:10.13292/j.1000-4890.201901.019.
ZHANG H H, LONG J H, WANG J R, WU X Y, MA S L, NING Q, XU N. Effects of different salt stress conditions on growth ofseedlings and function of leaf photosynthetic apparatus. Chinese Journal of Ecology, 2019, 38(1): 161-172. doi:10.13292/j.1000-4890. 201901.019. (in Chinese)
[31] 赵和丽, 杨再强, 王明田, 韦婷婷, 王琳, 孙擎, 张旭然. 高温高湿胁迫及恢复对番茄快速荧光诱导动力学的影响. 生态学杂志, 2019, 38(8): 2405-2413. doi:10.13292/j.1000-4890.201908.029.
ZHAO H L, YANG Z Q, WANG M T, WEI T T, WANG L, SUN Q, ZHANG X R. Effects of high temperature and high humidity stress and restoration on the fast fluorescence induction dynamics of tomato leaves. Chinese Journal of Ecology, 2019, 38(8): 2405-2413. doi:10.13292/j.1000-4890.201908.029. (in Chinese)
[32] 李耕, 高辉远, 赵斌, 董树亭, 张吉旺, 杨吉顺, 王敬锋, 刘鹏. 灌浆期干旱胁迫对玉米叶片光系统活性的影响. 作物学报, 2009, 35(10): 1916-1922. doi:10.3724/SP.J.1006.2009.01916.
LI G, GAO H Y, ZHAO B, DONG S T, ZHANG J W, YANG J S, WANG J F, LIU P. Effects of drought stress on activity of photosystems in leaves of maize at grain filling stage. Acta Agronomica Sinica, 2009, 35(10): 1916-1922. doi:10.3724/SP.J.1006. 2009.01916. (in Chinese)
[33] 李书鑫, 徐婷, 李慧, 杨文莹, 蔺吉祥, 朱先灿. 低温胁迫对玉米幼苗叶绿素荧光诱导动力学的影响. 土壤与作物, 2020, 9(3): 221-230. doi:10.11689/j.issn.2095-2961.2020.03.002.
LI S X, XU T, LI H, YANG W Y, LIN J X, ZHU X C. Effects of low temperature on chlorophyll fluorescence kinetics of maize seedlings. Soil and Crop, 2020, 9(3): 221-230. doi:10.11689/j.issn.2095-2961. 2020.03.002. (in Chinese)
[34] 孙山, 王少敏, 王家喜, 高辉远. 黑暗中脱水对'金太阳'杏离体叶片PSⅠ和PSⅡ功能的影响. 园艺学报, 2008, 35(1): 1-6. doi:10. 3321/j.issn: 0513-353X.2008.01.001.
SUN S, WANG S M, WANG J X, GAO H Y. Effects of dehydration in the dark on functions of PSⅠ and PSⅡ in apricot (L. ‘Jin Taiyang’) leaves. Acta Horticulturae Sinica, 2008, 35(1): 1-6. doi:10.3321/j.issn: 0513-353X.2008.01.001. (in Chinese)
[35] 原佳乐, 马超, 冯雅岚, 张均, 杨发强, 李友军. 不同抗旱性小麦快速叶绿素荧光诱导动力学曲线对干旱及复水的响应. 植物生理学报, 2018(6): 1119-1129.
YUAN J L, MA C, FENG Y L, ZHANG J, YANG F Q, LI Y J. Response of chlorophyll fluorescence transient in leaves of wheats with different drought resistances to drought stresses and rehydration. Plant Physiology Journal, 2018(6): 1119-1129. (in Chinese)
Effects of Continuous Application of Biochar on Chlorophyll Fluorescence Characteristics of Peanut at Different Growth Stages
GU BoWen1,YANG JinFeng1, LU XiaoLing2,WU YiHui1, LI Na1, LIU Ning1, AN Ning1, HAN XiaoRi1
1College of Land and Environment, Shenyang Agricultural University/National Engineering Laboratory for Efficient Utilization of Soil and Fertilizer Resources/Monitoring & Experimental Station of Corn Nutrition and Fertilization in Northeast Region, Ministry of Agriculture and Rural Affairs, Shenyang 110866;2Marine College, Shandong University, Weihai 264209, Shandong
【】By measuring the photosynthetic performance indexes of functional leaves of peanut at different growth stages, the effects of different amounts of biochar on electron transport, light energy absorption and redox properties of peanut leaves photosome II were studied for 9 years in a row. Meanwhile, the change trend of leaf oxygen evolution complex (OEC) damage degree was observed to provide the theoretical support for guiding peanut fertilization. 【】A field experiment was conducted in 2011 with three treatments: CK (no fertilization), C15 (biochar 225 kg·hm-2), and C50 ( biochar 750 kg·hm-2). In 2019, the peanut functional leaves at different growth stages were collected, and the photosynthetic indexes of leaves after dark treatment were measured by M-PEA-2 instrument.【】By analyzing the chlorophyll fluorescence parameters of peanut functional leaves at different growth stages, it was found that continuous application of biochar had a significant effect on the rapid chlorophyll fluorescence kinetic curve (OJIP curve). The relative variable fluorescence intensity difference (ΔVt) of K point treated with C15 was -0.002 and -0.020 at seedling stage and flowering and needle setting stage, and -0.024 and -0.053 at pod setting stage and maturity stage. Compared with CK treatment, the relative variable fluorescence intensity of K point in functional leaves of peanut at different growth stages was significantly decreased; with the increase of biochar dosage, the decrease range of K point at flowering, needling and mature stages increased in varying degrees. The chlorophyll fluorescence parameters of peanut functional leaves had a positive response to the continuous application of biochar at the flowering, needling and maturity stages. Compared with CK treatment, the relative variable fluorescence intensity at the J-step (VJ) under C15 treatment decreased by 23.9%, the approximated initial slope of the fluorescence transient (MO) decreased by 32.1%, and the rate at which trapped excitons transfer electrons to other electron receptors downstream of QAin the electron transport chain (ΨO) increased by 25.0% .The performance index on absorption basis (PIABS) increased by 154.6%, which alleviated the damage of oxygen releasing complex (OEC) in peanut functional leaves and improved the ability of electron transfer from primary quinone receptor (QA) to other electron receptors downstream of electron transport chain, and its effect on chlorophyll fluorescence performance increased. With the increase of biochar dosage, the effect was more obvious. At the mature stage, the effects of biochar application on chlorophyll fluorescence characteristics of peanut leaves were basically consistent with those at flowering and needling stage. The specific performance was as follows: the relative variable fluorescence intensity at the J-step (VJ) and the approximated initial slope of the fluorescence transient (MO) under C15 treatment were significantly lower than those under CK treatment 12.5% and 16.0%, respectively, and the trapped excitons transferred electrons into the electron transfer chain (QA) .Compared with CK treatment, the relative variable fluorescence intensity at the J-step (VJ) decreased by 13.2%, and the approximated initial slope of the fluorescence transient (MO) decreased by 19.4%. The probability that a trapped exciton moved an electron into the electron transport chain beyond QA (ΨO)was 8.2%, and the performance index on absorption basis (PIABS) increased by 79.7%.【】Continuous application of biochar could increase the electron transfer efficiency of photosystem II in functional leaves of peanut at the time of flowering and maturity, and improve the photosynthetic performance of functional leaves of peanut during this period.
biochar; peanut; chlorophyll fluorescence; chlorophyll a fluorescence (OJIP) transient

10.3864/j.issn.0578-1752.2021.21.006
2020-11-25;
2021-01-04
国家自然科学基金(32072679)、国家重点研发计划(2017YFD0200803)、国家现代农业产业技术体系(CARS-13)
顾博文,E-mail:2019220426@stu.syau.edu.cn。通信作者杨劲峰,E-mail:yangjinfeng7672@syau.edu.cn。通信作者韩晓日,E-mail:hanxr@syau.edu.cn
(责任编辑 李云霞)

