不同干燥方式对甘薯叶功能成分及抗氧化活性的影响
赵珊,仲伶俐,秦琳,黄世群,李曦,郑幸果,雷欣宇,雷绍荣,郭灵安,冯俊彦
不同干燥方式对甘薯叶功能成分及抗氧化活性的影响
赵珊1,仲伶俐1,秦琳1,黄世群1,李曦1,郑幸果1,雷欣宇1,雷绍荣1,郭灵安1,冯俊彦2
1四川省农业科学院农业质量标准与检测技术研究所/农业部农产品质量安全风险评估实验室(成都),成都 610066;2四川省农业科学院生物技术核技术研究所,成都 610061
【】探讨不同干燥方式对甘薯叶功能成分含量及抗氧化能力的影响,为甘薯叶综合开发和干燥加工工艺优化提供理论依据。以甘薯品种‘台农71’和‘胜南’的叶片为材料,研究蒸干结合热风干燥、真空冷冻干燥、60℃/50℃/40℃热风干燥共5种干燥方式对甘薯叶功能成分(总酚、总黄酮、绿原酸类成分、-胡萝卜素、维生素D3、维生素E、抗坏血酸、维生素B1、维生素B2)、抗氧化能力(采用DPPH、ABTS+自由基清除法测定)和外观色泽(叶绿素、色值)的影响,并分析各功能成分间及功能成分与抗氧化活性的关系。甘薯叶中检测到的游离酚酸主要包括新绿原酸、绿原酸、隐绿原酸、咖啡酸、异绿原酸A、异绿原酸B和异绿原酸C。5种干燥方式对甘薯叶中功能成分有不同程度的影响。真空冷冻干燥下,‘台农71’叶片中游离酚酸总量最高,达到38.4 mg·g-1DW,是其在60℃热风干燥下含量的25.6倍。真空冷冻干燥和蒸干结合热风干燥下,叶片中总酚、总黄酮和抗坏血酸含量差异相对较小,但都显著高于60℃/50℃/40℃ 3种热风干燥。真空冷冻干燥下,两个材料的总酚和总黄酮含量最高,分别是3种热风干燥的1.7—5.3倍和1.7—3.8倍。抗坏血酸在真空冷冻干燥下有较好的保留(175.3—441.1 mg/100 gDW),而在热风干燥中含量极低(3.4—5.7 mg/100 gDW)。维生素D3和-生育酚在蒸干结合热风干燥下含量最高。抗氧化活性分析表明,不同干燥方式下甘薯叶甲醇提取物抗氧化活性差异显著(<0.05),其中真空冷冻干燥和蒸干结合热风干燥的自由基清除率较高,显著高于3种热风干燥。相关性分析表明,总酚、总黄酮、总绿原酸、维生素D3、-生育酚之间存在极显著相关性(<0.01);甘薯叶抗氧化能力与总酚、总黄酮及各绿原酸类成分的含量也存在极显著相关(<0.01)。真空冷冻干燥和蒸干结合热风干燥能较好地保留甘薯叶中总酚、绿原酸及衍生物、黄酮、维生素D3、-生育酚、抗坏血酸等功能成分,使叶片干燥后仍具有较强的抗氧化能力。与真空冷冻干燥相比,蒸干结合热风干燥具有成本低和耗时短的优势,是实际生产应用中干燥保留甘薯叶多酚和黄酮的优选方式。
甘薯叶;干燥方式;功能成分;抗氧化活性
0 引言
【研究意义】甘薯(Lam.)又名红薯、番薯,属旋花科番薯属一年生草本植物[1],世界第七大粮食作物,也是我国重要的粮食、饲料、工业原料和生物质能源作物[2]。甘薯地上部分包括叶、叶柄和茎,可以在一年中多次采收,产量远高于其他叶类蔬菜[3]。甘薯茎叶还富含多种生物活性成分,如多糖、黄酮、多酚以及多种维生素,具有调节免疫、抗肿瘤、降血糖、降血脂、抗衰老、抗疲劳、抗菌、抗辐射等生理保健功效[4-7]。近年来,茎叶的食用和加工逐渐成为甘薯产业化研究的热点。多酚类物质是甘薯叶中最重要的功能性成分之一,主要包括绿原酸及其衍生物[8-10]。由于新鲜甘薯叶片采摘后保鲜时间短,易萎蔫、腐烂。干燥是延长甘薯叶片保存时间的最佳方法,也是深加工及产品开发的必需环节,如甘薯叶青汁粉、甘薯叶饮料、甘薯叶保健醋等[11]产品都是在干燥叶片的基础上开发而来。这些产品不但满足了消费者对营养和保健的需求,也进一步促进了甘薯产业的发展。但是,研究表明[12-14]干燥会对叶片固有营养物质,特别是生物活性化合物造成损害。因此,研究不同干燥方式对甘薯叶片功能成分的影响,建立最佳的干燥方式,对提高甘薯叶片加工工艺具有重要意义。【前人研究进展】目前,果蔬的干燥方式主要有日晒、热风干燥、真空冷冻干燥等。日晒投入低,但加工时间长,易受天气、温度等气候环境因素的影响,干燥质量不稳定。热风干燥是一种成本低、易于控制且应用广泛的干燥方法[15],但热风干燥往往会破坏活性成分,降低含量[16-17]。真空冷冻干燥技术能够较好地保存和保留新鲜样品的外观、味道、营养成分、颜色、风味、质地和生物活性等,但该方式设备投资高,干燥时间长且能耗大[18-19]。蒸汽热烫结合热风干燥是近几年发展起来的干燥新技术,据报道在保存食品营养价值方面效果更好,被认为是一种获得高质量干燥产品的潜在方法[20-22]。司金金[23]、宋振[24]等比较了不同干燥方式对总酚、黄酮、蛋白质、总糖等成分的影响。Jeng等[25]比较了30℃鼓风干燥、70℃和100℃热风干燥以及真空冷冻干燥下甘薯叶片中咖啡酰奎宁酸的含量,发现高温干燥会影响甘薯叶中咖啡酰奎宁酸的含量,真空冷冻干燥叶片的含量显著高于其他几种,其次是30℃鼓风干燥。【本研究切入点】最好的干燥方式应该是既可简便、快速除去材料中的水分,又尽可能减少材料中有效活性成分或目标成分的损失。目前,关于甘薯叶片干燥方式的报道还较少,不同干燥方式对甘薯叶功能成分及抗氧化活性的影响也缺乏全面和深入的研究。【拟解决的关键问题】本研究采用蒸干结合热风干燥、真空冷冻干燥和3种热风干燥的方式对甘薯叶进行干燥,比较不同干燥方式对甘薯叶片中功能成分、抗氧化活性及色泽等品质性状的影响,探求一种高效、低成本,且最大限度保留甘薯叶片活性成分的干燥方式,为叶用甘薯加工及产业发展提供理论和技术支撑。
1 材料与方法
1.1 试验材料
本研究选用甘薯品种为‘台农71’和‘胜南’,由四川省农业科学院生物技术核技术研究所提供。‘台农71’:半直立株型,叶心形、绿色;‘胜南’:半直立株型,叶心形、绿色。材料种植于四川省农业科学院生物技术核技术研究所试验基地。2019年4月播种育苗,同年6月剪苗栽插,8月采集甘薯叶片进行试验。
1.2 仪器与试剂
ACQUITY UPLC I-Class/Xevo TQ-XS超高效液相色谱-串联三重四级杆质谱仪(美国Waters公司);1290 Infinity II超高效液相色谱仪(美国Agilent公司);Gamma 2-16 LSC plus真空冷冻干燥机(德国Martin christ公司);Varioskan Flash多功能酶标仪(美国Thermo fisher公司);UV2550紫外分光光度计(日本岛津公司);Cary Eclipse荧光分光光度仪(美国Varian公司);CR-400色差仪(柯尼卡美能达公司);SFG-02B电热鼓风干燥箱(黄石市恒丰医疗器械公司);SHA-CA恒温水浴振荡器(常州荣华仪器制造有限公司);D3204R高速离心机(北京大龙兴创实验仪器有限公司);KQ5200DE超声波清洗机(昆明市超声仪器有限公司)。
标准品(纯度均大于97%):咖啡酸、L-抗坏血酸、-胡萝卜素购自美国Sigma-Aldrich公司,3-CQA、维生素D3、-生育酚、维生素B1和维生素B2购自德国Dr. Ehrenstorfer公司,4-CQA、5-CQA、3,4-diCQA、3,5-diCQA和4,5-diCQA购自武汉天植生物技术有限公司,1-CQA、1,3-diCQA和1,5-diCQA购自成都普瑞法科技开发有限公司,芦丁购自日本和光纯药公司;福林酚试剂购自国药集团化学试剂有限公司;1,1-二苯基-2-苦肼基自由基(1,1-Diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2′-Azino-bis (3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)、过硫酸钾(分析纯)、乙腈(色谱纯)、甲醇(色谱纯)、无水乙醇(色谱纯)、甲酸(色谱纯)、0.22 μm微孔过滤膜等购自上海安谱科技股份有限公司;碳酸钠、乙酸钠、铁氰化钾、偏磷酸、硼酸、丙酮、石油醚、氢氧化钠、盐酸、乙酸等分析纯试剂均购自广东西陇化工股份有限公司。
1.3 试验方法
1.3.1 甘薯叶粉的制备 取新鲜叶片冲洗干净泥沙,晾干水分后随机均分为5份,根据文献[25]并结合预试验结果,分别采用不同的干燥方式干燥至水分低于10%。将干燥后的叶片粉碎过60目筛,贮存于-20℃备用。
蒸干结合热风干燥(steam drying combined with hot air drying,SD+HAD):将叶片平铺于蒸板上,水沸后将叶片放入蒸锅,并盖上锅盖蒸5 min,打开锅盖继续蒸,使甘薯叶片中水分去除80%以上,然后将甘薯叶片转移至电热鼓风干燥箱,50℃继续干燥2 h。
真空冷冻干燥(vacuum freeze drying,VFD):将叶片放入-80℃超低温冰箱冷冻过夜,之后将冷冻的叶片移至真空冷冻干燥箱,连续干燥48 h。
热风干燥(hot air drying,HAD):将叶片放至电热鼓风干燥箱干燥,分别设定温度为60℃,干燥时间为4 h;温度为50℃,干燥时间为8 h;温度为40℃,干燥时间为32 h。
1.3.2 总酚和总黄酮的测定 甘薯叶醇提取物的制备参照ZHENG[26]的方法并改进:精确称取样品0.2 g,加入70 mL 70%甲醇水溶液,于60℃超声浸提30 min,定容至100 mL,离心后过0.22 μm微孔过滤膜,避光保存待测定游离酚酸、总酚和总黄酮。
总酚含量的测定参照文献[27]以绿原酸为标准品,采用福林酚法测定上述醇提取物中总多酚含量,结果以干基样品中绿原酸当量(mg CAE·g-1DW)表示。测定重复3次。
总黄酮含量的测定参照文献[28]以芦丁为标准品,采用三氯化铝比色法测定上述醇提取物中总黄酮含量,结果以干基样品中芦丁当量(mg RE·g-1DW)表示。测定重复3次。
1.3.3 甘薯叶游离酚酸的UPLC-MS/MS分析 将1.3.2甘薯叶醇提取物稀释20倍进行UPLC-MS/MS分析,参照文献[29]进行测定,结果以干基(mg·g-1DW)表示,重复3次。具体条件和操作如下。
1.3.3.1 色谱条件 色谱柱:Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 µm);柱温:35℃;样品室温度10℃;进样量:2.0 μL;流动相A:0.01%甲酸水溶液,过0.2 μm水相微孔过滤膜;流动相B:乙腈;流速:0.3 mL·min-1;梯度洗脱程序:0—0.5 min,5% B;0.5—3 min,5%—10% B;3—9 min,10%—15% B;9—12 min,15%—20% B;12—12.5 min,20% B;12.5—14 min,20%—50% B;14—14.5 min,50%—90% B;14.5—15 min,90% B;15—15.5 min,90%—5% B;然后运行2.5 min。
1.3.3.2 质谱条件 离子源:电喷雾电离源(electrospray ionization,ESI);扫描方式:负离子模式;监测模式:多重反应监测模式(multiple response monitoring,MRM);毛细管电压3.0 kV;离子源温度:150℃;脱溶剂气温度:500℃;脱溶剂气流量:1 000 L·h-1;碰撞气流速:0.15 mL·min-1;锥孔气流速:150 L·h-1。
1.3.3.3 标准溶液的配制 分别称取10种酚酸标准品各10 mg,用甲醇溶解并定容至10 mL,贮存于-20℃棕色玻璃瓶中。酚酸混合标准工作液采用梯度稀释法现配现用。
1.3.4-胡萝卜素、维生素和叶绿素的测定-胡萝卜素含量的测定参照食品安全国家标准GB 5009.83— 2016,以-胡萝卜素为标准品,采用高效液相色谱法测定,结果以干基样品中-胡萝卜素量(mg·kg-1DW)表示。重复3次。
维生素D和维生素E含量的测定分别参照食品安全国家标准GB 5009.82—2016中第四法和第一法,分别以维生素D3和-生育酚为标准品,采用高效液相色谱法测定,结果以干基样品中维生素D3和-生育酚量(mg·kg-1DW)表示。重复3次。
抗坏血酸含量的测定参照食品安全国家标准GB 5009.86—2016第二法,以L(+)-抗坏血酸为标准品,采用荧光分光光度法测定,结果以干基样品中L(+)-抗坏血酸总量(mg/100 g DW)表示。重复3次。
维生素B1、B2含量的测定分别参照食品安全国家标准GB 5009.84—2016和GB 5009.85—2016,分别以维生素B1和B2为标准品,采用高效液相色谱法测定,结果以干基样品中维生素B1和B2量(mg·kg-1DW)表示。重复3次。
叶绿素含量的测定参照农业标准NY/T 3082— 2017,采用分光光度法,以叶绿素总量(mg·g-1DW)表示。重复3次。
1.3.5 抗氧化活性分析 DPPH清除能力的测定:使用DPPH法测量甘薯叶醇提取物的自由基清除能力。参照文献[30]并稍作修改,将50 μL提取物添加到3 mL 60 μmol·L-1DPPH(溶于80%甲醇)中。将混合物混合并在室温下于黑暗中保持30 min。在酶标仪517 nm下测量反应溶液的吸光度。以甲醇(80%)为空白溶液作为对照。所有试验重复3次。使用以下公式计算DPPH自由基清除率:
DPPH自由基清除率(%)=(A0-Ai)/A0×100
其中A0为对照品的吸光度,Ai为样品的吸光度。
ABTS+清除能力的测定:参照文献[31]并稍作修改,取7.4 mmol·L-1ABTS储备液和2.6 mmol·L-1过硫酸钾溶液以体积比1﹕1混匀,室温避光静置12 h后,用pH 7.4磷酸盐缓冲液稀释至734 nm处吸光度0.7±0.02,作为ABTS+工作液。取50 μL甘薯叶醇提取物样品至3 mL ABTS+工作液中,混匀后反应6 min,在酶标仪734 nm波长下测定吸光度。以pH 7.4磷酸盐缓冲液为空白溶液作为对照。所有试验重复3次。使用以下公式计算ABTS+自由基清除率:
ABTS+自由基清除率(%)=(A0-Ai)/A0×100
其中A0为对照品的吸光度,Ai为样品的吸光度。
1.3.6 色值的测定 将甘薯叶粉末平铺于色差仪的粉末测试盒中,读取色值,记录L*、a*、b*值,L*表示亮度,a*和b*分别表示红(+a*)/绿(-a*)和黄(+b*)/蓝(-b*),重复3次。
1.4 数据处理
采用完全随机设计,每个样品3次重复。使用SPSS 22.0软件分析统计数据。用方差分析评估各组间的统计差异,然后进行LSD检验,不同字母表示差异显著(<0.05)。
2 结果
2.1 UPLC-MS/MS测定甘薯叶片游离酚酸方法的建立与优化
结合之前的研究结果[29],通过进一步优化液相条件和质谱方法,10种酚酸化合物得到了较好的峰形和分离度。在负离子模式下,分别对10种酚酸化合物进行扫描,确定特征离子对,进一步优化毛细管电压、锥孔电压、碰撞能量、驻留时间等参数,使分子离子与特征碎片离子产生的离子对强度达到最大,确定丰度较高的两个子离子作为定性离子,并选择其中丰度最高的作为定量离子,具体质谱参数见表1。采用优化好的液相方法和质谱方法对酚酸标准品进行分析,10种酚酸的离子色谱图如图1所示。各酚酸在10—1 000 μg·L-1浓度范围线性良好,相关系数(2)≥0.999,可以满足定量分析的要求。
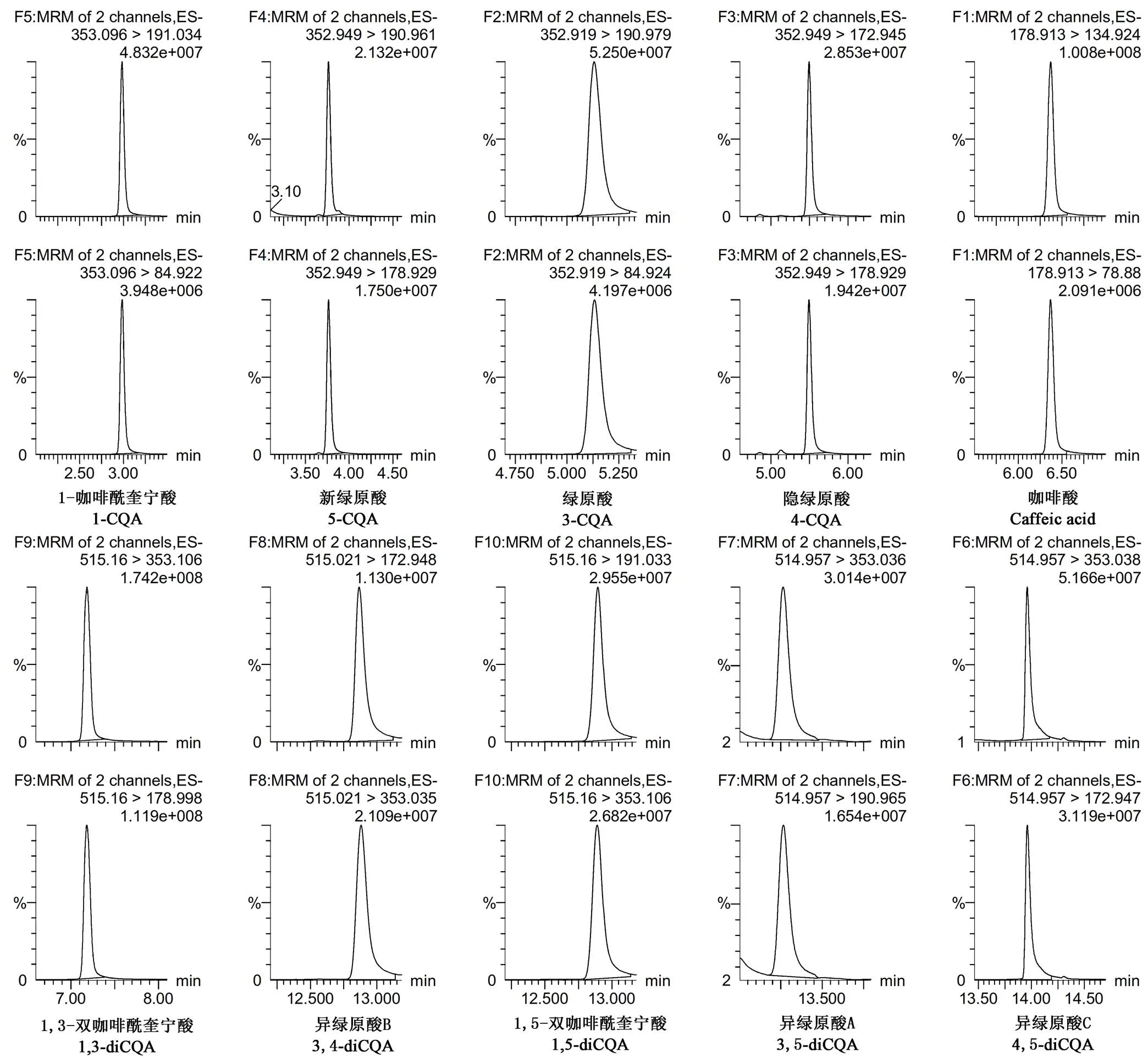
图1 10种酚酸的离子色谱图
2.2 干燥方式对甘薯叶片功能成分含量及色值的影响
2.2.1 游离酚酸含量 甘薯叶中游离酚酸的组成为新绿原酸、绿原酸、隐绿原酸、咖啡酸、异绿原酸A、异绿原酸B和异绿原酸C。不同干燥方式下甘薯叶中游离酚酸含量见表2,两个材料在不同干燥方式下游离酚酸总量差异显著(<0.05),‘胜南’中游离酚酸含量低于‘台农71’。在‘台农71’叶片中,游离酚酸总量最高的干燥方式是真空冷冻干燥(38.4 mg·g-1DW),其含量分别是蒸干结合热风干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥的1.3倍、2.6倍、3.7倍和25.6倍。‘胜南’中游离酚酸总量最高的干燥方式是蒸干结合热风干燥(17.9 mg·g-1DW),其含量分别是真空冷冻干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥条件下的1.3倍、3.6倍、6.9倍、19.9倍。
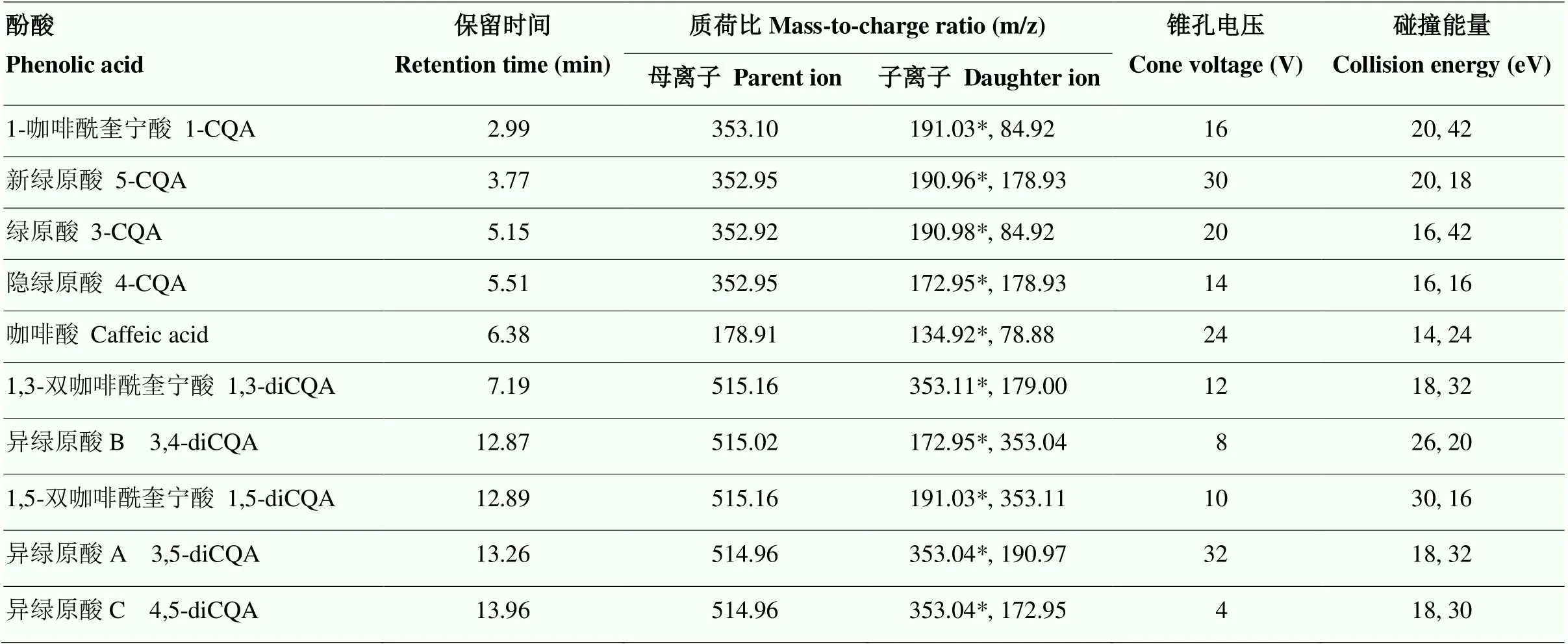
表1 目标化合物的质谱分析参数
*为定量离子 *Represents quantitative ions in the table
单个酚酸的测定结果显示,在‘台农71’叶片中,真空冷冻干燥方式下的新绿原酸(3.87 mg·g-1DW)、绿原酸(4.86 mg·g-1DW)、异绿原酸B(7.50 mg·g-1DW)、异绿原酸A(15.82 mg·g-1DW)含量最高;异绿原酸C在蒸干结合热风干燥下的(4.38 mg·g-1DW)含量最高;隐绿原酸在真空冷冻干燥(2.09 mg·g-1DW)和蒸干结合热风干燥(2.15 mg·g-1DW)中含量相对较高且二者间没有显著差异(>0.05);咖啡酸在真空冷冻干燥下(2.70 mg·g-1DW)含量最高,显著高于其他4种干燥方式(0.01—0.04 mg·g-1DW)(<0.05)。在‘胜南’中,真空冷冻干燥条件下的绿原酸(3.23 mg·g-1DW)和异绿原酸A(4.50 mg·g-1DW)含量最高;蒸干结合热风干燥条件下的新绿原酸(1.67 mg·g-1DW)、隐绿原酸(1.11 mg·g-1DW)、异绿原酸B(4.58 mg·g-1DW)和异绿原酸C(4.10 mg·g-1DW)含量最高;咖啡酸在真空冷冻干燥下(0.41 mg·g-1DW)含量最高,显著高于其他4种干燥方式(<0.05)。
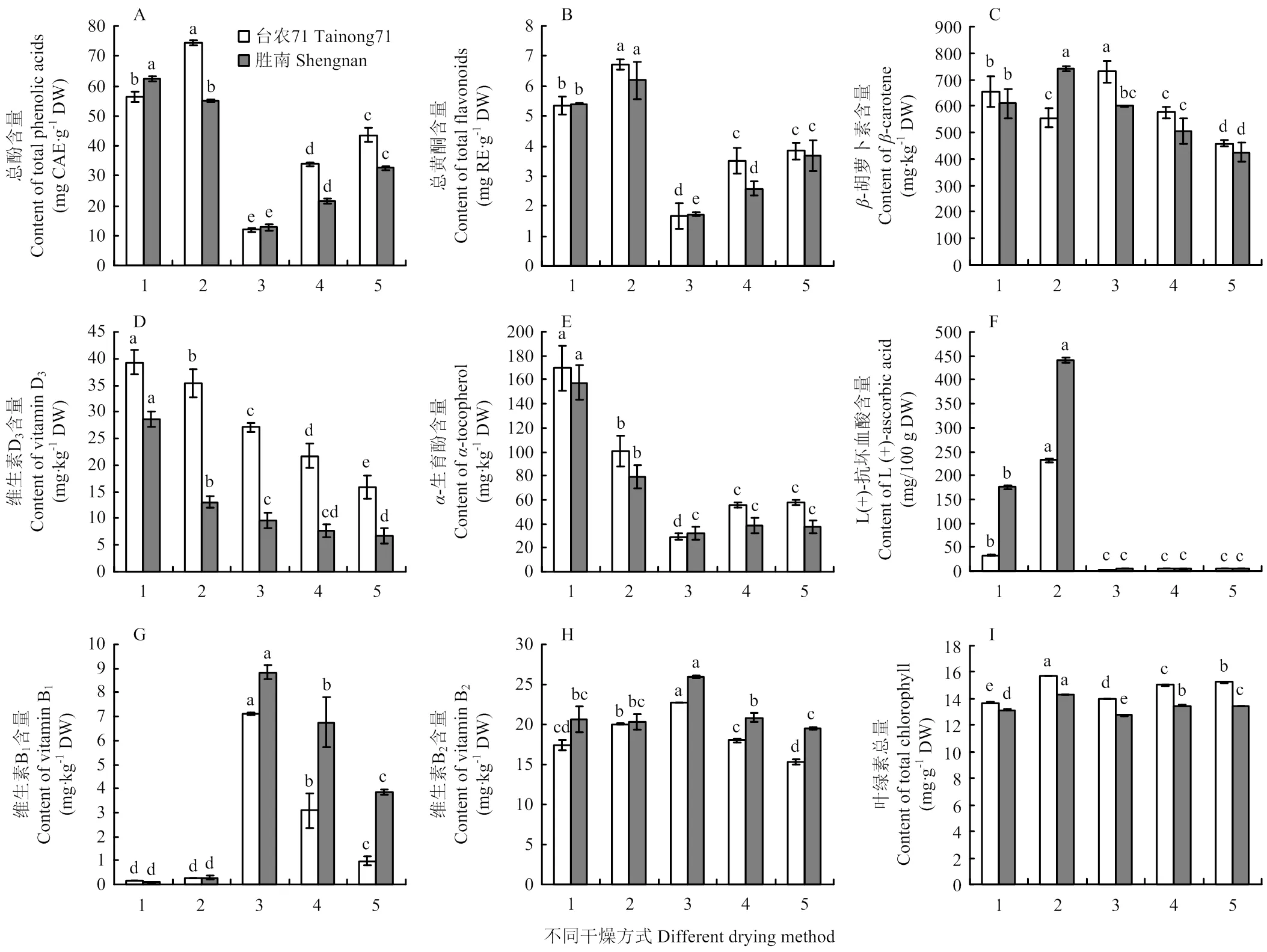
2.2.2 总酚、总黄酮含量 不同干燥方式下总酚含量差异显著(<0.05),总黄酮在50℃和40℃热风干燥的‘台农71’叶片中差异不显著(>0.05),其余差异显著(<0.05),其中真空冷冻干燥和蒸干结合热风干燥的含量明显高于3种热风干燥。不同温度下的热风干燥,其总酚和总黄酮含量高低顺序为40℃>50℃>60℃(图2)。
真空冷冻干燥下,两个材料的总酚(64.8 mg CAE·g-1DW)和总黄酮(6.5 mg RE·g-1DW)含量最高,总酚分别是蒸干结合热风干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥的1.1倍、1.7倍、2.3倍、5.3倍;总黄酮分别是它们的1.2倍、1.7倍、2.1倍和3.8倍。
2.2.3 脂溶性维生素含量-胡萝卜素在‘台农71’中的含量范围为457.9—729.8 mg·kg-1DW,含量最高的是60℃热风干燥;在‘胜南’中含量范围是425.6—740.6 mg·kg-1DW,含量最高的是真空冷冻干燥。维生素D3在两个材料中的含量高低情况基本一致,具体为蒸干结合热风干燥>真空冷冻干燥>60℃热风干燥>50℃热风干燥>40℃热风干燥,‘台农71’和‘胜南’中的含量范围分别为16.0—39.3和6.7—28.6 mg·kg-1DW。-生育酚在蒸干结合热风干燥中含量最高(157.5—169.8 mg·kg-1DW),其次是真空冷冻干燥(79.0—100.6 mg·kg-1DW),3种热风干燥含量较低(图2)。
2.2.4水溶性维生素含量 抗坏血酸在真空冷冻干燥方式下含量最高,‘台农71’和‘胜南’中含量分别为175.3和441.1 mg/100 g DW,其次是蒸干结合热风干燥(32.4和175.3 mg/100 g DW),3种热风干燥下,抗坏血酸被严重破坏,仅为3.4—5.7 mg/100 g DW。维生素B1在热风干燥下含量较高,且高低情况为60℃>50℃>40℃,在‘台农71’中的含量为1.0—7.1 mg·kg-1DW,‘胜南’中的含量为3.9—8.8 mg·kg-1DW;维生素B1在真空冷冻干燥和蒸干结合热风干燥中含量都较低,且没有显著性差异(>0.05)。维生素B2在两个材料中含量最高的都是60℃热风干燥(图2)。
2.2.5 叶绿素含量和色值结果 由图2-I可知,不同干燥方式下甘薯叶中叶绿素总量差异显著(<0.05),‘台农71’和‘胜南’都是真空冷冻干燥下含量最高。‘台农71’在蒸干结合热风干燥下(13.7 mg·g-1DW)含量最低,‘胜南’在60℃热风干燥下(12.8 mg·g-1DW)含量最低。
不同干燥方式对甘薯叶色值的影响见表3。L*值差异相对较小,不同干燥方式下‘台农71’的a*和b*有显著性差异(<0.05),其绿色深浅程度为40℃热风干燥>真空冷冻干燥>50℃热风干燥>蒸干结合热风干燥>60℃热风干燥,黄色深浅程度为真空冷冻干燥>40℃热风干燥>50℃热风干燥>60℃热风干燥>蒸干结合热风干燥。在‘胜南’中,蒸干结合热风干燥和60℃热风干燥的a*值之间差异不显著(>0.05),40℃和60℃热风干燥的b*值差异不显著(>0.05),其余方式差异显著(<0.05),绿色的深浅程度为真空冷冻干燥>40℃热风干燥>50℃热风干燥>60℃热风干燥/蒸干结合热风干燥,黄色深浅程度为真空冷冻干燥>40℃/60℃热风干燥>50℃热风干燥>蒸干结合热风干燥。
不同小写字母表示差异显著(P<0.05)。下同
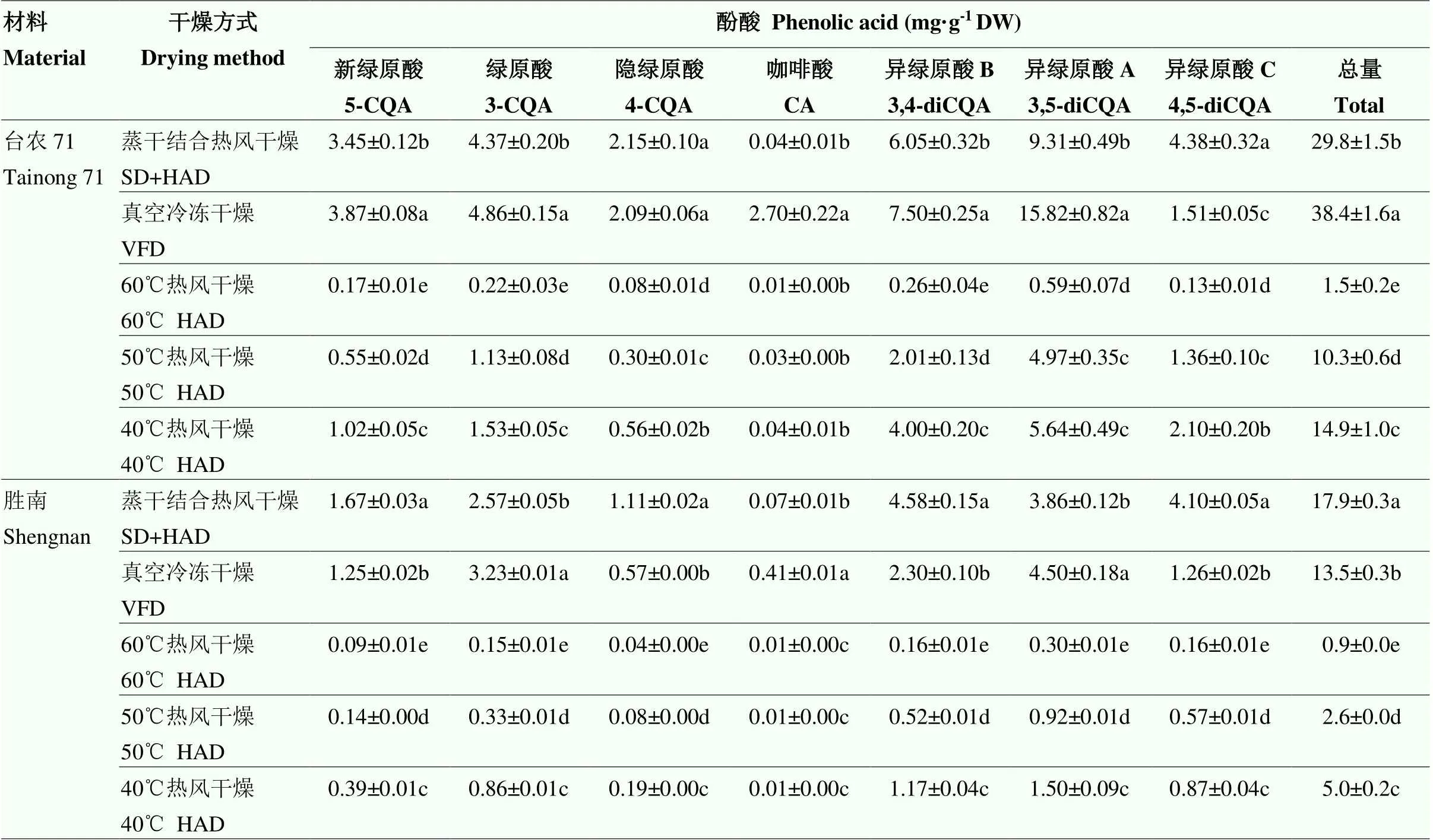
表2 不同干燥方式下甘薯叶中酚酸的含量
不同小写字母表示差异显著(<0.05)。下同
The different lowercase letters mean a significant difference (<0.05). The same as below
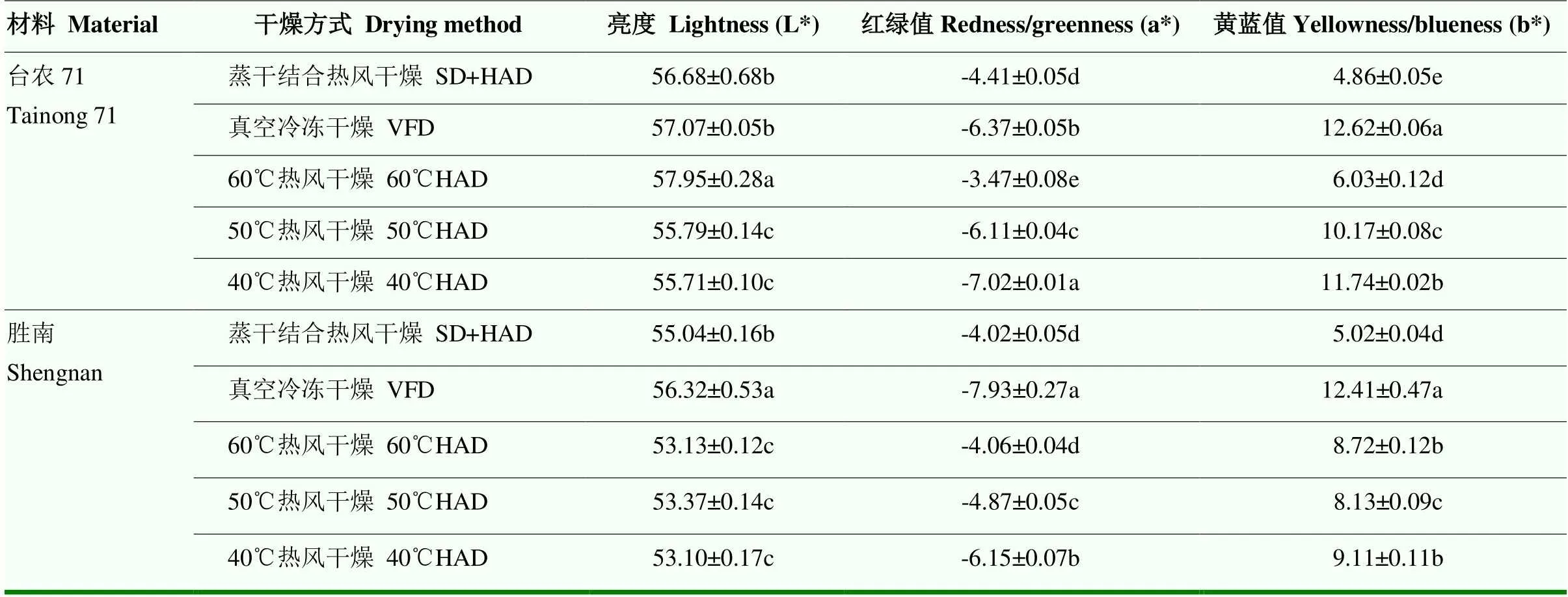
表3 不同干燥方式对甘薯叶色值的影响
2.3 功能成分相关性和主成分分析
整体上看,总酚、总黄酮、总绿原酸、维生素D3、-生育酚、维生素B1之间的相关性较强。其中,总酚与总黄酮、总绿原酸极显著相关;总酚与维生素D3、-生育酚、L(+)-抗坏血酸呈极显著正相关(<0.01);而维生素B1与总酚、总黄酮、总绿原酸、维生素D3、-生育酚、L(+)-抗坏血酸呈极显著负相关(<0.01);-胡萝卜素仅与L(+)-抗坏血酸呈极显著正相关(<0.01),与维生素D3呈显著正相关(<0.05),与其他成分相关性不显著(表4)。
将总酚、总黄酮、-胡萝卜素、维生素D3、-生育酚、L(+)-抗坏血酸、维生素B1和维生素B2这8项指标用于甘薯功能成分的主成分分析(表5),前3个主成分累计方差贡献率达到90.936%,可以代表原始数据的大部分信息。由表5可知,第一主成分包含信息量的57.746%,主要代表总酚、总黄酮、维生素D3、-生育酚和L(+)-抗坏血酸;第二主成分包含信息量的20.053%,主要代表-胡萝卜素和维生素B2;第三主成分包含信息量的13.137%,主要代表维生素D3和-生育酚。结合含量结果,推测同一类中的各成分在干燥过程中含量的变化趋势较为相似。
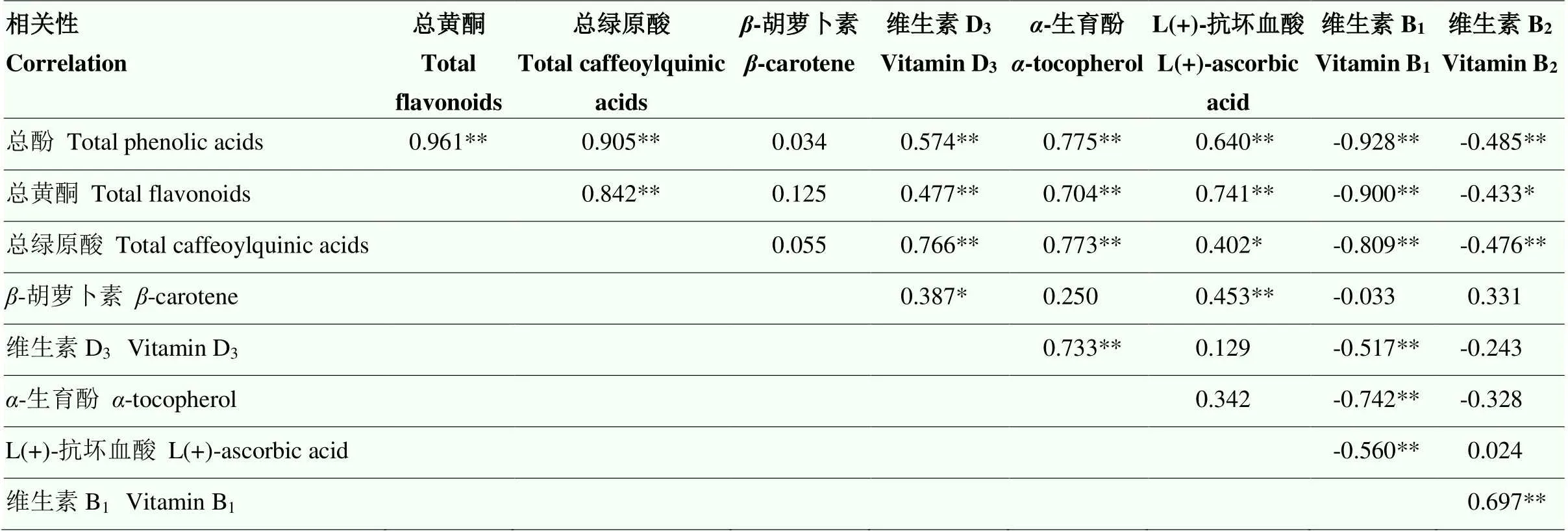
表4 甘薯叶功能成分间的相关性分析
**极显著相关(<0.01);*显著相关(<0.05)。下同
** represents extremely significant correlation (<0.01); * represents significant correlation (<0.05). The same as below
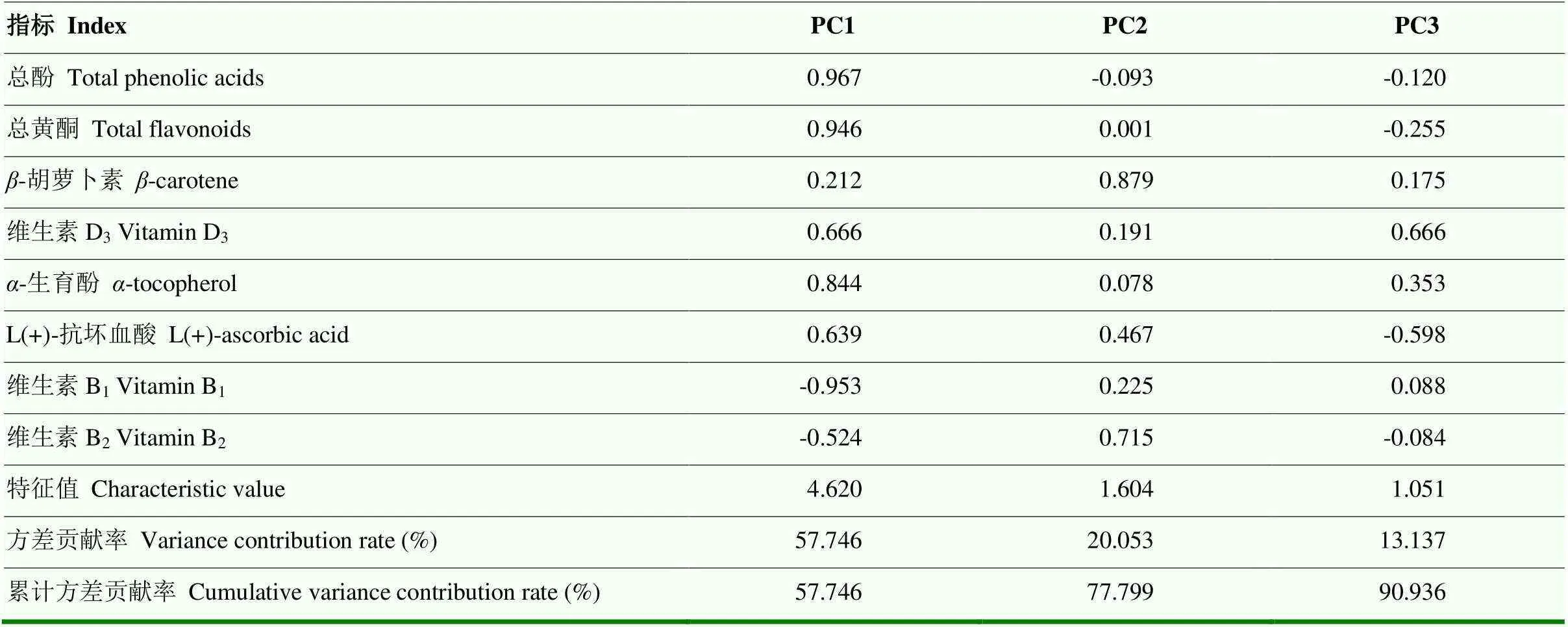
表5 甘薯叶中8项功能成分的主成分分析
2.4 干燥方式对甘薯叶醇提取物抗氧化活力的影响
2.4.1 不同干燥方式下甘薯叶醇提取物的抗氧化活力 5种干燥方式下的DPPH自由基清除率差异显著(<0.05),‘台农71’在真空冷冻干燥(73.3%)方式下最高,分别是蒸干结合热风干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥的1.1倍、1.7倍、2.1倍、7.2倍。‘胜南’在蒸干结合热风干燥(61.3%)方式下最高,分别是真空冷冻干燥、40℃热风干燥、50℃热风干燥、60℃热风干燥的1.1倍、2.1倍、3.2倍、8.3倍。比较ABTS+自由基清除率,发现‘台农71’在真空冷冻干燥(40.7%)方式下清除率最高,其次是蒸干结合热风干燥(34.7%),40℃热风干燥(31.0%)和50℃热风干燥(30.5%)差异不显著(>0.05),60℃热风干燥(18.6%)最低。‘胜南’在蒸干结合热风干燥(34.5%)和真空冷冻干燥(34.1%)下清除率较高,且二者之间差异不显著(>0.05),其次依次为40℃热风干燥(27.8%)、50℃热风干燥(26.1%)、60℃热风干燥(16.8%)(图3)。
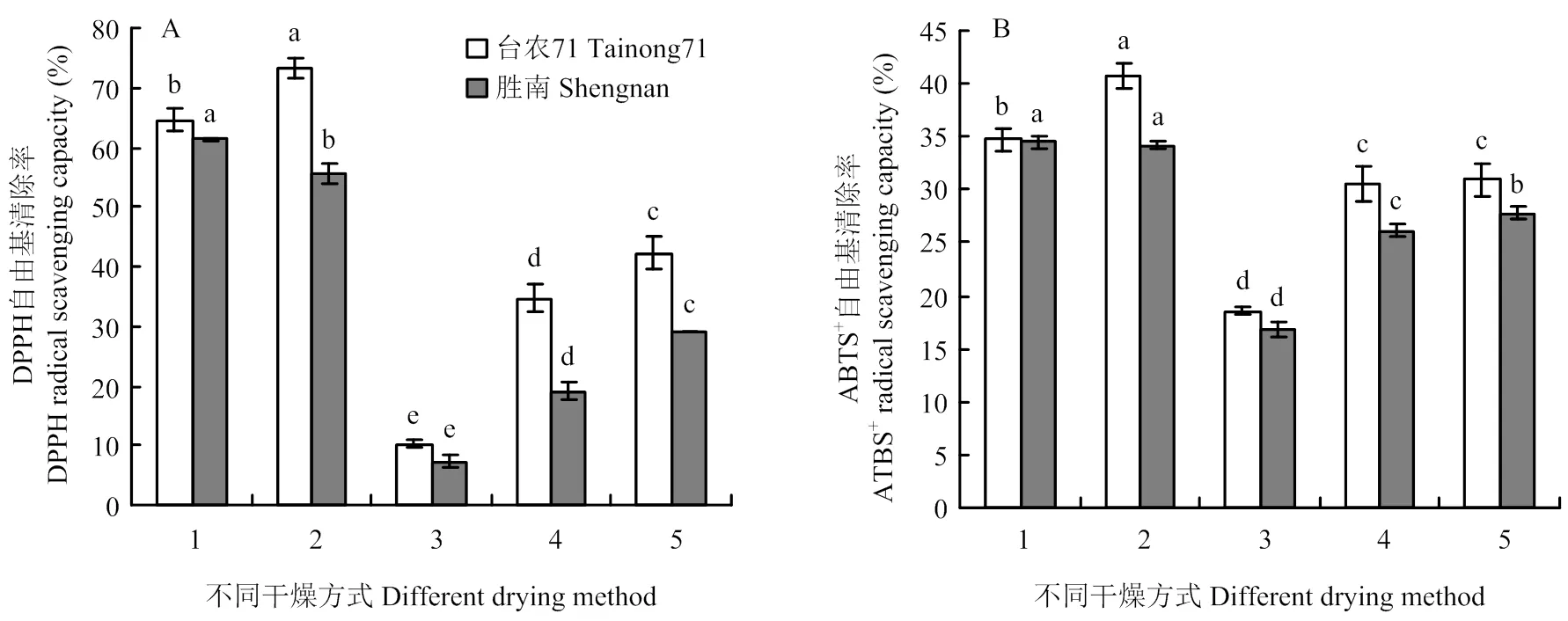
图3 干燥方式对甘薯叶醇提取物抗氧化能力的影响
2.4.2 抗氧化能力与功能成分间的相关性分析 甘薯叶DPPH和ABTS+自由基清除率与总酚、总黄酮、绿原酸类化合物总量以及各个酚酸含量之间都存在极显著相关性(<0.01),特别是与总酚、总黄酮、绿原酸类化合物总量、绿原酸和异绿原酸B的相关性较强,与总酚的相关性最强,相关系数范围为0.553—0.989(表6)。
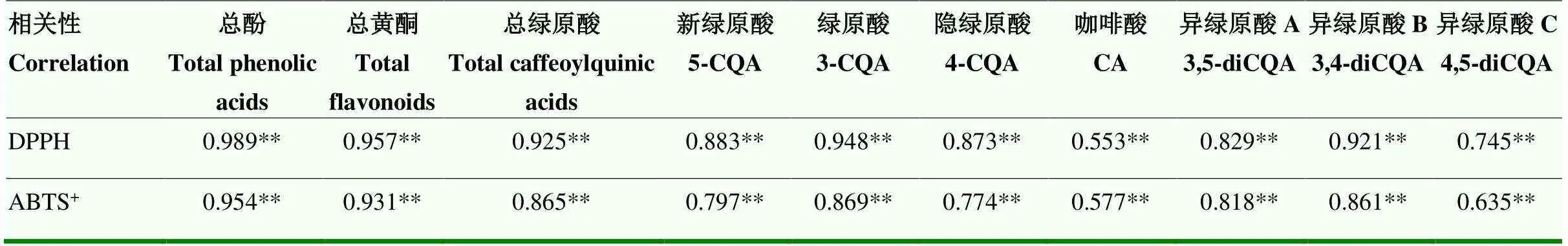
表6 干燥的甘薯叶抗氧化能力与总酚、总黄酮及绿原酸类化合物含量间的相关性分析
3 讨论
3.1 甘薯叶游离酚酸的组成及开发价值
甘薯叶中游离酚酸主要为绿原酸及其衍生物,这与前人的研究[8,32]一致。本研究除分析鉴定了9种绿原酸类物质和咖啡酸外,还采用笔者前期研究使用的方法[29]分析鉴定了甘薯叶中的其他游离酚酸,包括没食子酸、2,3,4-三羟基苯甲酸、水杨酸、3,5-二羟基苯甲酸、原儿茶酸、龙胆酸、焦儿茶酸、对羟基苯甲酸、香草酸、丁香酸、4-香豆酸、阿魏酸、3-羟基肉桂酸、芥子酸、异阿魏酸、2-羟基肉桂酸和反式肉桂酸,但这17种酚酸的游离态在甘薯叶中未检出(结果未列出)。研究发现[33-35]绿色甘薯叶片的黄酮组成有槲皮素和山奈酚及相应的黄酮苷等,但其黄酮类成分含量远低于酚酸,本研究结果与之一致。广泛存在绿原酸类物质的天然植物主要有杜仲、金银花、咖啡豆、菊花等,杜仲中绿原酸类物质含量高达5%,金银花为1.5%—5%,绿咖啡豆为6%—7.5%,甜叶菊为1.7%—7.2%[36]。本研究采用真空冷冻干燥或蒸干结合热风干燥后的甘薯叶片中绿原酸及衍生物含量为13.1—35.7 mg·g-1DW,较高的绿原酸类物质含量可能是甘薯叶具有保健功能的原因之一。与其他富含绿原酸的植物相比,甘薯叶具有栽培简单、生长周期短、产量高、成本低、绿原酸含量高等特点,这些特性也使甘薯叶在功能保健方面具有极大的开发价值。
3.2 不同干燥方式影响甘薯叶中的功能成分
多酚、黄酮、维生素等功能成分在干燥过程中会受到光照、温度、氧分压、水分活度等因素的影响,发生氧化、集合或分解等反应,导致功能成分含量发生变化[20,25,37-40]。真空冷冻干燥和蒸干结合热风干燥下的总酚、总黄酮、抗坏血酸、新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A和异绿原酸C含量都明显高于热风干燥。推测真空冷冻干燥是在低温、低氧分压条件下,氧化酶活性低,因此,类似多酚、黄酮、抗坏血酸等易发生酶促氧化和热敏感成分在该干燥条件下有较好地保留。蒸干结合热风干燥下多酚、黄酮等成分含量高可能是在高温蒸汽条件下使氧化酶迅速失活,且在较短时间内水分迅速蒸发,保持了较低的水分活度,这些使易发生酶促氧化反应的成分得到较好地保留。胡皓等[41]测定了生咖啡豆和不同烘焙条件下的6种绿原酸及衍生物含量,发现生咖啡豆中绿原酸及衍生物总量最高,随着烘焙温度和时间的增加,绿原酸总量逐渐降低。在热风干燥中,总酚、总黄酮、绿原酸及衍生物随着温度升高,含量逐渐降低,表明这些成分都是热敏感成分,在干燥方式和条件的选择时,温度需要重点考虑。在一定温度范围内,随着干燥温度的升高,氧化酶的活性增强,加速活性成分的氧化反应,但温度升高,干燥时间相应缩短,氧化反应时间减少,对于-胡萝卜素、维生素D3、维生素E等成分而言,可能是不同的干燥温度和时间共同决定了最终成分的含量差异。抗坏血酸的酶促氧化反应十分迅速,它可能只有在低温低氧分压条件才能部分保存,而不同干燥方式对维生素B2的影响较小。另外,不同干燥方式下甘薯叶的颜色有一定差异,低温对叶绿素的破坏较少,同时甘薯叶色值更偏绿和偏黄。综上,真空冷冻干燥更有利于甘薯叶中多酚、黄酮等功能活性成分的保留,其次是蒸干结合热风干燥,但两者在成本投入上有较大的差异,真空冷冻干燥设备投入大且能耗高,而蒸干结合热风干燥成本低、耗时短,在生产上更具有实用性。本研究选用的两个材料各功能成分间有一定的差异,如‘胜南’的绿原酸及衍生物含量明显低于‘台农71’,因此,功能成分的含量还取决于品种、基因等因素。
3.3 酚类物质含量影响甘薯叶的抗氧化能力
DPPH和ABTS+的自由基清除率与总酚、总黄酮以及绿原酸类化合物含量存在极显著相关性(<0.01)。总酚和总黄酮为甘薯叶中主要的功能成分,其中由绿原酸及其衍生物组成的酚类物质占主导。多酚化合物含有多个酚羟基,有很强的还原性,其结构特性是这类化合物具有抗氧化活性的主要原因,它们主要通过直接清除自由基或与金属离子相互作用来实现抗氧化[42]。傅玉凡等[43]研究了不同叶菜型甘薯茎尖绿原酸含量及清除DPPH能力,发现DPPH清除能力与绿原酸含量具有显著或极显著正相关。李晓英等[38]比较了不同干燥方式对蓝莓叶中酚类物质含量及抗氧化活性的影响,结果显示绿原酸、总酚和总黄酮含量均与抗氧化活性存在极显著相关性。综上,多酚类化合物的含量对甘薯叶抗氧化能力有很大的影响,而不同干燥方式影响了甘薯叶中功能成分的含量,特别是酚类物质,因此,干燥方式也决定了其抗氧化性能。
4 结论
采用蒸干结合热风干燥、真空冷冻干燥、60℃/50℃/40℃热风干燥5种方式对甘薯叶进行处理,不同干燥方式显著影响甘薯叶中功能成分的含量及抗氧化能力。真空冷冻干燥和蒸干结合热风干燥较好地保留了多酚、黄酮、维生素D3、-生育酚、抗坏血酸等功能成分的含量及较高的抗氧化活性。在热风干燥下,多酚和黄酮类物质为热敏感型成分,随着温度的升高,含量逐渐降低。相比真空冷冻干燥,蒸干结合热风干燥具有成本较低和干燥时间更短的优势,是实际生产应用中保留多酚和黄酮类物质的优选干燥方式。
[1] 木泰华, 孙红男, 张苗, 王成, 陈井旺, 邓福明, 何伟忠, 李鹏高, 刘兴丽, 马梦梅, 梅新, 彭小燕, 王晓梅, 席丽莎, 熊志冬, 张燕燕. 甘薯深加工技术. 北京: 科学出版社, 2014.
MU T H, SUN H N, ZHANG M, WANG C, CHEN J W, DENG F M, HE W Z, LI P G, LIU X L, MA M M, MEI X, PENG X Y, WANG X M, XI L S, XIONG Z D, ZHANG Y Y. Sweet Potato Processing Technology. Beijing: Science Press, 2014. (in Chinese)
[2] 马代夫, 李强, 曹清河, 钮福祥, 谢逸萍, 唐君, 李洪民. 中国甘薯产业及产业技术的发展与展望. 江苏农业学报, 2012, 28(5): 969-973.
MA D F, LI Q, CAO Q H, NIU F X, XIE Y P, TANG J, LI H M. Development and prospect of sweetpotato industry and its technologies in China. Jiangsu Journal of Agricultural Sciences, 2012, 28(5): 969-973. (in Chinese)
[3] AN L V, FRANKOW-LINDBERG B E, LINDBERG J E. Effect of harvesting interval and defoliation on yield and chemical composition of leaves, stems and tubers of sweet potato (L. (Lam.)) plant parts. Field Crops Research, 2003, 82(1): 49-58.
[4] JOHNSON M, PACE R D. Sweet potato leaves: Properties and synergistic interactions that promote health and prevent disease. Nutrition Reviews, 2010, 68(10): 604-615.
[5] SUN H N, MU T H, XI L S, SONG Z. Effects of domestic cooking methods on polyphenols and antioxidant activity of sweet potato leaves. Journal of Agricultural and Food Chemistry, 2014, 62(36): 8982-8989.
[6] ISLAM S. Sweetpotato (L.) leaf: Its potential effect on human health and nutrition. Journal of Food Science, 2006, 71(2): R13-R21.
[7] ISLAM M S, YOSHIMOTO M, YAMAKAWA O. Distribution and physiological functions of caffeoylquinic acid derivatives in leaves of sweetpotato genotypes. Journal of Food Science, 2003, 68(1): 111-116.
[8] ISLAM M S, YOSHIMOTO M, YAHARA S, OKUNO S, ISHIGURO K, YAMAKAWA O. Identification and characterization of foliar polyphenolic composition in sweetpotato (L.) genotypes. Journal of Agricultural and Food Chemistry, 2002, 50(13): 3718-3722.
[9] JUNG J K, LEE S U, KOZUKUE N, LEVIN C E, FRIEDMAN M. Distribution of phenolic compounds and antioxidative activities in parts of sweet potato (L.) plants and in home processed roots. Journal of Food Composition and Analysis, 2011, 24(1): 29-37.
[10] 赵珊, 仲伶俐, 李曦, 雷欣宇, 郑幸果, 郭灵安, 雷绍荣, 周虹, 黄世群, 冯俊彦. 超高效液相色谱测定冷冻研磨甘薯植株中酚酸及其分布(英文). 食品科学, 2021, 42(12): 222-232.
ZHAO S, ZHONG L L, LI X, LEI X Y, ZHENG X G, GUO L A, LEI S R, ZHOU H, HUANG S Q, FENG J Y. Determination of phenolic acids and their distribution in freeze-grinding sweetpotato plants by ultra-high performance liquid chromatography [J/OL]. Food Science, 2021, 42(12): 222-232.
[11] 郭政铭, 杨静, 周成伟, 孙月娥, 王卫东. 甘薯茎叶生理功能与其加工利用. 食品安全质量检测学报, 2019, 10(24): 8302-8307.
GUO Z M, YANG J, ZHOU C W, SUN Y E, WANG W D. Advances on physiological activities and processing utilization of sweet potato stems and leaves. Journal of Food Safety & Quality, 2019, 10(24): 8302-8307. (in Chinese)
[12] KORUS A. Effect of pre-treatment and drying methods on the content of minerals, B-group vitamins and tocopherols in kale (L. var.) leaves. Journal of Food Science and Technology, 2021. http://doi.org/10.2007/513197-021-05012-9.
[13] GARCIA L M, CECCANTI C, NEGRO C, DE BELLIS L, INCROCCI L, PARDOSSI A, GUIDI L. Effect of drying methods on phenolic compounds and antioxidant activity ofL. leaves. Horticulturae, 2021, 7(1): 10.
[14] YU Q, LI J W, FAN L P. Effect of drying methods on the microstructure, bioactivity substances, and antityrosinase activity ofstems. Journal of Agricultural and Food Chemistry, 2019, 67(5): 1537-1545.
[15] LEWICKI P P. Design of hot air drying for better foods. Trends in Food Science & Technology, 2006, 17(4): 153-163.
[16] VASHISTH T, SINGH R K, PEGG R B. Effects of drying on the phenolics content and antioxidant activity of muscadine pomace. LWT - Food Science and Technology, 2011, 44(7): 1649-1657.
[17] CAPECKA E, MARECZEK A, LEJA M. Antioxidant activity of fresh and dry herbs of somespecies. Food Chemistry, 2005, 93(2): 223-226.
[18] CHAN E W C, LIM Y Y, WONG S K, LIM K K, TAN S P, LIANTO F S, YONG M Y. Effects of different drying methods on the antioxidant properties of leaves and tea of ginger species. Food Chemistry, 2009, 113(1): 166-172.
[19] HARGUINDEGUY M, FISSORE D. On the effects of freeze-drying processes on the nutritional properties of foodstuff: A review. Drying Technology, 2020, 38(7): 846-868.
[20] HONEST K, ZHUOYAN H, LEI Z, MOLIN Z. Effect of steam blanching and drying on phenolic compounds of litchi pericarp.Molecules, 2016, 21(6): 729.
[21] PRIECINA L, KARKLINA D, KINCE T. The impact of steam- blanching and dehydration on phenolic, organic acid composition, and total carotenoids in celery rootsInnovative Food Science & Emerging Technologies, 2018, 49(5): 192-201.
[22] ROSLAN A S, ISMAIL A, ANDO Y, AZLAN A. Effect of drying methods and parameters on the antioxidant properties of tea () leaves. Food Production, Processing and Nutrition, 2020, 2(1): 8.
[23] 司金金, 辛丹丹, 王晓芬, 寇莉萍. 干燥方式对红薯叶粉品质特性的影响. 西北农林科技大学学报(自然科学版), 2018, 46(6): 129-136, 154.
SI J J, XIN D D, WANG X F, KOU L P. Effect of drying methods on quality characteristics of sweet potato leaf powder. Journal of Northwest A & F University (Natural Science Edition), 2018, 46(6): 129-136, 154. (in Chinese)
[24] 宋振, 木泰华, 孙红男, 席利莎. 不同干燥方法对甘薯茎叶粉营养及功能特性的影响及其品质评价指标的筛选. 食品科技, 2014, 39(11): 163-169.
SONG Z, MU T H, SUN H N, XI L S. Effect of different drying methods on nutritional and functional properties of sweet potato leaf powder and the screening on evaluating indicators. Food Science and Technology, 2014, 39(11): 163-169. (in Chinese)
[25] JENG T L, LAI C C, LIAO T C, LIN S Y, SUNG J M. Effects of drying on caffeoylquinic acid derivative content and antioxidant capacity of sweet potato leaves. Journal of Food and Drug Analysis, 2015, 23(4): 701-708.
[26] ZHENG W, CLIFFORD M N. Profiling the chlorogenic acids of sweet potato () from ChinaFood Chemistry, 2008, 106(1): 147-152.
[27] FU Z F, TU Z C, ZHANG L, WANG H, WEN Q H, HUANG T. Antioxidant activities and polyphenols of sweet potato (L.) leaves extracted with solvents of various polarities. Food Bioscience, 2016, 15: 11-18.
[28] DO Q D, ANGKAWIJAYA A E, TRAN-NGUYEN P L, HUYNH L H, SOETAREDJO F E, ISMADJI S, JU Y H. Effect of extraction solvent on total phenol content, total flavonoid content, and antioxidant activity of. Journal of Food & Drug Analysis, 2014, 22(3): 296-302.
[29] 赵珊, 仲伶俐, 周虹, 李曦, 雷欣宇, 黄世群, 郑幸果, 冯俊彦, 雷绍荣, 郭灵安. 超高效液相色谱-串联质谱法鉴定和分析稻米中酚酸类化合物的组成及分布. 中国农业科学, 2020, 53(3): 612-631.
ZHAO S, ZHONG L L, ZHOU H, LI X, LEI X Y, HUANG S Q, ZHENG X G, FENG J Y, LEI S R, GUO L G. Identification and analysis of phenolic acids in rice using ultra-high performance liquid chromatography-tandem mass spectrometry. Scientia Agricultura Sinica, 2020, 53(3): 612-631. (in Chinese)
[30] SHARMA O P, BHAT T K. DPPH antioxidant assay revisited. Food Chemistry, 2009, 113(4): 1202-1205.
[31] 罗牡康, 贾栩超, 张瑞芬, 刘磊, 董丽红, 池建伟, 白亚娟, 张名位. 杨桃的酚类成分含量及其生物可及性与抗氧化活性. 中国农业科学, 2020, 53(7): 1459-1472.
LUO M K, JIA X C, ZHANG R F, LIU L, DONG L H, CHI J W, BAI Y J, ZHANG M W. Phenolic content, bioavailability and antioxidant activity of carambola. Scientia Agricultura Sinica, 2020, 53(7): 1459-1472. (in Chinese)
[32] SASAKI K, OKI T, KAI Y M, NISHIBA Y, OKUNO S. Effect of repeated harvesting on the content of caffeic acid and seven species of caffeoylquinic acids in sweet potato leaves. Bioscience, Biotechnology, and Biochemistry, 2015, 79(8): 1308-1314.
[33] CHU Y H, CHANG C L, HSU H F. Flavonoid content of several vegetables and their antioxidant activity. Journal of the Science of Food and Agriculture, 2000, 80(5): 561-566.
[34] LUO C Y, WANG X X, GAO G, WANG L, LI Y X, SUN C J. Identification and quantification of free, conjugate and total phenolic compounds in leaves of 20 sweetpotato cultivars by HPLC-DAD and HPLC-ESI-MS/MS. Food Chemistry, 2013, 141(3): 2697-2706.
[35] HUANG Z, WANG B, EAVES D H, SHIKANY J M, PACE R D. Phenolic compound profile of selected vegetables frequently consumed by African Americans in the southeast United States. Food Chemistry, 2007, 103(4): 1395-1402.
[36] 李云聪, 牛志平, 徐美利, 田洪, 高伟. 甜叶菊与其他植物中绿原酸类成分对比分析. 中国食品添加剂, 2021, 32(1): 1-6.
LI Y C, NIU Z P, XU M L, TIAN H, GAO W. Comparative analysis of chlorogenic acids inand other plants. China Food Additives, 2021, 32(1): 1-6. (in Chinese)
[37] RUENROENGKLIN N, SUN J, SHI J, XUE S J, JIANG Y M. Role of endogenous and exogenous phenolics in litchi anthocyanin degradation caused by polyphenol oxidase. Food Chemistry, 2009, 115(4): 1253-1256.
[38] 李晓英, 薛梅, 樊汶樵, 罗洁. 不同干燥方式对蓝莓叶中酚类物质及其抗氧化活性的影响. 中国农业科学, 2018, 51(13): 2570-2578.
LI X Y, XUE M, FAN W Q, LUO J. Analysis of phenolic compounds and antioxidant activities of blueberry leaves from different drying methods. Scientia Agricultura Sinica, 2018, 51(13): 2570-2578. (in Chinese)
[39] 邓媛元, 汤琴, 张瑞芬, 张雁, 刘磊, 魏振承, 马永轩, 张名位. 不同干燥方式对苦瓜营养与品质特性的影响. 中国农业科学, 2017, 50(2): 362-371.
DENG Y Y, TANG Q, ZHANG R F, ZHANG Y, LIU L, WEI Z C, MA Y X, ZHANG M W. Effects of different drying methods on the nutrition and physical properties of. Scientia Agricultura Sinica, 2017, 50(2): 362-371. (in Chinese)
[40] MBONDO N N, OWINO W O, AMBUKO J, SILA D N. Effect of drying methods on the retention of bioactive compounds in African eggplant. Food Science & Nutrition, 2018, 6(4): 814-823.
[41] 胡皓, 宋红坤, 王继良, 林涛, 刘兴勇, 邵金良. 高效液相色谱法同时测定咖啡中6种绿原酸. 食品安全质量检测学报, 2018, 9(7): 1634-1643.
HU H, SONG H K, WANG J L, LIN T, LIU X Y, SHAO J L. Determination of 6 kinds of chlorogenic acid by high performance liquid chromatography. Journal of Food Safety & Quality, 2018, 9(7): 1634-1643. (in Chinese)
[42] 张欣. 多酚化合物抗氧化性的化学—生物学研究[D]. 哈尔滨: 东北农业大学, 2008.
ZHANG X. Chemical and biological study on antioxidant and capacity of polyphenols [D]. Harbin: Northeast Agricultural University, 2008. (in Chinese)
[43] 傅玉凡, 杨春贤, 赵亚特, 赵文婷, 刘小强, 曾令江, 廖志华, 张启堂. 不同叶菜型甘薯品种茎尖绿原酸含量及清除DPPH·能力. 中国农业科学, 2010, 43(23): 4814-4822.
FU Y F, YANG C X, ZHAO Y T, ZHAO W T, LIU X Q, ZENG L J, LIAO Z H, ZHANG Q T. Chlorogenic acid contents in shoot-tips of different vegetable-use sweetpotato varieties and their DPPH- scavenging capacities. Scientia Agricultura Sinica, 2010, 43(23): 4814-4822. (in Chinese)
Effects of Different Drying Methods on Functional Components and Antioxidant Activity in Sweet Potato Leaves

1Institute of Agricultural Quality Standards and Testing Technology, Sichuan Academy of Agricultural Sciences/Security Risk Assessment Laboratory of Ministry of Agriculture (Chengdu), Chengdu 610066;2Institute of Biotechnology and Nuclear Technology, Sichuan Academy of Agricultural Sciences, Chengdu 610061
【】 This study was aimed to explore the effects of different drying methods on functional components content and antioxidant capacity of sweet potato leaves, which could provide a theoretical basis for optimize drying process and fully utilize sweet potato leaves in the future. 【】 The leaves of sweet potato varieties of Tainong 71 and Shengnan were dried using five drying methods, including steam drying combined with hot air drying (SD+HAD), vacuum freeze drying (VFD), hot air drying (HAD) at 60℃, 50℃ and 40℃. The effects of different drying methods on the functional components (total phenols, total flavonoids, caffeoylquinic acids,-carotene, vitamin D3, vitamin E, ascorbic acid, vitamin B1, and vitamin B2), antioxidant capacity (using DPPH and ABTS+radical scavenging methods) and appearance color of sweet potato leaves (chlorophyll and color value) was evaluated, and the correlation between the functional components and the correlation between functional components and antioxidant activity were analyzed. 【】 Free phenolic acids detected in sweet potato leaves mainly included 5--caffeoylquinic acid, 3--caffeoylquinic acid, 4--caffeoylquinic acid, caffeic acid, 3,5-di--caffeoylquinic acid, 3,4-di--caffeoylquinic acid and 4,5-di--caffeoylquinic acid. The effects of five drying methods on the functional components of sweet potato leaves were different. Under VFD, the total content of free phenolic acids in Tainong 71 leaves was the highest, reaching to 38.4 mg·g-1DW, which was 25.6 times of that under 60℃ HAD. Total phenols, total flavonoids, ascorbic acid and caffeoylquinic acids showed small differences between VFD and SD+HAD, but which were significantly higher than those of 60℃, 50℃ and 40℃ HAD. The average total phenols (64.8 mg CAE·g-1DW) and total flavonoids (6.5 mg RE·g-1DW) content of the two materials under VFD were the highest, which were 1.7-5.3 times and 1.7-3.8 times of that under the three types of HADs, respectively. Vitamin C was well retained under VFD (175.3-441.1 mg/100 g DW), but it was extremely low (3.4-5.7 mg/100 gDW) in the three types of HADs. Vitamin D3and-tocopherol had the highest content in SD+HAD. The antioxidant activity of methanol extracts from sweet potato leaves was significantly different under different drying methods (<0.05). VFD and SD+HAD had higher free radical scavenging rates, and which were significantly higher than that under HADs. Correlation analysis showed that there was a strong correlation between total phenols, total flavonoids, total caffeoylquinic acids, vitamin D3, and-tocopherol (<0.01). Furthermore, a significant correlation was found between the antioxidant capacity of sweet potato leaves and the contents of total phenols, total flavonoids and each caffeoylquinic acid (<0.01). 【】 VFD and SD+HAD could better retain the content of polyphenols, flavonoids, vitamin D3,-tocopherol, ascorbic acid and other functional components in sweet potato leaves, which confered strong antioxidant capacity to dried sweet potato leaves. Compared with VFD, SD+HAD had the advantages of low cost and short time-consuming, so it was the preferred drying method to retain polyphenols and flavonoids in sweet potato during practical production.
sweet potato leaves; drying methods; functional components; antioxidant activity

10.3864/j.issn.0578-1752.2021.21.014
2021-02-25;
2021-05-14
四川省科技计划(2019YFH0106)、四川省财政创新工程(2017QNJJ-021,2017QNJJ-001,2019LJRC019,2016ZYPZ-005,2019LWJJ-003)、四川省农业科学院现代农业学科建设推进工程(2021XKJS061,2021XKJS080)
赵珊,Tel:028-84504142;E-mail:zhaoshan11@126.com。通信作者冯俊彦,Tel:028-84504320;E-mail:junyanfeng@live.cn
(责任编辑 赵伶俐)

