超声表现联合Ki-67指数评估胃肠间质肿瘤恶性程度的价值
张伟莉
(亳州市人民医院超声科,安徽 亳州 236800)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是临床上最常见的间质性肿瘤[1],多位于胃肠、肠系膜、网膜和腹膜中,目前认为该肿瘤起源于胃肠道Cajal细胞[2]。超声内镜引导下细针穿刺活检术(endoscopic ultrasonography guided fine needle aspiration,EUS-FNA)不仅可对病变部位进行病理诊断,还可检测病变部位的Ki-67增殖指数。Ki-67是一种与细胞增殖能力有关的抗原[3],其表达的变化与肿瘤的分化程度、浸润转移、预后情况等密切相关,是许多恶性肿瘤预后评估的重要参考指标之一[4]。Ki-67作为一种可靠的预后评估标志物[5-6],已经在口腔癌[7]、肺癌[8]、神经鞘瘤[9]等诸多肿瘤中得到了证实。2020年《间质瘤全程化管理中国专家共识》中将Ki-67也列为检测项目[10]。彩色多普勒超声检查是临床最常用的无创性检查,已成为多种疾病的首选检查和筛查方法[9]。本研究旨在分析GIST超声表现联合Ki-67指数是否能作为评估GIST恶性程度的标准,并验证Ki-67表达与GIST危险度分级是否一致。
1 资料与方法
1.1 一般资料选择2018年1月至2020年12月于亳州市人民医院经术后病理及免疫组织化学检查确诊为GIST且满足EUS-FNA适应证的86例GIST患者作为研究对象。病例纳入标准:患者符合2020年《间质瘤全程化管理中国专家共识》中关于GIST的病理学诊断标准。排除标准:(1)并发其他系统肿瘤者;(2)术前已接受放射治疗、化学治疗、靶向治疗者。86例患者中男36例,女50例;年龄28~83(54.65±5.80)岁;肿瘤位置:直肠或大肠4例,小肠23例,胃56例,其他3例;根据美国国立卫生研究院(National Institutes of Health,NIH)GIST危险度分级标准[11]将86例患者分为极低危险度25例,低危险度22例,中危险度13例,高危险度26例;肿瘤最长径:≤2 cm 44例,2~5 cm 30例,5~10 cm 10例,>10 cm 2例;病灶转移:未转移68例,转移18例。患者均表现为不同程度的腹痛和黑便,其中26例患者有腹胀腹痛现象,4例患者腹部可触及明显包块且伴低热,5例患者出现黏液便并伴有肛门灼热感,5例无明显症状因体检被发现。
1.2 检查方法
1.2.1 EUS-FNA检查患者禁食禁水8 h后进行咽喉部局部麻醉,并静脉注射15~30 mL异丙酚静脉麻醉。采用超声内镜检查仪(日本奥林巴斯CV-290+CLV-290SL),用水囊法选择常规探头以7.5 MHz的频率,先行超声内镜检查,重点记录肿瘤部位、大小、边缘及回声情况,随后在疑似结节处负压穿刺10~30次。送至病理科制片、诊断,并进行后续Ki-67指数检查
1.2.2 Ki-67指数检查根据病理科所制细胞涂片在光学显微镜下观察,Ki-67阳性肿瘤细胞的细胞核被染为棕黄色。在高倍镜视野区域,每例患者的涂片取5个肿瘤细胞丰富区域进行计数,计算Ki-67阳性细胞占视野内总细胞数的比例,即为Ki-67指数。根据Ki-67指数将患者分为极低表达组(阳性细胞比例≤3%)、低表达组(3%<阳性细胞比例≤5%)、中度表达组(5%<阳性细胞比例≤10%)和高表达组(阳性细胞比例>10%)。

2 结果
2.1 GIST部位与Ki-67表达的关系结果见表1。胃肠道内肿瘤与肠道外肿瘤患者的Ki-67表达分布的构成比比较差异有统计学意义(χ2=19.170,P=0.000)。

表1 不同部位GIST 中Ki-67表达的比较
2.2 GIST大小与Ki-67表达的关系结果见表2。高表达患者的肿瘤长径(long diameter,LD)显著高于极低表达、低表达、中表达患者,差异均有统计学意义(P<0.05);极低表达、低表达、中表达患者的肿瘤LD比较差异无统计学意义(P>0.05)。极低表达、低表达、中表达、高表达患者的肿瘤长径与短径的比值(long diameter to short diameter,LD/SD)比较差异均无统计学意义(P>0.05)。

表2 GIST患者肿瘤大小与Ki-67表达的关系
2.3 GIST边缘及内部回声与Ki-67表达的关系结果见表3。GIST边缘不规则与边缘光滑患者Ki-67表达分布的构成比比较差异有统计学意义(P<0.05)。GIST内部回声不均匀与回声均匀患者Ki-67表达分布的构成比比较差异有统计学意义(P<0.05)。GIST内部回声低回声、中等回声及高回声患者Ki-67表达分布构成比比较差异无统计学意义(P>0.05)。

表3 GIST边缘及内部回声与Ki-67表达的关系
2.4 各检测方法诊断GIST效能比较超声表现、Ki-67指数及超声表现联合Ki-67指数诊断GIST的AUC分别为0.594(95%可信区间为0.436~0.753)、0.809(0.436~0.753)、0.907(0.818~0.997)。结果见图1。超声表现联合Ki-67指数诊断GIST的AUC大于单纯的超声表现和Ki-67指数,差异有统计学意义(P<0.05)。

图1 各检测方法诊断GIST的ROC曲线
2.5 GIST的NIH危险度分级与Ki-67表达分组的一致性结果见表4。GIST患者的Ki-67表达分级与危险度分级具有一致性(Kappa=0.415,P<0.05)。
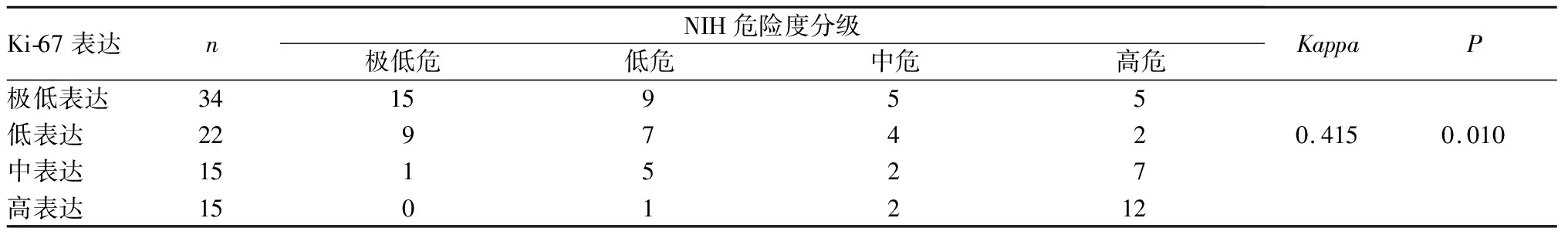
表4 NIH危险度分级与Ki-67表达分级的一致性评价
3 讨论
EUS-FNA是目前临床常用的一种对黏膜下肿瘤组织取样的方法[12],可对活检组织进行免疫组织化学诊断[13]。Ki-67是一种与细胞增殖相关的基因,其表达水平可以特异性地体现肿瘤细胞的增殖能力,二者呈现明显的正相关。有研究表明,Ki-67表达与细胞增殖周期有关,其在G0期几乎不表达,G1期至S期的早期阶段低表达,G2及M期表达明显升高[14]。肿瘤细胞Ki-67指数越高,增殖越活跃,侵袭性则越强,发生复发、转移的可能性也随之增大。目前常用的NIH危险度分级所参考的核分裂象仅代表有丝分裂的M期[15]。EUS-FNA不仅可提供病理诊断,而且可检测Ki-67增殖指数[16]。
腹膜、网膜、肠系膜等浆膜组织及肝脏等实质器官是GIST常见的转移部位,而腹膜外转移及淋巴结转移则较为少见,因此,通常认为位于胃肠道外的GIST可能具有更高的恶性风险。本研究结果显示,胃肠道外与肠道内GIST患者Ki-67表达分布的构成比比较差异有统计学意义,胃肠道外GIST患者肿瘤组织中Ki-67主要为中、高表达,本研究3例胃肠道外GIST患者中未见极低表达和低表达,提示胃肠道外GIST具有较高的恶性生物学行为。目前临床上认为,超声内镜显示不规则的边缘、内部回声不均和液性暗区是恶性间质瘤的表现,具备其中2项即可判断为恶性间质瘤。本研究结果发现,边缘不规则回声不均匀且回声较高的GIST具有更高的Ki-67指数,提示GIST的超声结果与Ki-67指数对于GIST是否为恶性间质瘤的判断可以相互参考;本研究还发现,GIST中肿瘤LD越大,Ki-67表达越高,与王瑾[17]研究结果一致,提示GIST的LD与肿瘤恶性程度关系密切,LD越长,Ki-67越可能为高表达,相应预后可能越差。本研究还发现,GIST的NIH危险度分级与Ki-67表达分级基本一致,上述结果与其他学者[18-19]的研究结果一致。
综上所述,在对GIST患者进行诊断分级时,除了可以参考现行的危险度分级标准之外,还可参考超声表现结合Ki-67表达情况,从而更加精准地判断肿瘤恶性程度。

