奥替普拉改善急性痛风性关节炎小鼠模型疼痛和炎症的效应及机制研究
曾丹怡尹诚语刘伯宇聂慧敏李晓洁陈瑞香王洁李园园徐若瑶位会娜台燕邵晓梅王萍*刘伯一*
(1.浙江中医药大学第三临床医学院,浙江省针灸神经病学研究重点实验室,杭州 310053;2.浙江中医药大学基础医学院,杭州 310053;3.浙江中医药大学中医药科学研究院,杭州 310053)
急性痛风性关节炎(AGA)是一种由单钠尿酸盐结晶(MSU)在关节组织处沉积而造成的急性炎症性关节疾病,其与体内嘌呤代谢系统紊乱相关[1]。AGA作为老年人最常见的炎症性关节病之一[2],同时也是全球公认的最能影响人类的急性痛症之一[3],可使患者生活质量显著下降。AGA属于全球性疾病,目前全球范围患病率约为1%~4%,其中以老年男性多见,但近年来逐步趋于年轻化[4]。我国AGA患病率为1%~3%,并呈逐年上升趋势。AGA起病急骤,可导致关节红、肿、热、痛和运动功能障碍,历时数天或数周缓解。患者关节部位出现刀割、咬噬样剧痛,严重影响生活质量[5]。目前临床针对AGA治疗主要为秋水仙碱、非甾体抗炎药和糖皮质激素,而长期使用这些药物往往导致诸多不良反应,包括胃肠道不适、溃疡、肝肾损害、神经毒性和免疫抑制等[6]。近期临床新推出的选择性环氧酶-2抑制剂,如依托考昔等,虽深受痛风患者喜爱,然而有研究表明,长期服用此类药物可能对心脏产生严重毒副作用,从而使得此类药物应用受限[7]。因此针对AGA治疗药物的研究具有重要临床意义。
氧化应激反应广泛参与了炎症和疼痛的发生机制。AGA发病时局部关节组织中巨噬细胞对MSU晶体的识别与反应是其中的主要环节。在此过程中,巨噬细胞被募集到炎症部位,吞噬MSU,并释放大量氧化应激产物(ROS)。这些ROS物质的释放可进一步加剧脂质过氧化反应,导致一系列脂质过氧化产物生成,激活痛敏感TRPA1通道,产生关节疼痛,并诱发关节炎症反应[8-9]。此外,关节炎症过程中所释放的一些炎症因子,如IL-1β、TNF-α等,也参与了痛觉敏化的发生机制[10-12]。
奥替普拉最初是一种临床用于治疗血吸虫的药物,它是一种Nrf2特异性激动剂。前期研究已经发现AGA模型小鼠患侧踝关节组织中Nrf2表达含量显著减少,而某些抗氧化剂和镇痛剂能提高其在踝关节组织中的表达含量。且有研究发现,在不同动物模型和临床试验中,奥替普拉可发挥抗氧化、抗癌、镇痛和抗炎等功效[13]。它可通过激活抗氧化信号通路,抑制高糖诱导的细胞氧化应激和凋亡[14]。它还可以上调Nrf2内源性抗氧化机制,防止小鼠高脂饮食引起的胰岛素抵抗和肥胖[15]。近期还有研究显示,奥替普拉能通过激活脊髓Nrf2/HO-1信号通路改善化疗药物紫杉醇诱发的外周神经病理痛[16]。然而目前关于奥替普拉能否对AGA发挥治疗作用还未见报道。因此在本研究中,拟制备MSU诱发的AGA小鼠模型,观察并研究Nrf2特异性激动剂奥替普拉对AGA模型小鼠踝关节炎症和疼痛的治疗作用及可能机制,从而为研究有效治疗AGA的药物提供方向。
1 材料与方法
1.1 材料
1.1.1 实验动物
选用100余只8周龄SPF级健康雄性C57/BL6小鼠,体重22~28 g,购自中国上海斯莱克实验动物有限公司【SCXK(沪)2019-0016】,并在浙江中医药大学实验动物中心【SYXK(沪)2019-0008】饲养。室温维持在22~25℃,湿度40%~60%,小鼠自由饮食和饮水,灯光12 h循环。本实验所有操作已通过浙江中医药大学动物伦理委员会的批准(审批号:ZSLL-2017-183)。
1.1.2 主要试剂与仪器
vonFrey纤维丝(Stoelting公司);全能台式高速冷冻离心机(Thermo Scientific公司);M4多功能酶标仪(SoftMax公司);奈特数码游标卡尺(上海美奈特实业有限公司);奥替普拉(B5958,APExBIO);二甲基亚砜(DMSO,Sigma公司);磷酸盐缓冲液(凯基生物公司);尿酸钠(Sigma公司);微量还原型谷胱甘肽(GSH)检测试剂盒(南京建成,货号:A006-2-1);SOD检测试剂盒(南京建成,货号:A001-3-2);MDA测定试剂盒(南京建成,货号:A003-1-2);过氧化氢(H2O2)检测试剂盒(碧云天,货号:S0038);其余试剂均为国产分析纯。
1.2 方法
1.2.1 分组与造模
C57/BL6小鼠,随机分为5组,即对照组,模型+溶剂组,模型+奥替普拉高剂量组(MSU+100 mg/kg Oltipraz)、模型+奥替普拉低剂量组(MSU+30 mg/kg Oltipraz)以及模型+吲哚美辛组(MSU+10 mg/kg Indo)。除对照组注射磷酸盐缓冲液外,其余各组小鼠右踝关节注射1 mg/20μL尿酸钠,制备急性痛风性关节炎小鼠模型。模型+奥替普拉组:在造模前及模后5、23、47 h腹腔注射奥替普拉。模型+吲哚美辛组:在同一时间点腹腔注射吲哚美辛。其余组腹腔注射相应溶剂或药物。
1.2.2 踝关节肿胀程度测定
采用数码游标卡尺检测造模前后不同时间点小鼠内踝和外踝之间的距离,连续测3次后取均值。踝关节肿胀程度=当前测量关节直径-初始测量直径。
1.2.3 行为学检测与50%机械缩足反应阈值(50%PWT)测定
在造模前和造模后的2、6、8、24、48 h,用von-Frey纤维丝(力量分别是0.02、0.04、0.07、0.16、0.40、0.60、1.00、1.40、2.00 g),采用经典Up-Down方法检测小鼠机械痛阈[17]。检测时,把小鼠放在高架铁丝网上的透明塑料盒内,盖上透明有机玻璃罩,让小鼠适应30 min,等其完全安静(停止整理毛发和探索走动),用von-Frey纤维丝刺激小鼠右后肢足底中部,刺激时避开足垫,直到von-Frey丝弯成S形,接着持续进行刺激5 s,观察小鼠是否出现缩足反应。假如小鼠在刺激时间段内出现缩足或舔足反应,就记为阳性反应(记为X),不能出现缩足或添足反应,就记为阴性反应(记为0)。测定首先从0.4 g开始,假如该力度von-Frey丝刺激不能引起阳性反应(小鼠足爪出现躲避)时,就用相邻大一级力度纤维丝刺激;当出现阳性反应,就给予相邻小一级力度纤维丝刺激,参照此法连续检测,直到出现第1次阳性和阴性(或阴性和阳性)反应的骑跨,继续检测4次。当第1次OX或XO出现时,再检测4次即得到一串序列。两次检测之间至少间隔1 min,从而消除上一次刺激的影响。把第1次出现“X”的前一次“O”作为起点,把该起点连续6次检测结果作为计算50%PWT的关键序列。计算公式为50%PWT(g)=10^(xf+k*δ-4)。δ在此约为0.231,Xf是序列中最后一根von-Frey丝的对数值,k为根据检测所得“X”“O”序列查表所得。
1.2.4 踝关节滑膜组织切片病理学观察
模后24 h,异氟烷麻醉处理,快速取下患侧踝关节,无菌磷酸盐缓冲液冲洗后,固定于4%多聚甲醛中。室温下固定1 d,随后PBS冲洗3次,蒸馏水冲洗3次。组织转移至20倍体积EDTA脱钙液中,室温下行脱钙处理2周。石蜡包埋,沿矢状面进行切片,再用苏木素-伊红(HE)染色。光学显微镜下观察各组小鼠踝关节滑膜组织病变及炎性细胞浸润。
1.2.5 小鼠步态分析
模后24 h用DigiGait成像系统对小鼠进行步态行为学检测,包括多种步态力学和姿势指数,如脚爪面积(paw area)、步幅长度(stride length)等。
1.2.6 抗氧化能力与氧化应激相关分子检测组织提取
模后24 h,小鼠异氟烷麻醉处理,快速取下患侧踝关节,用于生化分析,按照试剂商制定的标准进行测定。准确称取组织重量,按照重量∶体积=1∶9的比例加入生理盐水及2 mm直径钢珠,放入组织破碎仪中,在4℃环境下,匀浆粉碎制备组织匀浆。4℃,3000 rpm,15 min离心,吸取上清液,分装部分上清进行BCA法蛋白浓度测定,剩余上清用于下列试剂盒检验。
(1)超氧化物歧化酶(SOD)活性检测:根据试剂盒说明书,每孔加入20μL待测样本及20μL酶工作液,充分混匀,每孔加200μL底物应用液,置于37℃恒温箱孵育20 min后,450 nm处酶标仪读数,根据公式计算样本中SOD酶活性,报告结果是每毫克蛋白质SOD的活力,单位为U/mg protein。
(2)还原型谷胱甘肽(GSH)活性检测:配制不同浓度标准品,每孔加100μL标准品或待测样本及125μL工作液,GSH与二硫代二硝基苯甲酸(DTNB)反应,生成黄色化合物,在405 nm波长下读取数值,绘制标准曲线,计算每样本中GSH酶活性,单位为μmol/mg protein。
(3)丙二醛(MDA)含量检测:配制不同浓度标准品,每管加100μL标准品或待测样本及200μL工作液,混匀100℃加热15 min,水浴冷却至室温,室温1000 rpm离心10 min。移取200μL上清液加入96孔板中,MDA与硫代巴比妥酸反应产生红色化合物,在562 nm波长下酶标仪读数,绘制标准曲线,计算各样本中MDA含量。报告的结果是每毫克蛋白质的MDA含量,单位为μmol/mg protein。
1.3 统计学分析
实验数据均采用平均值±标准误(±s¯x)展示,采用Graphpad Prism 8.0进行数据绘图及统计分析。两组间数据分析用Student’sttest,多组间(≧3)用One-或Two-way ANOVA,事后分析用Tukey法检验,P<0.05为差异具有显著性。
2 结果
2.1 AGA小鼠模型建立及踝关节滑膜组织病理学观察
注射MSU后,模型小鼠右踝关节部位明显肿胀,且一直持续到48 h(图1A,1B)。模型小鼠患侧踝关节50%PWT明显降低,提示有机械痛超敏发生(P<0.01)。机械痛超敏反应在造模后24 h达到高峰,且一直持续到48 h(图1C)。上述现象与以往报道一致,提示造模成功[18-19]。对造模后24 h小鼠踝关节进行病理学切片和HE染色。HE染色结果显示模后24 h(图1D),AGA模型组小鼠患侧踝关节滑膜组织出现广泛炎性细胞浸润和增生(P<0.01)。
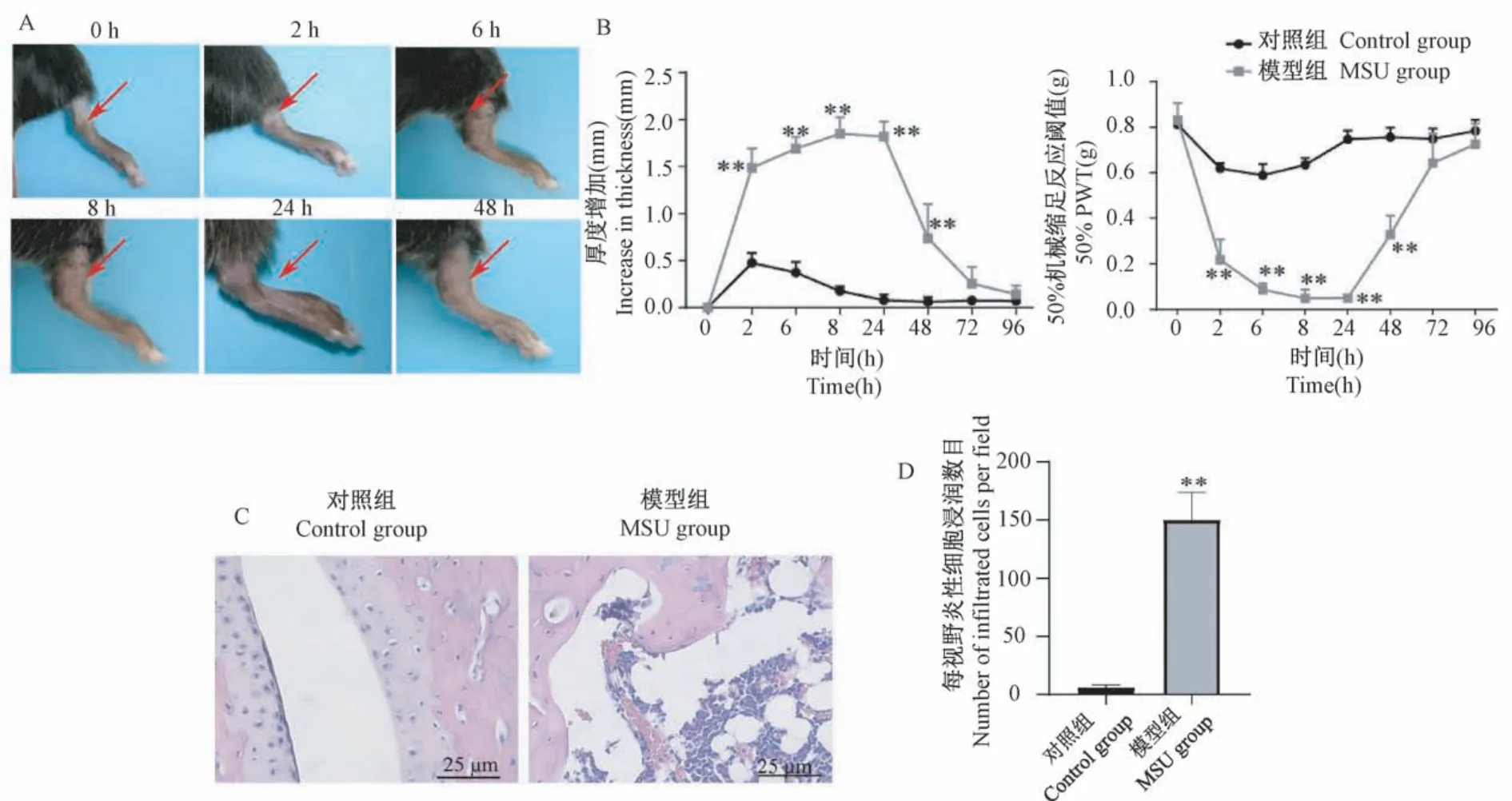
图1 小鼠造模后踝关节肿胀及机械缩足反应阈值变化情况(n=6)Note.A.Representative pictures showing the swelling of the affected ankle joint at each time point before and after AGA model establishment.B.Time course indicating the changes of ankle joint swelling of control and MSU group.C.Time course showing the changes of 50%PWT of control and MSU group.D.Histopathological analysis of synovium of ankle joint 24 h after AGA model establishment.Compared with control group,**P<0.01.Figure 1 Changes of paw withdrawal threshold and ankle joint swelling before and after AGA model establishment in mice(n=6)
2.2 奥替普拉对AGA小鼠踝关节肿胀和疼痛的疗效观察
分别设立对照组、模型+溶剂组(MSU+Veh)和模型+奥替普拉组(MSU+Oltipraz)。模型+奥替普拉组:在造模前及模后5、23、47 h腹腔注射奥替普拉(30 mg/kg或100 mg/kg,40μL注射体积)。模型+溶剂组:同一时间点腹腔注射相应溶剂。模型+吲哚美辛组:同一时间点腹腔注射吲哚美辛(10 mg/kg)。图2A为奥替普拉给药及机械痛测定时间点示意图。用von-Frey丝检测0、2、6、8、24、48 h时间点各组小鼠患侧机械痛阈。腹腔注射奥替普拉后,相较于模型+溶剂组小鼠,模型+奥替普拉组小鼠50%PWT在各个时间点均出现显著上升,且踝关节肿胀程度出现显著降低(图2B)(P<0.01)。上述结果提示,奥替普拉对AGA模型小鼠踝关节肿胀和疼痛具有明显治疗作用。
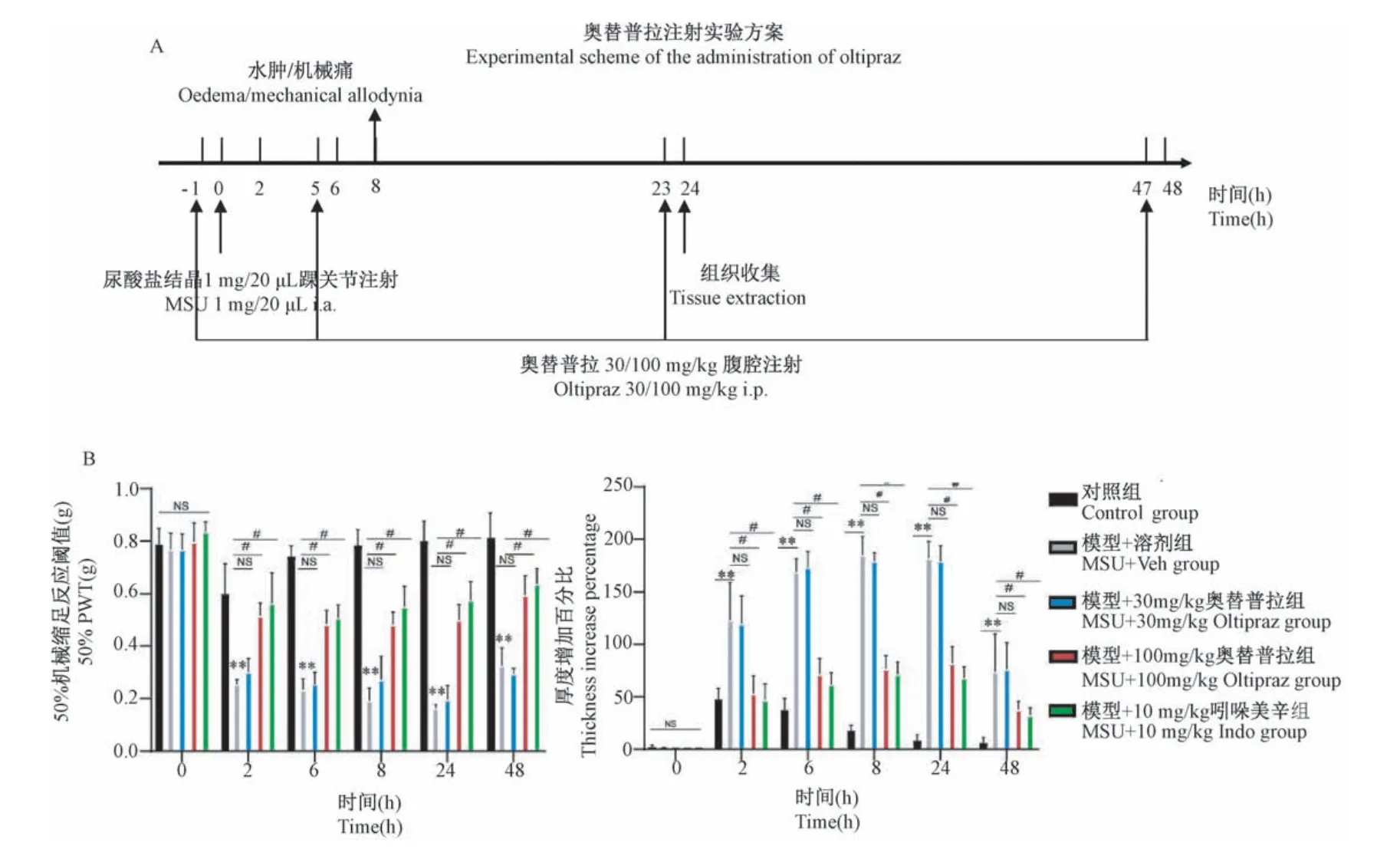
图2 奥替普拉对AGA模型小鼠踝关节肿胀和机械痛痛阈的治疗作用(n=6)Note.A.Experimental scheme of the administration of oltipraz.B.Time course showing the effect of oltipraz on 50%PWT and ankle joint swelling of control、MSU+Veh、MSU+30/100 mg/kg Oltipraz and MSU+10 mg/kg Indo group.Compared with control group,*P<0.05,**P<0.01.Compared with MSU+Veh group,#P<0.05.(The same in the following figures and table)Figure 2 Therapeutic effects of oltipraz on ankle joint swelling and mechanical pain threshold of AGA model mice(n=6)
2.3 奥替普拉对AGA模型小鼠步态行为学治疗作用
利用步态仪对模后24 h小鼠步态行为学进行研究。如图3A所示,发现与对照组相比,模型组小鼠步态行为学出现显著改变,即患侧足底相较于健侧足爪面积(paw area)显著减少。进一步分析发现,模型组小鼠步幅长度(stride length)也显著减少(P<0.01)。这一结果提示,AGA模型小鼠表现出明显的步态行为学改变。但相较于模型+溶剂组小鼠,模型+100 mg/kg奥替普拉组小鼠在步态仪上所表现的脚爪触地面积以及步幅长度指标均出现显著改善(P<0.05)。图3B显示的是上述参数的统计结果。这一结果提示,奥替普拉可显著改善AGA模型小鼠步态行为学的改变。
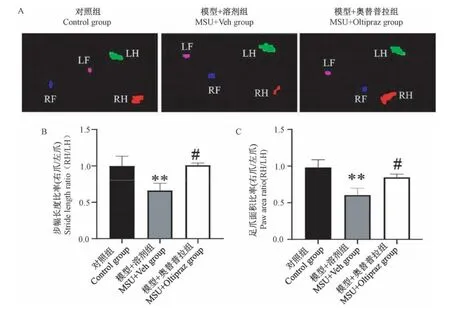
图3 奥替普拉对痛风小鼠步态行为学的干预作用(n=6)Note.A.Gait imaging of control,MSU+Veh and MSU+100 mg/kg Oltipraz group mice 24 h after the model.B.Summary of the gait parameters.Figure 3 Therapeutic effects of oltipraz on gait behavior of AGA model mice(n=6)
2.4 奥替普拉对AGA模型小鼠踝关节氧化应激反应的干预作用
氧化应激反应在介导AGA炎症与疼痛中具有重要作用[9,18-19]。因此,为了探讨奥替普拉对AGA模型小鼠患侧踝关节疼痛和炎症作用的治疗机制,我们进一步研究了奥替普拉对模型小鼠患侧踝关节氧化应激反应的干预作用。提取模后24 h小鼠患侧踝关节组织进行氧化应激分子检测。如表1所示,与对照组相比,模型+溶剂组小鼠踝关节组织中SOD和GSH含量均显著下降(P<0.05,P<0.01),而氧化应激产物MDA的含量明显上升(P<0.05,P<0.01)。提示模型+溶剂组小鼠患侧踝关节组织中出现明显氧化应激反应。与模型+溶剂组相比,模型+100 mg/kg奥替普拉组小鼠患侧踝关节组织中SOD和GSH含量出现显著恢复(P<0.01),且MDA水平显著下降(P<0.05)。以上结果表明奥替普拉可有效降低AGA模型小鼠患侧踝关节组织中氧化应激反应水平。
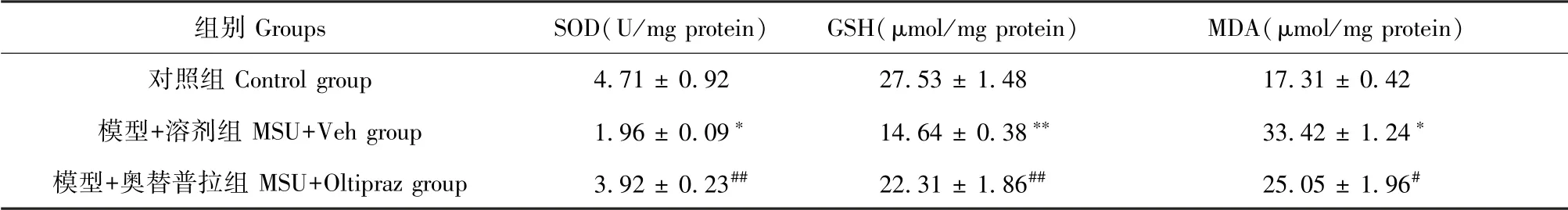
表1 各组小鼠患侧踝关节组织中氧化应激相关分子水平的变化(n=6)Table 1 Changes of the levels of oxidative stress-related molecules in ipsilateral ankle joint tissues of mice in each group(n=6)
2.5 奥替普拉对AGA模型小鼠踝关节组织中炎症因子表达的干预作用
如图4A,4B所示,模后24 h,相比对照组,模型+溶剂组小鼠患侧踝关节组织中炎症因子IL-1β和TNF-αmRNA表达出现显著升高(P<0.05)。经奥替普拉治疗后,相较模型+溶剂组,模型+100 mg/kg奥替普拉组小鼠患侧踝关节组织中IL-1β和TNF-α mRNA表达显著下降(P<0.05)。上述结果提示奥替普拉可有效减少AGA模型小鼠患侧踝关节组织中炎症因子过表达。
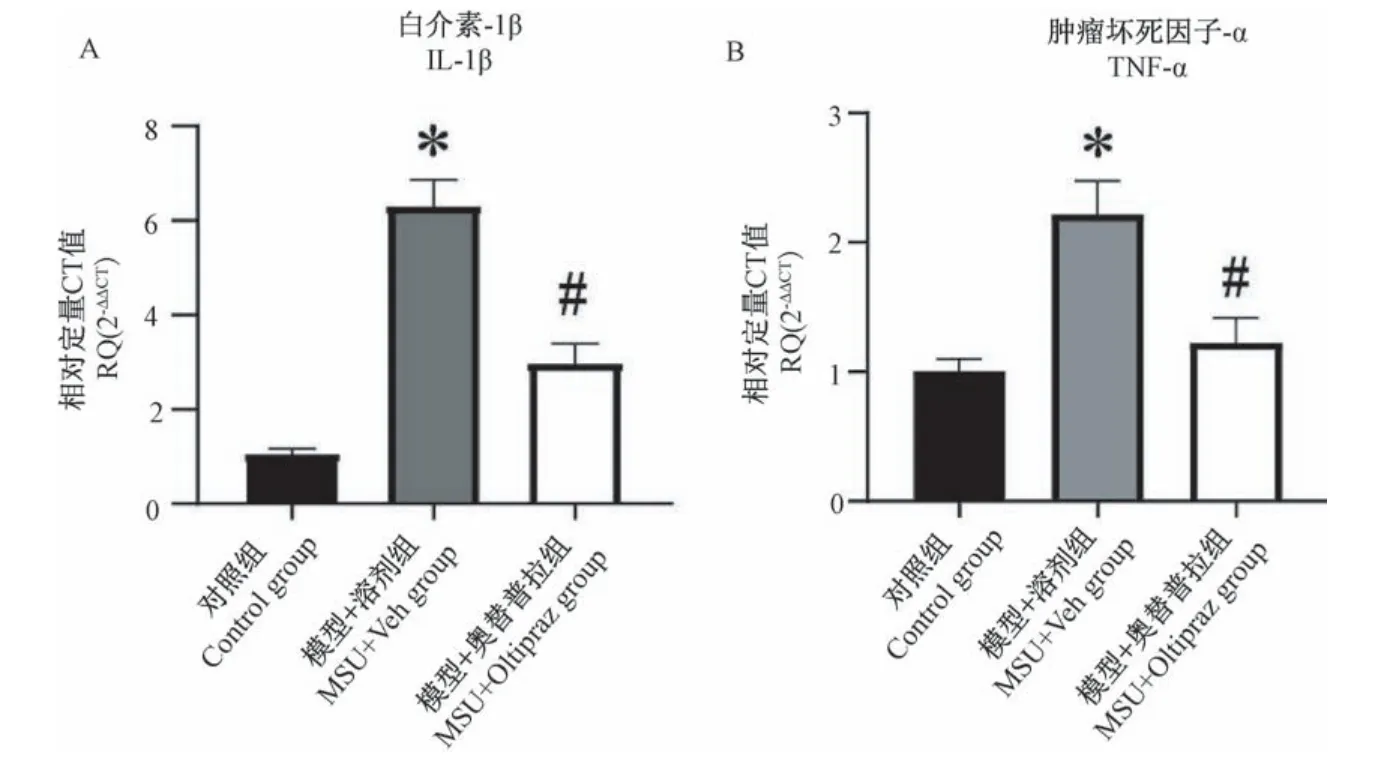
图4 奥替普拉对AGA模型小鼠患侧踝关节组织中炎症因子表达的干预作用(n=6)Note.Indicated the expression of inflammatory cytokines in ankle joint tissues of 3 groups of mice.Figure 4 Therapeutic effects of oltipraz on the expression of inflammatory cytokines in ankle joint tissues of AGA model mice(n=6)
3 讨论
AGA起病急骤,可导致患者关节部位出现红、肿、热、痛和运动功能障碍,往往历时数天或数周才逐渐缓解。患者关节部位往往出现似刀割、咬噬样剧痛,严重影响生活质量。目前临床针对AGA治疗的主要药物为秋水仙碱、非甾体抗炎药和糖皮质激素。但长期服用这些药物往往导致诸多不良反应,包括胃肠道不适、溃疡、肝肾损害、神经毒性和免疫抑制等。因此,寻找对AGA有效的治疗药物具有十分重要的临床意义。
在本研究中,首先利用向踝关节注射MSU的方法制备了小鼠AGA模型。发现AGA模型小鼠患侧肢体表现出明显且持续的机械痛超敏症状及踝关节肿胀。这些现象与以往报道及我们近期的研究结果相一致[12,20-21],提示造模成功。众所周知,AGA患者由于关节肿胀和疼痛,往往表现出步态行为改变。因此,继续利用DigiGait步态观测系统对模型小鼠进行步态检测。通过在透明跑步带下方对动物步态行为进行实时录像,并进行量化和分析后[22],发现,相较对照组小鼠,AGA模型组小鼠在步态行为学上表现出明显的步态摆动时间延长,脚爪触地面积和步幅长度减小的现象[23]。这一结果提示AGA模型小鼠表现出显著的步态行为学变化。
接下来,研究了Nrf2特异性激动剂奥替普拉对AGA模型小鼠踝关节抗炎和镇痛效应。近年来有研究显示,奥替普拉可通过激活体内Nrf2/HO-1抗氧化系统,缓解动物模型炎性痛和神经病理痛[16,24]。但奥替普拉能否对AGA发挥治疗作用还有待探索。在本实验中,发现100 mg/kg奥替普拉能有效缓解AGA模型小鼠踝关节疼痛症状且减少患侧踝关节肿胀程度,并显著改善模型小鼠步态行为学相关参数改变。
近期研究结果发现氧化应激反应在介导AGA炎症与疼痛中具有重要作用[18-19]。因此,继续探讨了奥替普拉对AGA模型小鼠踝关节氧化应激反应是否发挥干预作用。发现AGA模型小鼠患侧踝关节组织中抗氧化物质SOD和GSH水平下降,而氧化应激反应产物MDA的含量显著升高,提示AGA模型小鼠踝关节局部出现显著氧化应激反应。而给予奥替普拉后,可显著提高AGA模型小鼠患侧踝关节组织中SOD和GSH水平,并减少MDA含量,从而降低氧化应激反应水平。此外,还进一步发现奥替普拉可显著降低AGA模型小鼠患侧踝关节组织中炎症因子IL-1β和TNF-α过表达。因此推断,奥替普拉改善AGA模型小鼠踝关节炎症和疼痛症状的效应,很可能是通过抑制踝关节部位氧化应激反应水平和炎症因子过表达来实现的。
综上所述,本研究发现奥替普拉对AGA模型小鼠踝关节炎症和疼痛症状有治疗效果。奥替普拉的治疗效果很可能与其抑制踝关节部位氧化应激反应水平和炎症因子的过表达有关。但奥替普拉在AGA情况下所发挥的抗氧化应激活性和抗炎活性的详细机制还有待进一步研究。奥替普拉作为治疗AGA的崭新药物值得进一步进行相关的基础和临床研究。

