背根神经节P2X3受体表达上调在糖尿病神经痛中的作用
陈卢杭费雪瑜康玉蓉王涵芝瞿思颖李想何晓芬方剑乔*蒋永亮*
(1.浙江中医药大学第三临床医学院康复医学院,杭州 310053;2.浙江省针灸神经病学研究重点实验室,杭州 310053;3.浙江中医药大学针灸研究所,杭州 310053)
糖尿病神经痛(diabetic neuropathic pain,DNP)是糖尿病患者最常见的慢性并发症之一,以刺激诱发性疼痛和自发性疼痛为主要表现,发作时疼痛剧烈,严重影响患者生存质量[1]。DNP临床多见于糖尿病发展晚期,约10%~26%的糖尿病患者深受该并发症的困扰[2]。DNP患者的临床治疗往往采用普瑞巴林、杜洛西汀和阿片类药物等,但此类药物作用有限,且长期服用往往伴随着严重的副作用[3],因此更好地阐明DNP的基本机制是目前亟待解决的问题。
P2X3属于嘌呤信号受体家族成员之一,在最近几年的报道中,炎症及神经损伤后体内P2X3表达上调[4],阻断P2X3或敲低P2X3可逆转异常性疼痛[5]。P2X3在外周背根神经节(dorsal root ganglion,DRG)神经元中往往表达于中小直径神经元上[6]。已有研究表明,糖尿病神经痛敏化的发生和维持与DRG神经元兴奋性增强密切相关[7]。P2X3可能是神经性疼痛新型的潜在治疗靶标,但在糖尿病神经痛中的作用还鲜见报道。
链脲佐菌素(STZ)是一种可以选择性破坏胰岛β细胞的抗生素。STZ被广泛用于建立I型糖尿病动物模型[8]。相对于通过其他方式,如遗传诱导1的自发性糖尿病或高脂饮食(HFD)结合低剂量STZ创建的糖尿病动物模型,STZ诱导的糖尿病动物模型由于其便利性和较低的成本,得到了广泛的应用[9-11]。因此,为了进一步探究背根神经节P2X3在DNP模型中的作用,本实验通过单次大剂量腹腔注射STZ(65 mg/kg)建立糖尿病神经痛大鼠模型,在STZ注射后7、14、21 d采用免疫荧光技术检测P2X3的表达,并观察其拮抗剂TNP-ATP对糖尿病神经痛大鼠的干预效应,以期为临床DNP患者的治疗提供新的思路与靶标。
1 材料与方法
1.1 材料
1.1.1 实验动物
45只6周龄清洁级雄性SD大鼠,体重(190±15)g,购买于上海斯莱克实验动物有限责任公司【SCXK(沪)2017-0005】,由浙江中医药大学实验动物中心【SYXK(浙)2018-0012】饲养。饲养环境:昼夜周期12 h/12 h,温度恒定,湿度恒定。所有实验均符合浙江中医药大学实验动物伦理学要求(伦理审批号:IACUC-20180723-08)。
1.1.2 主要试剂与仪器
链脲佐菌素STZ(S0130,美国Sigma);P2X3抑制剂TNP-ATP(2464,美国Tocris);兔抗P2X3(APR-002,以色列Alomone);Alexa Fluor 488驴抗兔IgG H&L(ab150065,美国Abcam);动态足底测痛仪(意大利UGO BASILE,37450);冷冻切片机(NX50,德国Thermo);罗氏卓越型血糖仪(Roche ACCUCHEK Performa);A1R共聚焦显微镜(A1R,日本Nikon)。
1.2 方法
1.2.1 糖尿病模型大鼠造模
禁食16 h后,对模型组大鼠予以一次性腹腔注射STZ溶液,按照65 mg/kg的剂量进行注射,于0.1 mmol/L的柠檬酸/柠檬酸钠缓冲液中溶解STZ,并将溶液的PH值调整为4.5,所有溶液当天使用。在STZ注射后第7天,禁食8 h,对大鼠进行尾静脉采血从而测定其血糖水平,糖尿病模型建立成功的纳入标准为空腹血糖水平大于16.7 mmol/L。
1.2.2 实验分组与实验干预
本实验主要分两部分进行:(1)在20只实验大鼠中选取14只作为实验组,对其进行禁食16 h后腹腔注射STZ,剩余大鼠注射柠檬酸钠/柠檬酸缓冲液进行对照。观察大鼠STZ注射前(Base)、注射后7、14、21 d PWT情况,并取大鼠L4-L6 DRG进行免疫荧光法测试,检测其各时间点P2X3受体阳性细胞表达率。(2)取25只健康雄性SD大鼠,随机分为正常+生理盐水(Control+NS,n=6)组和STZ腹腔注射组(n=19),剔除1只未成模大鼠后,将18只造模成功的DNP大鼠随机分为模型+生理盐水(DNP+NS,n=6)组、模型+50 nmol P2X3抑制剂TNP-ATP组(DNP+50 nmol TNP-ATP,n=6)和模型+100 nmol P2X3抑制剂TNP-ATP组(DNP+100 nmol TNP-ATP,n=6)。观察50 nmol与100 nmol TNP-ATP或NS干预前和干预后0.5、1、1.5 h PWT,同时观察50 nmol与100 nmol TNP-ATP连续注射7 d后PWT变化情况。
1.2.3 机械痛阈检测
检测方法:将大鼠于测量前置于塑料盒进行适应,待到大鼠安静后进行测量。取大鼠左侧后足进行机械痛觉刺激。对准大鼠左后足中央启动仪器,金属针以恒定速度上行,刺激力度逐渐递增直至大鼠缩足。检测每隔5 min进行1次,每只大鼠进行5次测试,去掉最大值与最小值后计算平均数。
1.2.4 免疫荧光法检测DRG神经元上P2X3受体阳性细胞表达
使用戊巴比妥(80 mg/kg)麻醉大鼠,使用生理盐水对大鼠主动脉进行灌注至肝变白,再使用4%多聚甲醛进行灌注,取出L4-L6 DRG后使用蔗糖溶液梯度脱水,液氮冷冻后置于-80℃冰箱保存。使用OCT包埋,行10μm厚度的冰冻切片。使用TBST漂洗3次,将样本放置于含兔抗P2X3(1∶800)的TBST溶液中进行孵育,次日复温。加入驴抗兔IgG H&L(1∶800)进行孵育后漂洗,后转移至载玻片封片。每组选择3只大鼠,每只大鼠L4-L6 DRG每个节段取3~5张切片,使用激光共聚焦显微镜取得图像,使用Image J图像软件进行分析,并计算阳性细胞个数。
1.2.5 药物干预
将TNP-ATP溶于生理盐水中,干预方式参照文献的方法[11-12],在大鼠左后足足背行药物注射,DNP+50 nmol TNP-ATP大鼠注射量为50 nmol,DNP+100 nmol TNP-ATP大鼠注射量为100 nmol,注射体积为50μL;连续7 d注射药物量同上。Control+NS组和DNP+NS组大鼠注射等体积生理盐水。
1.3 统计学分析
结果用平均值±标准误(±s¯x)表示。所有数据均用GraphPad Prism 5和SPSS 19.0软件处理,多组间使用单因素ANOVA分析,两组间使用独立样本t检验。以P<0.05表示具有统计学意义。
2 结果
2.1 糖尿病模型的建立
使用STZ腹腔注射建立糖尿病大鼠模型,模型组大鼠在STZ注射7 d后较正常组空腹血糖显著升高(P<0.01),并维持到第21天(见图1)。
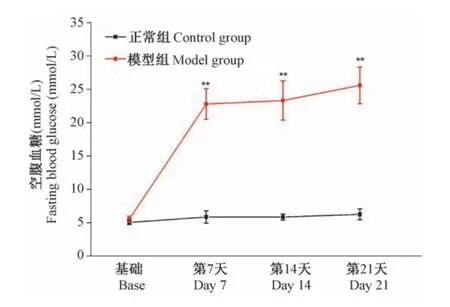
图1 模型组与正常组大鼠不同时间点空腹血糖(n=6)Note.Compared with the control group,**P< 0.01.(The same in the following figures)Figure 1 Fasting blood glucose at different time points in model and control rats(n=6)
2.2 各时间点机械痛阈变化情况
模型组与正常组比较,PWT在STZ注射前无显著性差异(P>0.05);同时,两组在STZ注射后第7天PWT仍无明显差异(P<0.05);STZ注射后第14天和第21天模型组PWT较正常组大鼠降低(P<0.01)(见图2)。
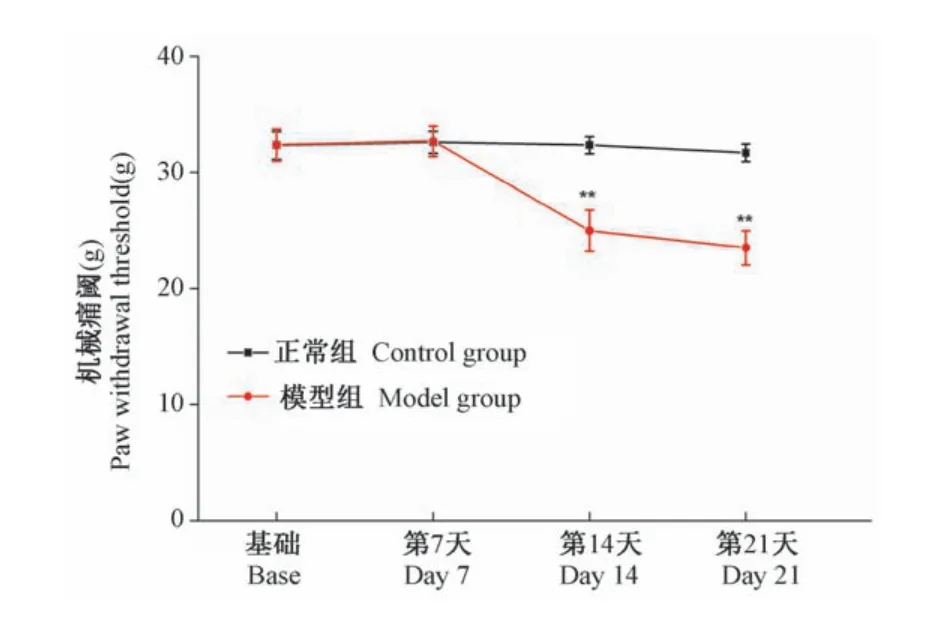
图2 模型组与正常组大鼠不同时间点机械痛阈变化情况(n=6)Figure 2 Changes of PWT in model group and control group rats at different time points(n=6)
2.3 各时间点不同大鼠P2X3阳性细胞表达情况
与正常组比,STZ注射第7、14、21天后大鼠L4、L5 DRG上P2X3阳性细胞数明显增多(P<0.01),STZ注射第14、21天后大鼠L6 DRG上P2X3阳性神经元数目明显增多(P<0.01)(见图3)。
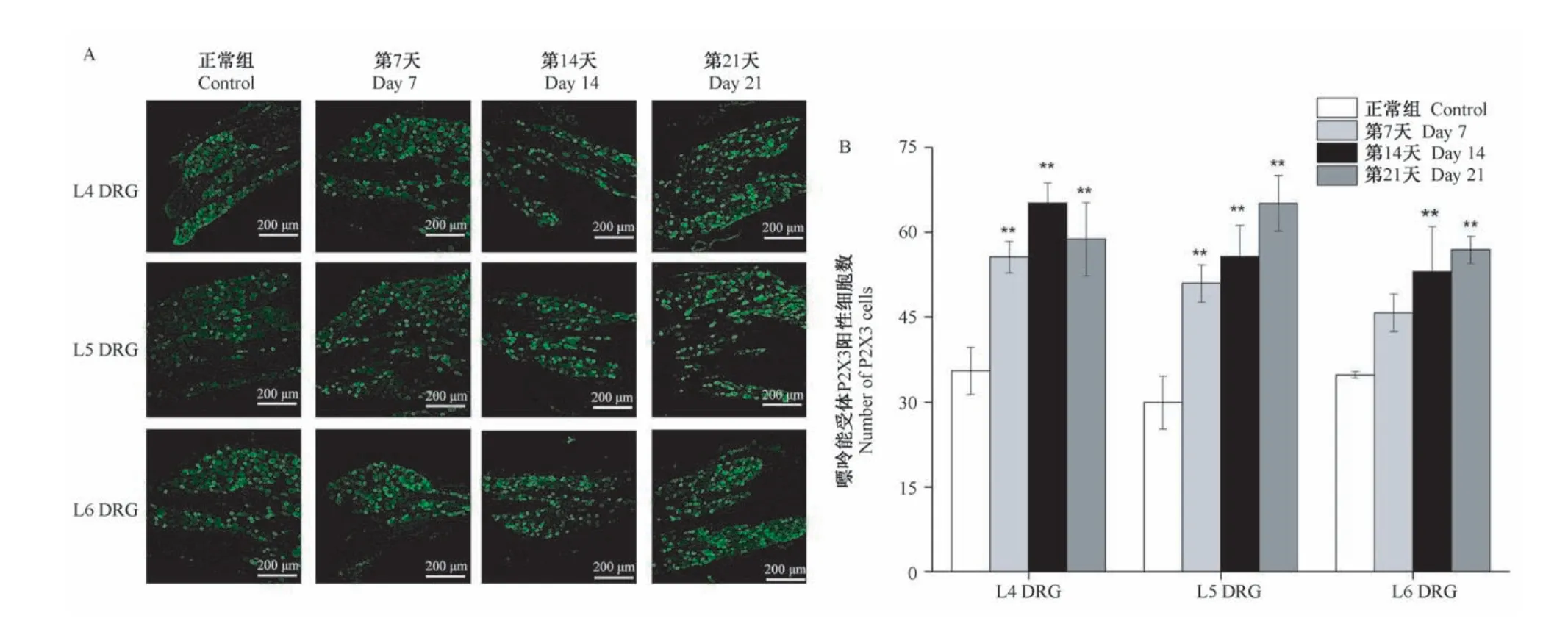
图3 模型组大鼠L4-L6 DRG上P2X3表达情况和阳性细胞数统计结果(n=3)Figure 3 P2X3 expression on L4-L6 DRG and statistical results of positive cells in model group rats(n=3)
2.4 单次注射TNP-ATP对DNP大鼠模型的镇痛作用
为了探究TNP-ATP是否可以有效缓解糖尿病神经痛,在第15天给予单次TNP-ATP(50、100 nmol)。在TNP-ATP注射前(0 h)、注射后0.5、1、1.5 h进行机械缩爪阈值测试(见图4)。与溶剂对照组相比,以50 nmol的剂量注射TNP-ATP对PWT无明显改善。但是,以100 nmol的剂量注射TNPATP可以显著增加大鼠PWT,表明了TNP-ATP对DNP大鼠糖尿病神经痛有作用。PWT的上调在0.5 h开始且达到峰值,并持续至少1 h。
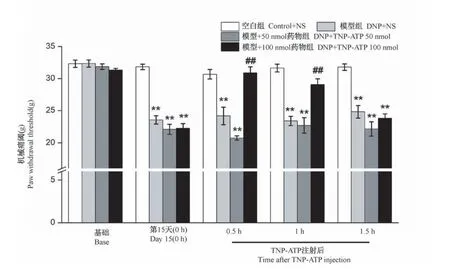
图4 单次注射TNP-ATP对DNP大鼠机械痛阈的影响(n=6)Note.Compared with the control+NS group,**P<0.01.Compared with the DNP+NS group,##P<0.01.(The same in the following figure)Figure 4 Effect of TNP-ATP Single injection on PWT in DNP rats(n=6)
2.5 多次注射TNP-ATP对DNP大鼠模型的镇痛作用
为了确定TNP-ATP重复治疗是否对DNP大鼠具有镇痛作用,从第14天到第21天每天给予TNPATP(50、100 nmol),连续7 d。如图5所示,每日1次,重复注射7次TNP-ATP(100 nmol)可明显提高DNP大鼠的PWT。同时,与溶剂对照组处理的DNP大鼠相比,重复给予低剂量的TNP-ATP(50 nmol)的DNP大鼠PWT无明显变化。

图5 单次注射TNP-ATP对DNP大鼠机械痛阈的影响(n=6)Figure 5 Effect of TNP-ATP Multiple injection on PWT in DNP rats(n=6)
3 讨论
高血糖所引发的糖尿病周围神经病变发病中的细胞和分子机制仍未完全阐明,但大量文献证实,高血糖会导致周围神经末梢受损,导致糖尿病患者的长期疼痛。在这项研究中,以大鼠作为模型动物研究了P2X3的表达对糖尿病神经病理痛各个阶段的影响。结果显示,单次大剂量的STZ注射可诱导大鼠出现1型糖尿病症状。大鼠在STZ注射后14 d,出现明显的DNP症状,即疼痛的超敏行为,如机械性异常性疼痛[13-15],同时伴有DRG中P2X3表达升高。我们发现P2X3非特异性拮抗剂TNP-ATP可抑制DNP机械痛觉超敏反应。综上所述,这些发现表明DNP可能是由背根神经节P2X3表达升高所介导的。
目前人们已使用了多种不同的方法建立DNP动物模型。例如,自发性糖尿病动物,如WBN/Kob大鼠和Ins2 Akita小鼠[16-17];或遗传缺陷导致的糖尿病模型,如C57BL/Ks(db/db)小鼠模型[18];以及高脂高糖饮食或药物(四氧嘧啶或STZ)诱导的糖尿病动物[19-21]。然而,STZ诱发的糖尿病操作简单,价格低廉,所以被广泛用于糖尿病模型建立。小鼠,大鼠和猴子等动物体内胰腺β细胞对STZ刺激相当敏感,无论是腹膜内(I.P.)或静脉内(I.V.)注射STZ均可对胰腺β细胞具有直接的细胞毒性,因此它们是诱导1型糖尿病的首选[22-23]。因此,通过单次腹腔注射大剂量STZ(65 mg/kg)建立了1型糖尿病大鼠模型。STZ注射后,大鼠空腹血糖升高和PWT降低表明成功建立了DNP大鼠模型。
之前已有多项研究表明P2X3活化参与了神经病理痛[24-25],P2X3受体高选择性大量地表达于处理痛觉信息的DRG中小直径神经元上,激活后可使Ca2+、Na+内流,K+外流,广泛参与痛信号产生、传导和痛敏化调制,在多种神经痛敏化中起着重要作用[26]。由于P2X3对极低浓度的ATP敏感,因此可以使用不同的ATP浓度来调节嘌呤能信号转导[27]。ATP通过改变感觉神经元电压门控离子通道活性(包括CaV和NaV)来调节疼痛敏感性[28-29],TNP-ATP是ATP的结构类似物,其重要作用位点广泛分布于P2X1~P2X4受体[30],可竞争性结合于P2X3受体细胞外ATP结合位点,其抑制作用起效快、可逆,且不表现出使用依赖性,是理想的P2X3受体抑制剂[31]。
在本研究中,发现模后7 d时,DRG中P2X3表达有一定程度增多,而此时大鼠痛阈并未出现明显变化;而模后14~21 d,随着P2X3表达逐渐增加,外周敏化逐渐形成,大鼠PWT明显下降。同时,发现较低剂量的TNP-ATP无法缓解STZ诱导的糖尿病大鼠的机械痛觉超敏反应,而当施用高剂量TNPATP时,却可有效的缓解疼痛,说明P2X3可能参与了大鼠糖尿病神经病理痛。
综上所述,腹腔注射STZ可成功诱导DNP大鼠模型,背根神经节P2X3表达上调可能参与糖尿病神经痛形成,为DNP的临床治疗提供了崭新的策略与思路。

