脊髓A1型星形胶质细胞在外周炎性痛中的动态变化
李倩李玲玲李爽黄楚天周君梅
(上海市儿童医院,上海交通大学附属儿童医院中心实验室,上海 200040)
外周炎性痛是外周局部组织炎性病变或损伤时引起的疼痛不适[1]。长期的炎性痛限制肢体活动、干扰患者情绪,严重影响患者生活质量。
炎性痛的神经机制复杂,外周伤害性信号沿感觉传入神经持续传入中枢,可使脊髓内产生以胶质细胞激活、促炎性细胞因子升高为特征的神经炎症反应,引起神经元敏化,疼痛信号级联放大,导致感觉超敏与痛觉过敏等异常[2]。星形胶质细胞作为中枢神经系统内数量最多的一类细胞,对神经炎症的发生发展至关重要。当外周受到伤害性刺激时,脊髓星形胶质细胞可被激活,数量增生、形态肥大,称为反应性星形胶质细胞[3]。最新研究表明反应性星形胶质细胞可向A1和A2两种不同的表型极化,A1型星形胶质细胞可分泌促炎性细胞因子,诱导神经炎症以及神经元功能损害,具有神经毒性;A2星形胶质细胞可分泌神经营养因子,促进神经元和组织修复,具有神经保护性[4]。但在外周炎症导致的炎性痛过程中,脊髓A1、A2两种反应性星形胶质细胞的动态变化,尚不清楚。本研究旨在探讨脊髓A1、A2型星形胶质细胞在炎性痛小鼠脊髓中的动态变化,为进一步阐明外周炎性痛的机制提供可能线索。
1 材料与方法
1.1 材料
1.1.1 实验动物
34只6~8 周龄成年雄性清洁级C57BL/6小鼠,体重25~30 g,由上海灵畅生物科技有限公司提供【SCXK(沪)2018-0003】。实验动物由上海交通大学实验动物科学部饲养【SCXK(沪)2018-0021】,昼夜各半循环照明,湿度恒定,温度控制在22~25℃。所有操作均符合上海交通大学附属儿童医院实验动物管理及伦理委员会要求(审批号:LLSC2020074)。
1.1.2 主要试剂与仪器
CFA(F5881-10 mL,Sigma);GFAP抗体(MAB360,MERCK);C3抗体(ab200999,Abcam);FITC-donkey anti mouse抗体(715-095-150,Jackson);Cy3-donkey anti rabbit抗体(711-165-152,Jackson)。von Frey弗莱毛(Stoelting,美国);IITC热辐射痛觉测量仪(Life Science Instruments,美国);ND2000自动分光光度计(Thermo,美国);荧光实时定量PCR仪(Roche,瑞士)激光共聚焦显微镜(Leica,德国)。
1.2 方法
1.2.1 模型建立
外周炎性痛小鼠模型制备:抓取小鼠右后爪,足底注射完全弗氏佐剂20μL。对照组小鼠足底注射相同体积的生理盐水。
1.2.2 动物分组与给药方法
将16只小鼠随机分为足底炎性痛组(CFA组)和对照组(Saline组),每组8只。
1.2.3 行为学实验
分别在造模前1 d、造模后第1、3、5、7天测定小鼠的机械刺激缩足阈值(mechanical withdraw threshold,MWT)和辐射热刺激缩爪潜伏期(paw withdrawal latency,PWL)。MWT具体方法如下:将动物放在铺有铁丝网的塑料笼中,并在测试前连续2~3 d使其适应。在测试日,将小鼠置于笼中适应至少30 min。然后,在测试过程中使用von Frey弗莱毛(0.02、0.04、0.07、0.16、0.4、0.6、1.0和1.4 g)垂直刺激后爪的足底正中。采用Dixon介绍的Up-and-Down法计算小鼠的50%MWT[5]。PWL具体方法如下:将小鼠分别放置在铺有玻璃板的透明塑料笼中,连续2~3 d的适应期。在测试前1 d禁水,测试当天适应至少30 min后,将辐射热隔玻璃板施加到后爪足底表面,直到小鼠将其爪子从玻璃板上抬起。缩爪潜伏期为从施加辐射热开始到小鼠缩爪的时间,截止时间设置为20 s[6]。
1.2.4 用免疫荧光法测定脊髓GFAP、C3表达
分别在造模前以及造模后第7天各取材3只小鼠,采用1%戊巴比妥钠50 mg/kg腹腔注射麻醉后灌流固定取材,取脊髓腰膨大段组织,经20%及30%蔗糖梯度脱水沉底后,进行冰冻切片。脊髓切片采用漂片法进行免疫荧光染色,依次进行封闭、一抗孵育4℃过夜(抗GFAP一抗1∶800,抗C3一抗1∶200)、漂洗、荧光二抗37℃孵育1 h(FITC或Cy3标记的二抗1∶300)、封片,激光共聚焦显微镜观察采集结果。
1.2.5 用RT-PCR法检测星形胶质细胞标志物表达
分别在造模前以及造模后第1、3、7天,每个时间点取材3只小鼠,采用1%戊巴比妥钠50 mg/kg腹腔注射麻醉后新鲜取材脊髓腰膨大段组织,采用RNA提取试剂盒提取脊髓组织的总RNA。用分光光度计检测RNA浓度,取RNA 1μg采用逆转录实验将RNA逆转录成cDNA。
PCR 引 物: GFAP 上 游 引 物 5′-CACCTACAGGAAATTGCTGGAGG-3′,下游引物5′-CCACGATGTTCCTCTTGAGGTG-3′;Lcn2上游引物5′-ATGTCACCTCCATCCTGGTCAG-3′,下游引物5′-GCCACTTGCACATTGTAGCTCTG-3′;Serping1上 游引物5′-TTGCCTGTGTCCACCAAGCACT-3′,下游引物5′-GCTGCTTCCATACAGGCTCTGA-3′;H2-T23上游引物5′-GTGGCTCCATAGATACCTACGG-3′,下游引物5′-GGTGATGTCAGCAGGGTAGAAG-3′;S100a10上游引物5′-GACAAAGGAGGACCTGAGAGTG-3′,下游 引 物5′-CTCTGGAAGCCCACTTTGCCAT-3′;Ptx3上游引物5′-CGAAATAGACAATGGACTTCATCC-3′,下游引物5′-CATCTGCGAGTTCTCCAGCATG-3′。按照说明书,PCR反应体系中加入上下游引物,逆转录产物cDNA,以SYBR Green作为荧光标记物,进行实时定量PCR反应。结果以2-△△Ct表示靶基因的表达水平。
1.3 统计学分析
采用SPSS 12.0统计软件进行分析,计量资料以平均值±标准误(±s¯x)表示,行为学数据分析采用双因素方差分析,分子实验数据采用t检验或单因素方差分析,组间多重比较采用Bonferroni检验,P<0.05为差异显著,具有统计学意义。
2 结果
2.1 CFA炎性痛小鼠行为学变化
使用雄性C57BL/6小鼠成功建立了CFA炎性痛小鼠模型。造模前CFA组与对照组小鼠MWT分别为(0.78±0.06),(0.76±0.04),二者无统计学差异(P>0.05)。造模后第7天,CFA组与对照组小鼠MWT分别为(0.24±0.06),(0.74±0.07)。与对照组相比,CFA组MWT在造模后第1、3、5、7天均具有显著性差异(P<0.05)。而对照组造模前以及造模后各时间点均无显著性差异(P>0.05)(见图1A)。
造模前CFA组与对照组PWL分别为(10.16±0.58),(10.33±1.01),二者无统计学差异(P>0.05)。造模后第1天CFA组小鼠造模侧PWL显著下降,造模后第7天,CFA组与对照组PWL分别为(3.59±0.58),(10.36±0.81)。与对照组相比,CFA组PWL在造模后第1、3、5、7天均具有显著性差异(P<0.05)。而对照组各时间点均无显著性差异(P>0.05)(见图1B)。
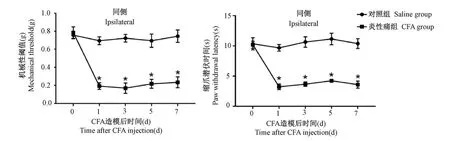
图1 CFA炎性痛小鼠机械刺激缩足阈值(MWT)和辐射热刺激缩爪潜伏期(PWL)变化(±s¯x,n=8)Note.Compared with Saline group,*P<0.05.Figure 1 Time course of the mechanical withdraw threshold(MWT)and the paw withdrawal latency(PWL)in mice treated with CFA or saline(±s¯x,n=8)
2.2 CFA炎性痛小鼠脊髓星形胶质细胞激活过程
RT-PCR实验发现,与造模前相比,CFA炎性痛造模后第3天脊髓内反应性星形胶质细胞标志物GFAP、Lcn2的mRNA相对表达水平分别为(1.84±0.10),(4.64±0.61),较造模前升高(P<0.05),造模后第7天,GFAP、Lcn2的mRNA相对表达水平分别为(2.05±0.20),(5.43±0.34),与造模前相比具有显著性差异(P<0.05)(见图2)。表明CFA炎性痛小鼠脊髓星形胶质细胞激活。
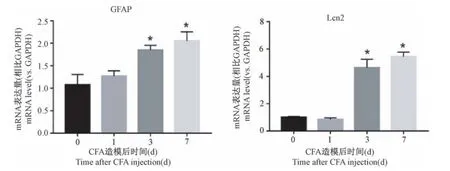
图2 CFA炎性痛小鼠脊髓反应性星形胶质细胞标志物GFAP、Lcn2表达变化(±s¯x,n=3)Note.Compared with D0,*P<0.05.(The same in the following figures)Figure 2 RT-PCR analysis showing the time courses in expression changes of the GFAP and Lcn2 in the spinal cord of CFA-treated mice(±s¯x,n=3)
免疫荧光实验发现,与造模前相比,CFA组造模后第7天脊髓背角GFAP信号水平显著升高,可以看到星形胶质细胞数量增多、形态肥大(见图3)。

图3 CFA炎性痛小鼠造模前及造模后第7天脊髓背角GFAP表达(n=3)Note.A’,B’.Partially enlarged picture of A and B.Figure 3 Confocal images show the GFAP immunoreactivity in the ipsilateral spinal dorsal horn of CFA-treated mice before and 7 days after CFA injection(n=3)
2.3 CFA炎性痛小鼠脊髓A1、A2型星形胶质细胞标志物表达变化
RT-PCR实验发现,CFA组造模后第7天脊髓内A1型星形胶质细胞标志物Serping1、H2-T23的mRNA相对表达水平分别为(2.54±0.12),(2.31±0.12),与造模前D0相比有显著升高(P<0.05,见图4A,4B)。A2型星形胶质细胞极化标志物S100a10、Ptx3的mRNA相对表达水平明显下降,且在造模后第7天分别为(0.57±0.15),(0.40±0.04),较造模前均有显著差异(P<0.05,见图4C,4D),提示CFA炎性痛小鼠脊髓反应性星形胶质细胞向A1亚型极化。

图4 CFA炎性痛小鼠脊髓A1型星形胶质细胞标志物Serping1、H2-T23以及A2型星形胶质细胞标志物S100a10、Ptx3表达变化(±s¯x,n=3)Figure 4 RT-PCR analysis showing the time courses in expression changes of the A1 astrocyte maker Serping1,H2-T23 and the A2 astrocyte maker S100a10,Ptx3 in the spinal cord of CFA-treated mice(±s¯x,n=3)
2.4 A1型星形胶质细胞标志物C3的表达
免疫荧光实验发现,CFA组在造模后第7天脊髓背角内A1型星形胶质细胞标志物C3相对荧光强度为(1.74±0.08),C3与GFAP的共定位信号相对荧光强度为(4.46±0.38),水平较造模前显著升高(P<0.05,见图5)。

图5 CFA炎性痛小鼠造模前与造模后第7天脊髓背角A1型星形胶质细胞标志物C3表达以及与GFAP共标变化(±s¯x,n=3)Note.C’,D’.Locally amplified C3 signal in frame C and D.C’,D’.Locally enlarged picture in frame C and D.Figure 5 Confocal images show the GFAP immunoreactivity(green)and C3(red)in the ipsilateral spinal cord dorsal horn of CFA-treated mice at D0 and D7 after injection(±s¯x,n=3)
3 讨论
外周炎性痛是最常见的临床症状之一,常伴发于局部损伤以及关节肌肉炎症等病理过程,持续存在的炎性痛,可干扰患者情绪,继发新的精神疾病[7]。CFA诱导的足底炎性痛具有造模简单、行为学稳定等优点,且疼痛持续时间可长达2月,是被广泛使用的炎性痛模型[8]。本研究发现,小鼠CFA注射后1 d,注射区域即出现明显充血、肿胀,在造模后第1、3、5、7天,造模侧PWL及MWT均显著降低,与对照组相比具有统计学差异,此结果与以往研究结果相一致[9]。
在慢性痛的发生发展中,脊髓内神经炎症是公认的病理机制之一[10]。星形胶质细胞与小胶质细胞激活生成的细胞因子、趋化因子可作用于神经元表面受体,使神经元兴奋性增高,促进痛行为维持[11]。有研究表明,炎性痛患者脑脊液中促炎性细胞因子水平升高,关节炎模型小鼠脊髓内胶质细胞激活[12-13]。在本研究中,CFA炎性痛小鼠在造模后第3天,脊髓内反应性星形胶质细胞标志物表达升高,而形态学结果显示背角星形胶质细胞增生肥大,进一步证实脊髓内存在星形胶质细胞激活。
在炎症等刺激下,反应性星形胶质细胞可向A1和A2两种不同的表型极化。A1型星形胶质细胞可释放伤害性信号分子,同时因其正常的吞噬、营养等功能降低,进而加剧了神经元的功能损害[14-15]。目前,关于A1型星形胶质细胞在神经退行性疾病中的报道最多,如阿尔茨海默病、帕金森病[16-17],而其在慢性痛中的相关报道比较有限。有研究发现,神经病理性疼痛模型大鼠脊髓背角中,A1型反应性星形胶质细胞明显增加[18]。本研究通过RT-PCR、免疫荧光等方法发现CFA小鼠脊髓内A1型星形胶质细胞标志物表达升高,表明炎性痛小鼠脊髓存在A1型星形胶质细胞极化。
关于诱导A1型星形胶质细胞极化的分子机制,目前有研究证实小胶质细胞激活后释放的IL-1α、TNF和C1q可在直接体外诱导星形胶质细胞激活并向A1表型极化[19]。除此以外,有研究在术后痛大鼠模型上证实,小胶质细胞可通过下调CXCR7/PI3K/Akt信号通路诱导脊髓反应性星形胶质细胞向A1表型极化[20]。而在本研究中所使用的CFA炎性痛小鼠模型,大量文献证实其在造模后早期即存在脊髓小胶质细胞激活[21]。炎性痛早期脊髓背角小胶质细胞被激活,促使星形胶质细胞激活并向A1型反应性星形胶质细胞极化,进而参与脊髓神经炎症反应,促进炎性痛的发生发展。提示,A1型星形胶质细胞可能成为外周炎性痛治疗的干预靶点。

