流式细胞术检测急性髓系白血病微小残留病的现状与进展
王 卉, 陈 曼
(河北燕达陆道培医院 检验科,河北 三河 065201)
流式细胞术(flow cytometry, FCM)是临床上检测急性髓系白血病(acute myeloid leukemia, AML)微小残留病(minimal residual disease, MRD)常用的技术之一,具有灵敏度高、覆盖率广等优点,已被用于复发预测和指导治疗方法选择[1-4]。但FCM检测AML MRD仍存在诸多难点和问题,如白血病细胞的复杂性、多样性、抗原漂移以及技术因素等[5-8]。本文结合国内外FCM检测AML MRD现状,提出解决上述问题对策、介绍新技术及临床实用性,有助于提高检测水平,促进FCM技术检测AML MRD临床应用。
1 FCM检测AML MRD现状及问题
FCM检测AML MRD经历20多年发展:①虽然仪器分类为4~20色,但是目前常用流式细胞仪为8~10色,建议做8色及以上方案[9-10];全光谱流式仪器在少数医院开始应用并初见成效;②建议使用白血病相关免疫表型(leukemia-associated immunophenotypes, LAIP)与正常表型差异性(different-from-normal, DFN)相结合的识别模式[9-15];③设计方案遵循骨架标志+常见异常表达标志原则,使用多标志设门[9-15];④为了保证灵敏度达到10-3~10-4, 样本获取至少活细胞20万, 最好白细胞在50万~100万[9-15],如果做白血病干细胞(leukemic stem cells, LSC)检测,获取活细胞400万~800万[16];⑤外周血比骨髓白血病负荷低,建议首选骨髓[9-10, 17]。为了避免外周血稀释,建议紧接形态的第一管做FCM[9-10];⑥脑脊液MRD阳性与不良预后有关,且FCM灵敏度高于细胞学,建议使用FCM法检测脑脊液[1, 18];⑦存在抗原漂移可能,不主张根据初治表型使用既定设门法[15, 19-20];⑧近年来免疫治疗等新技术的发展,在MRD检测同时,对于难治复发病例通过免疫表型检测,进行靶向治疗的靶点筛查;⑨随着免疫治疗后复发机制的研究,开始将肿瘤干细胞、免疫微环境、免疫检查点与MRD一起进行研究。即FCM检测AML MRD,从单纯实验室检查逐步扩展到治疗方案选择。在取得巨大进展,FCM成为临床上几乎所有AML患者随访必做检测项目同时,但是FCM检查MRD也面临一些问题。
1.1检测方案 一般使用CD45及髓系原始标志[CD34、CD117、HLA-DR和(或)CD33]作为骨架抗原,结合常见伴系标志(如CD7、CD56、CD2、CD19、CD4等)、异常获得标志[CD96、CD366(Tim3)等]、过早获得的成熟阶段标志(CD15、CD64、CD11b、CD11c、CD36、CD14等)、表达强度改变的髓系及早期标志(CD13、CD33、CD371、CD38、CD123、CD200等)[9-17]。各种异常的发生率和识别难易度是方案设计的依据[13-17]。有两种倾向,欧洲白血病网络(European Leukemia Net, ELN)[10]等选择固定的统一方案[3-4, 12-17];另一种为相对个体化方法,即固定骨架和必做标志,留出1~2个荧光通道,根据初治表型选做相应的LAIP标志[9]。
近年来AML LSC有进入MRD检测的趋势, 一般认为免疫表型为CD34+/CD38-/CD45RA+/CD123+或者CD34+/CD38+/CD45RA+/CD123+或者 CD45dimCD34+CD38-CD133+,其他标志有CD371(CLL1)、Tim3、CD7、CD11b、CD22、CD56等[10, 14, 21-23]。CD33、CD44、CD47、CD123、CLL1、Tim3等标志进入靶向治疗研究[21-22]。原发AML如果LSC比例高,提示预后不佳;不同AML的LSC异质性强, 且同一患者治疗过程中可能会改变[21]。免疫表型和遗传学有很强的相关性,成为个体化MRD检测的基础。见表1[12,24]。

表1 流式细胞术检测AML MRD标志与发生率
在所有血液肿瘤中,AML对于MRD检测几乎是难度最大,室间差异最大,甚至是室内不同检验医师之间差异性最大的项目,原因在于:①AML本身的异质性,包括多种亚型,亚型之间表型差异大,尤其是急性早幼粒细胞白血病和急性巨核细胞白血病,往往需要特殊的MRD方案;②同样亚型的AML,也经常存在异质性克隆,尤其是急性粒单细胞白血病和急性单核细胞白血病;③随着治疗进行,AML的抗原漂移发生率更高,而且缺乏规律性;④肿瘤之间表型异质性大,每种异常的覆盖率不高,造成很难用同一个方案高效检测大多数患者MRD,尤其是使用8色以下机型;⑤MRD是一个定期随访项目,国内收费限制一般做8色1~2管,8~16个标志,其中骨架(设门)抗体占据3~8个,导致形成组合有限[3, 5, 9];⑥初治往往在当地医院完成,可能检测的LAIP和DFN标志及组合有限,提供信息有限;⑦由于髓系标志在大量成熟细胞中也表达,AML往往不能使用系别标志设门,而CD34、CD117等早期标志设门的覆盖率不足90%,是AML漏诊的原因之一,尤其是单核细胞和巨核细胞白血病;⑧骨髓中正常存在髓系原始细胞,而AML细胞很多时候与正常细胞表型差异无统计学意义;⑨覆盖率高的DFN,往往是正常表达标志的荧光强度细微改变,以及标志组合造成的改变,而感染、药物、个体差异、抗体和组合的强度影响、标本质量、仪器稳定性等原因都会影响检测结果,人工分析情况下,经验性的依赖进一步增加检测精确度的变数。
1.2时间与阈值 多项研究表明,化疗早期(16~18 d)、1和2次诱导治疗后、巩固治疗后、移植前后(+28 d),FCM检测AML MRD对于选择治疗方法,判断预后有很大意义[2-5,8,15]。造血干细胞移植后6个月内MRD检测以每月1次为宜,半年后至2年每3个月1次为宜,此外,移植后任何时间如果怀疑患者疾病进展均可进行MRD检测[5]。关于阳性结果的定义,虽然ELN等选择0.1%作为阈值[4, 10, 16],但是低于此阈值也有预后意义[2, 15, 17]。因此,FCM检测AML MRD的灵敏度10-3~10-4甚至10-5,覆盖率90%[5, 8, 10]。LSC初治时阈值0.004%~0.03%, 随访阈值10-6[14,16]。
影响检测灵敏度和特异性的原因很多,对于不同的病例,采用统一阈值如0.1%并不恰当。①个体差异,LAIP和DFN标志多的患者,灵敏度可以达到10-4,甚至更高,而不表达早期标志,尤其是与正常髓系细胞表型重叠性高的AML,灵敏度可能连10-2都很难达到;②标本质量,增生差或者严重稀释的标本,容易出现假阴性;③检测者经验和能力也是影响检测结果的重要因素。因此,有些医院采用的是看到即报的原则。在报告描述中,如果是MRD比例极低或者总体原始细胞比例极低,或者细胞数极少、成熟淋巴细胞比例极高提示标本增生极差,或者粒细胞均为成熟阶段缺乏有核红细胞提示严重稀释等,会在报告中予以注明,这些因素可能会造成假阳性或者假阴性结果。
1.3方案合理性 AML中每种LAIP+DFN组合覆盖率均不高,为了达到覆盖率80%以上,经常需要做多管或者差异化方案。目前关于方案设门的观点:①尽量使用相对复杂的抗体组合去建立正常发育模式和抗原表达情况,DFN方案过于简单会使MRD与正常细胞重叠度高,导致假阴性;②尽量采用统一化方案,便于积累经验,使用多维软件回顾分析数据;③抗体克隆和荧光素会影响抗原表达强度,而伴系表达大多都是弱表达,尽量选择可信克隆和较强荧光素;④抗原漂移问题在AML中位发生率61%(10%~91%),且缺乏规律性[15, 19-20]。不能单纯根据初治免疫表型使用预设方案检测。
尽管如此,目前绝大多数医院虽然在抗体种类和设计的选择上相似度较高,但是组成方案差异很大。一些著名实验室的经验方案供参考[2, 4, 9, 12-14],见表2。

表2 几种急性髓系白血病微小残留病检测方案
1.4现状与挑战 MRD分析是对经验性分析最大的挑战,目前部分实验室还保留在使用CD45/侧向散射光(side scatter,SSC)设门的原始阶段;实验室会使用CD34/SSC设门,没有使用CD117/SSC做内对照,且只能报早期细胞比例,对没有表达CD7、CD19、CD56的细胞不进行判断;国内使用HLA-DR/CD45设门弥补CD34/SSC和CD117/SSC设门覆盖率低(70%~90%)缺陷的单位尚不多;使用标本内对照,进行细微DFN判断的能力有待加强。
解决方法:①CD45/SSC, CD34/SSC、CD117/SSC、CD45/HLA-DR同步设门,防止漏掉不表达一个或者更多早期标志的MRD(图1)。如果是罕见的类型,如巨核白血病,需要使用CD42a/CD45、CD61/CD45设门;②幼稚细胞门内尤其是CD117/SSC和(或)CD45/HLA-DR设门,可能同时存在正常和恶性髓系幼稚细胞,残留正常幼稚细胞是很好的DFN内对照,应该精确设门区分正常与白血病细胞(图1);③有些白血病细胞与正常细胞相似度极高,DFN改变很微妙,此时两种异常的组合会提高灵敏度,甚至使用软件做多维图(图2雷达图,图3 tSNE)。相同panel分析的组合越多,维度越多,得到的信息越多;④熟悉正常骨髓表达情况,包括增生的骨髓、不同时间点、药物与感染以及应激状态等因素影响等。
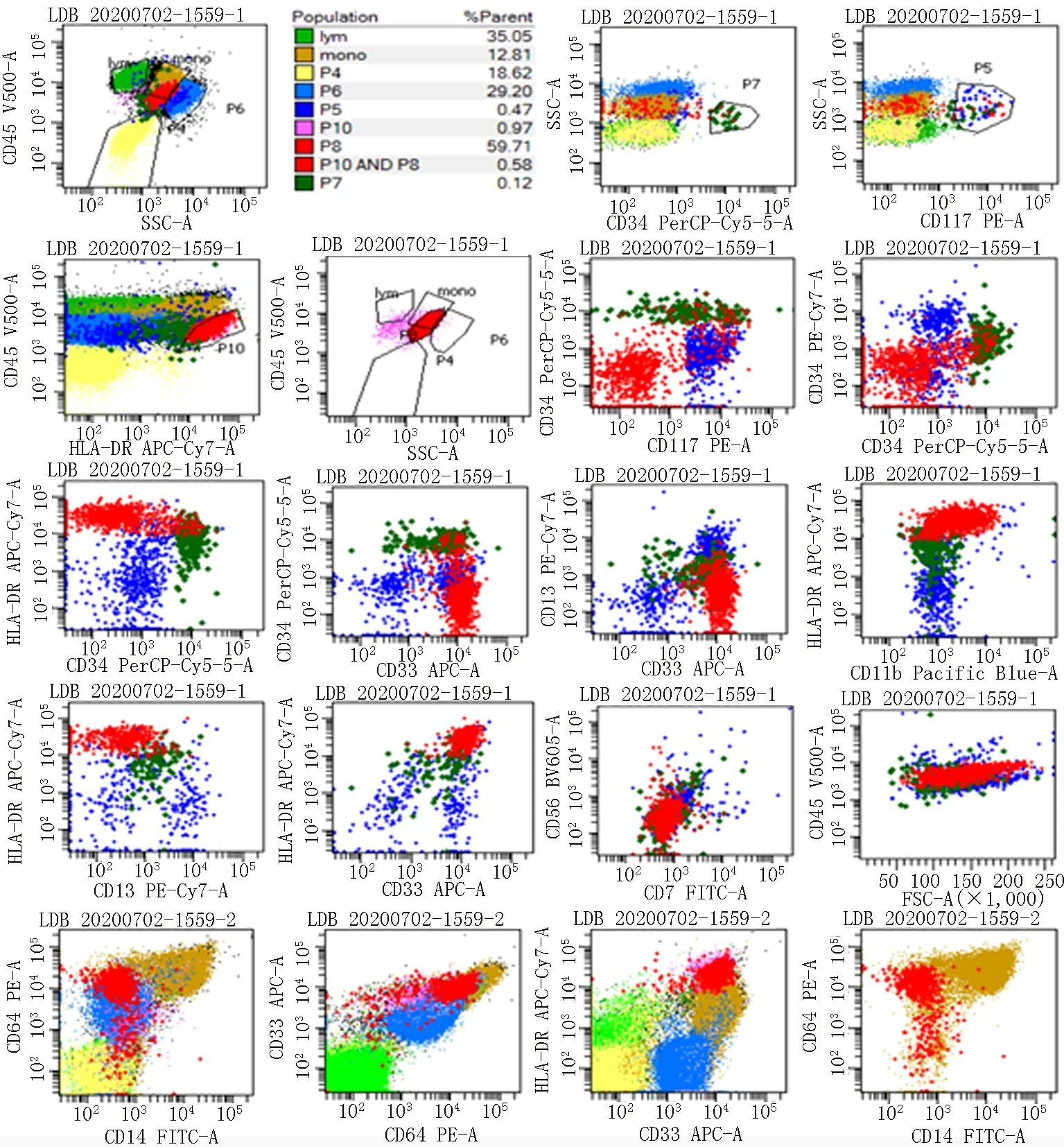
图1 未表达CD34、CD117的AML MRD骨髓标本 红色细胞群为恶性髓系原始细胞,占有核细胞0.58%,未表达早期标志CD34、CD117,表达HLA-DRbri、CD33bri、CD64、CD11bdim,未表达CD13、CD14。因为CD45/HLA-DR P10设门包括增生的B祖细胞,使用CD45/SSC选择SSC大的细胞P8设门,因此占有核细胞比例为P8×P10。P5(深蓝色细胞群)和P7(深绿色细胞群)为正常增生的髓系原始细胞

图2 骨髓标本分析 a:正常髓系原始细胞(红色为CD34阳性早期髓系原始细胞,深蓝色为CD117+CD34-晚期髓系原始细胞)。b:AML MRD(红色为恶性髓系原始细胞,深蓝色为正常髓系原始细胞)
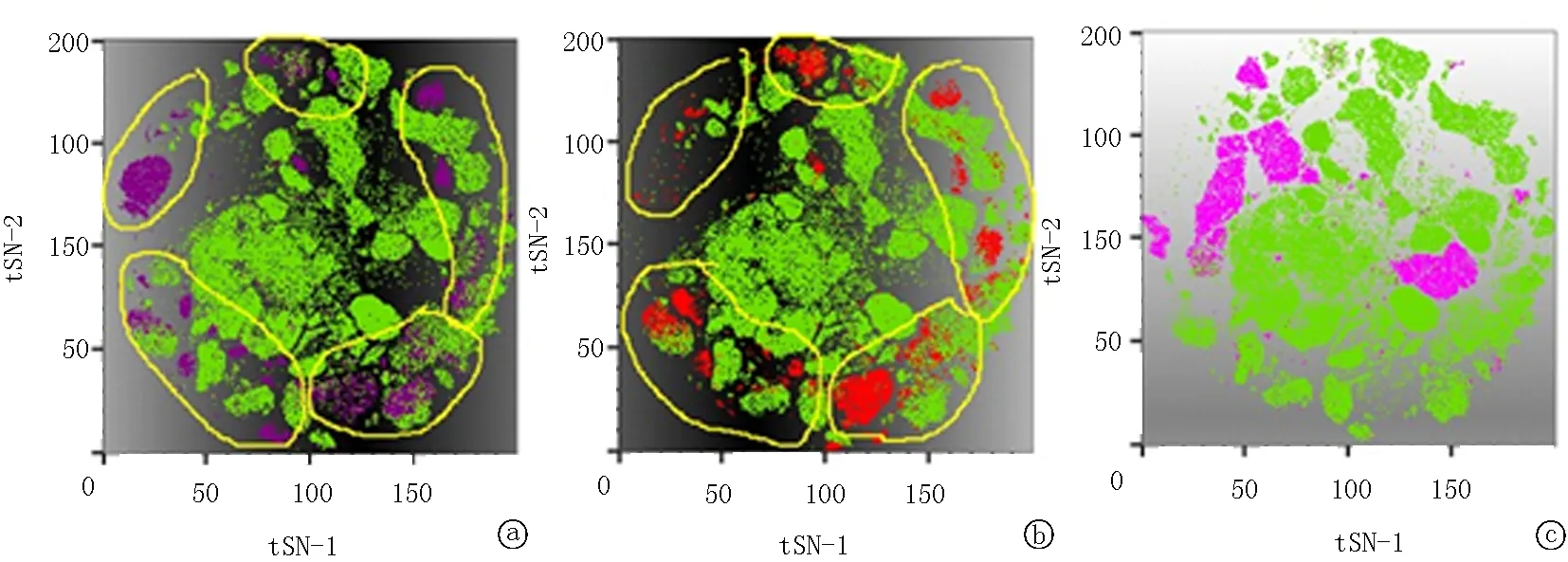
图3 正常与AML MRD骨髓标本的组合tSNE 绿色细胞群为20个正常骨髓标本组成的该方案正常对照图库,a.紫色细胞群;b.红色细胞群;c.粉红色细胞群分别为3个AML患者MRD细胞
2 技术进步意义
2.1更多功能 质谱流式[25]与全光谱流式[26]克服了传统流式荧光通道相对较少、相似发射光谱的荧光素不能同时使用、荧光通道之间干扰大和补偿较大等缺点,尽管目前存在一些问题(质谱流式灵敏度低、样本制备和采集速度低、价格高、复杂数据分析等,全光谱流式检测方案设计复杂、单阳管设置对解析影响大、繁复的数据分析等),依旧成为行业内期待的革命性机型,各自在MRD检测中的应用价值及优缺点见表3。随着质控问题的解决和软件进步,这些全新流式在临床应用会极大提高AML MRD检测的灵敏度和特异性。

表3 传统流式细胞术与新型流式细胞术的特点比较
2.2软件进步 Kaluza、Flowjo、Infinicyt、Cytobank等商业软件的降维功能推动了FCM MRD检测。初步研究flowSOM检测AML MRD, 与分子生物学一致率80.2%,灵敏度85%,特异性69%[27];Infinicyt聚类算法检测AML MRD灵敏度66.28%, 特异性99.9502%~99.9999%[28]。虽然灵敏度有待提高,但是看到了曙光。
2.3MRD新标志 基因芯片技术的发展极大推动了抗原标志筛查,St. Jude一项研究发现更多有望作为AML MRD检测的标志(表1),结合降维软件,有可能使一部分患者的检测灵敏度提高到≤0.001%[24]。
2.4单细胞测序技术的结合 陈赛娟院士团队将免疫表型和RNA-测序(RNA-sequencing,RNA-seq)以及单细胞RNA测序(single-cell RNA-seq,scRNA-seq)整合分析, 发现同一患者标本中,存在不同分化阶段的AML肿瘤细胞群[29],为将来MRD研究拓开新的思路。
3 前景展望
FCM检测AML MRD,从十几年前8色流式的推出,在3年前逐渐趋于完善[10],同时也达到平台期。超多色流式的推出以及高效智能软件问世,有望从方案上解决抗体组合覆盖率低的难题,且同步检测肿瘤干细胞、免疫细胞亚群、免疫检查点、靶向治疗靶点筛查,以及解决部分人员经验的问题。但是尽管最理想的状态下,技术进步可能在未来3~5年将室间差异、人员经验差异、仪器稳定性、方案优化和规范化等问题解决。鉴于AML的本质,相当长的时间里,找到高度特异性且高覆盖率的AML MRD的一个标志或者几个标志组合的可能性很小,即未来可能MRD依旧是能够检测到的MRD。
综上所述,FCM检测MRD具有很强的临床指导意义,虽然目前尚在完善中,但是技术进步带来的推动作用已经显现,将来可能会在提高灵敏度、特异性的同时,把肿瘤干细胞、免疫微环境、免疫检查点研究相结合,为临床提供更加全面的预后信息。

