不同透析方式对MHD患者尿毒症毒素清除、炎症因子和氧化应激状态的影响
刘绍芳 李金香 陈海燕 赵玉 朱爱华
维持性血液透析(maintenance hemodialysis,MHD)为尿毒症患者临床常用治疗方式,能够有效纠正患者代谢紊乱、水钠潴留以及酸碱水平失衡等状态,改善患者生存质量[1]。血液净化技术逐渐完善使尿毒症患者MHD 效果进一步改善。但是仍有研究显示尿毒症患者MHD时体内所处微炎症容易导致患者出现营养不良、淀粉样病变以及心血管疾病等一系列并发症[2]。改善MHD 患者预后重点即在于改善患者体内微炎症状态,达到降低相关并发症发生率目的。患者在接受MHD,透析膜性质如透析膜透析效率以及膜生物不相容性质均会影响患者毒素清除、炎症因子以及氧化应激指标水平变化,所以透析膜选取对于患者MHD 透析效果提高意义重大[3⁃4]。本研究比较2 种方式对患者体内微炎症状态影响,为后期患者MHD 透析膜选取提供相关依据。报告如下。
1 资料和方法
1.1 一般资料
选取2017年4月至2018年5月100 例在本院进行MHD 尿毒症患者为对象。纳入标准:①尿毒症病情诊断依据相关标准[5];②患者接受MHD 时间超过3 个月且病情稳定;③患者日排尿量超过400 mL;④本研究获取患者知情同意以及本院医学伦理会批准。排除标准:①患者肝功能损伤严重;②并发活动性风湿;③并发感染性疾病;④近半年有较为严重外伤史;⑤并发免疫缺陷综合征或者肿瘤。将患者随机分为低通量透析组以及高通量透析组,每组各50 例,患者分别应用低通量透析膜以及高通量透析膜血液透析。两组患者一般资料之间比较差异无统计学意义(P>0.05)。见表1。
表1 两组患者一般资料比较(±s)Table 1 Comparison on general data between the 2 groups(±s)
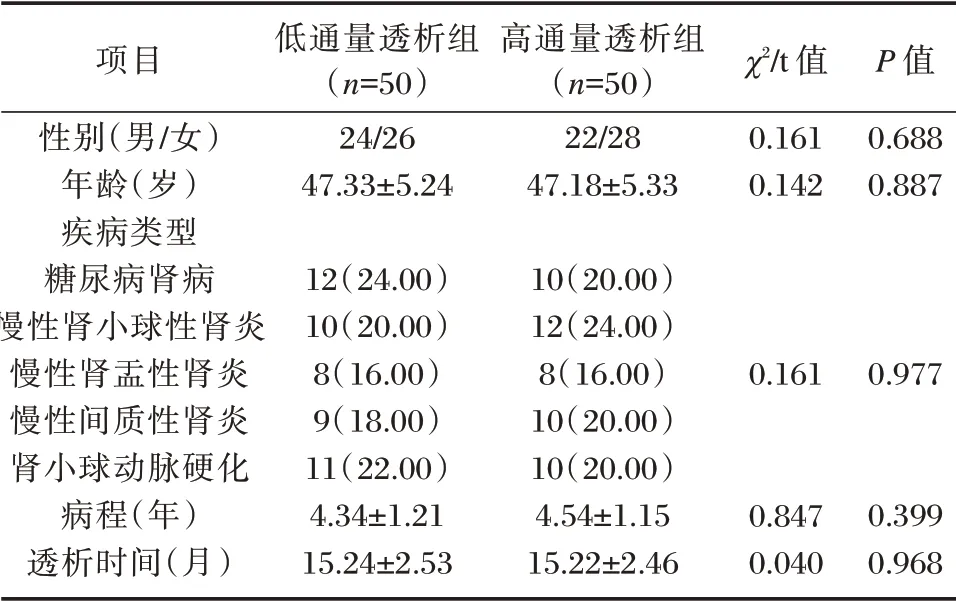
表1 两组患者一般资料比较(±s)Table 1 Comparison on general data between the 2 groups(±s)
项目性别(男/女)年龄(岁)疾病类型糖尿病肾病慢性肾小球性肾炎慢性肾盂性肾炎慢性间质性肾炎肾小球动脉硬化病程(年)透析时间(月)低通量透析组(n=50)24/26 47.33±5.24高通量透析组(n=50)22/28 47.18±5.33 χ2/t 值0.161 0.142 P 值0.688 0.887 12(24.00)10(20.00)8(16.00)9(18.00)11(22.00)4.34±1.21 15.24±2.53 10(20.00)12(24.00)8(16.00)10(20.00)10(20.00)4.54±1.15 15.22±2.46 0.161 0.977 0.847 0.040 0.399 0.968
1.2 仪器/试剂
4008B 血液透析机购自德国费森尤斯公司,7170 全自动生化仪购自美国HITACHI 公司,F6 和F60 型聚矾膜中空纤维透析器购自德国费森尤斯公司,炎症因子和氧化应激指标测定试剂盒均购自深圳子科生物科技有限公司。
1.3 方法
患者透析液选取碳酸氢盐,透析液流量设定为500 mL/min,血管通路选取动静脉内瘘,血流设定为200~250 mL/min,并选择肝素进行抗凝。低通量透析组患者使用低通量透析膜血液透析,患者选取超滤系数为5.5 mL/(mmHg·h·m2),膜面积为1.3 m2,型号为F6 型聚矾膜中空纤维透析器进行透析。高通量透析组患者使用高通量透析膜血液透析,患者选取超滤系数为40 mL/(mmHg·h·m2),膜面积为1.3 m2,型号为F60 型聚矾膜中空纤维透析器进行透析。低通量透析和高通量透析每周3次,每次透析时间为4 h,治疗周期为7 个月。
1.4 观察指标
比较2 组患者透析效果,治疗前后血液毒素指标,炎症因子和氧化应激指标变化。透析前后取患者空腹外周静脉血4 mL,离心后取上清。①血液毒素指标:使用全自动生化仪分析血肌酐(serum creatinine,Scr)、β2微球蛋白(β2⁃microglob⁃ulin,β2⁃MG)、尿素氮(usea nitrogen,BUN)、血磷(serium inorganic phosphorus,P)水平。②炎症因子:酶联免疫吸附法检测肿瘤坏死因子⁃α(tumor necrosis factor⁃α,TNF⁃α)、C 反应蛋白(C reactive protein,CRP)以及白细胞介素⁃6(interleukin⁃6,IL⁃6)变化。③氧化应激指标:免疫透射比浊法检测超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total antioxidant capacity,T⁃AOC)、谷胱甘肽过氧化物酶(glutathione peroxidas,GSH⁃PX)水平。
1.5 评价标准[6]
透析效果评价:治疗后通过患者血液中Scr、BUN、P 等毒素成分下降来评价患者透析效果。显效:患者血液中Scr、BUN、P 等毒素水平下降至正常范围;有效:患者血液中Scr、BUN、P 等毒素水平明显下降,但还未到正常范围;无效:患者血液中Scr、BUN、P 等毒素水平下降幅度不显著或者其水平增加。总有效率=显效率+有效率。
1.6 统计学方法
应用SPSS 20.0 软件包进行数据处理,计数资料用n(%)描述,使用χ2检验;计量资料用(±s)表示,用t检验进行,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者透析效果比较
高通量透析组透析总有效率高于低通量透析组,差异有统计学意义(P<0.05)。见表2。
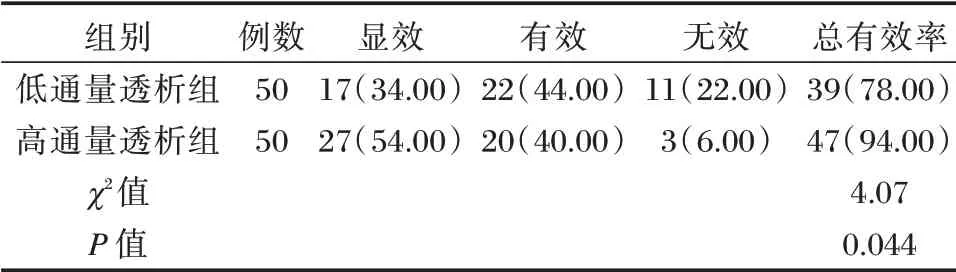
表2 两组患者透析效果比较[n(%)]Table 2 Comparison of dialysis effects of patients between the 2 groups[n(%)]
2.2 两组患者治疗前后毒素情况比较
两组患者治疗后Scr、BUN、P 等毒素指标水平较治疗前显著下降(P<0.05),治疗后高通量透析组患者β2⁃MG 水平显著低于治疗前(P<0.05),而低通量透析组患者β2⁃MG 水平治疗前后差异无统计学意义(P>0.05),高通量透析组毒素指标水平低于低通量透析组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后毒素情况比较(±s)Table 3 Comparison of toxins before and after treatment between the 2 groups(±s)
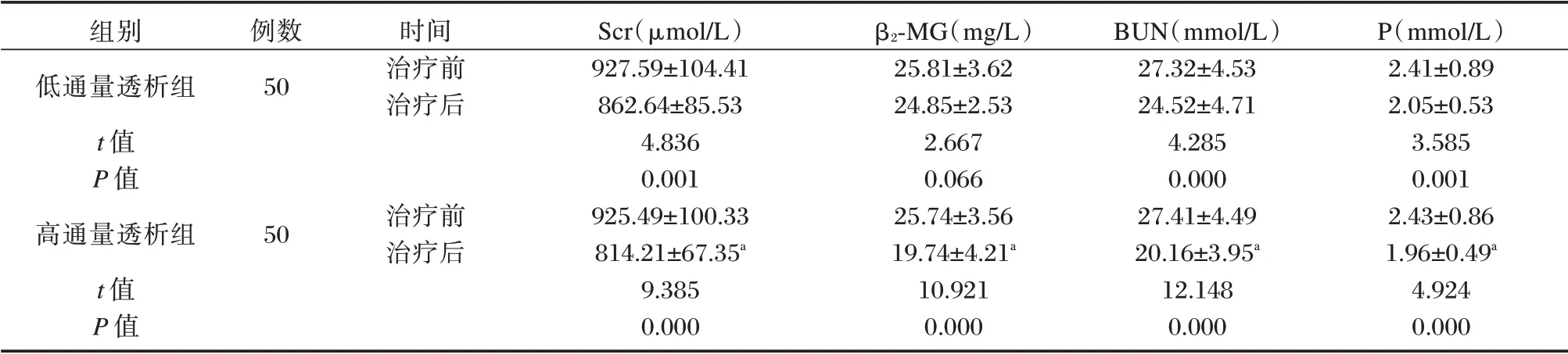
表3 两组患者治疗前后毒素情况比较(±s)Table 3 Comparison of toxins before and after treatment between the 2 groups(±s)
注:与低通量透析组比较,aP<0.05。
P(mmol/L)2.41±0.89 2.05±0.53 3.585 0.001 2.43±0.86 1.96±0.49a 4.924 0.000组别低通量透析组t 值P 值高通量透析组t 值P 值例数50时间治疗前治疗后50治疗前治疗后Scr(μmol/L)927.59±104.41 862.64±85.53 4.836 0.001 925.49±100.33 814.21±67.35a 9.385 0.000 β2⁃MG(mg/L)25.81±3.62 24.85±2.53 2.667 0.066 25.74±3.56 19.74±4.21a 10.921 0.000 BUN(mmol/L)27.32±4.53 24.52±4.71 4.285 0.000 27.41±4.49 20.16±3.95a 12.148 0.000
2.3 两组患者治疗前后炎症因子比较
高通量透析组患者治疗后TNF⁃α、CRP 和IL⁃6等炎症因子水平较治疗前显著下降(P<0.05),低通量透析组治疗前后炎症因子水平差异无统计学意义(P>0.05),高通量透析组炎症因子水平低于低通量透析组,差异有统计学意义(P<0.05)。见表4。
表4 两组患者治疗前后炎症因子比较(±s)Table 4 Comparison of inflammatory factors before and after treatment between the 2 groups(±s)
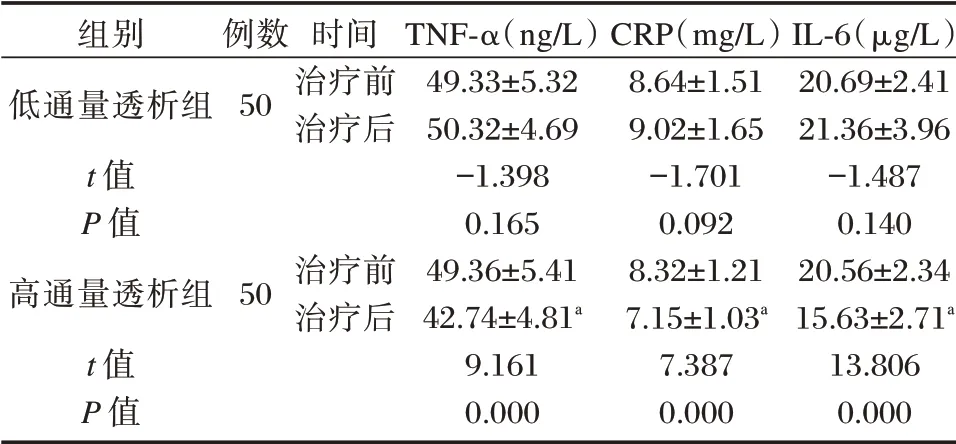
表4 两组患者治疗前后炎症因子比较(±s)Table 4 Comparison of inflammatory factors before and after treatment between the 2 groups(±s)
注:与低通量透析组比较,aP<0.05。
组别低通量透析组t 值P 值高通量透析组t 值P 值例数50时间治疗前治疗后50治疗前治疗后TNF⁃α(ng/L)49.33±5.32 50.32±4.69-1.398 0.165 49.36±5.41 42.74±4.81a 9.161 0.000 CRP(mg/L)8.64±1.51 9.02±1.65-1.701 0.092 8.32±1.21 7.15±1.03a 7.387 0.000 IL⁃6(μg/L)20.69±2.41 21.36±3.96-1.487 0.140 20.56±2.34 15.63±2.71a 13.806 0.000
2.4 两组患者治疗前后氧化应激指标变化比较
高通量透析组患者治疗后SOD、T⁃AOC 和GSH⁃PX 等氧化应激指标较治疗前显著上升(P<0.05),低通量透析组治疗前后氧化应激指标差异无统计学意义(P>0.05),治疗后高通量透析组氧化应激指标高于低通量透析组,差异有统计学意义(P<0.05)。见表5。
表5 两组患者治疗前后氧化应激指标变化比较(±s)Table 5 Comparison of oxidative stress indexes changes before and after treatment between the 2 groups(±s)
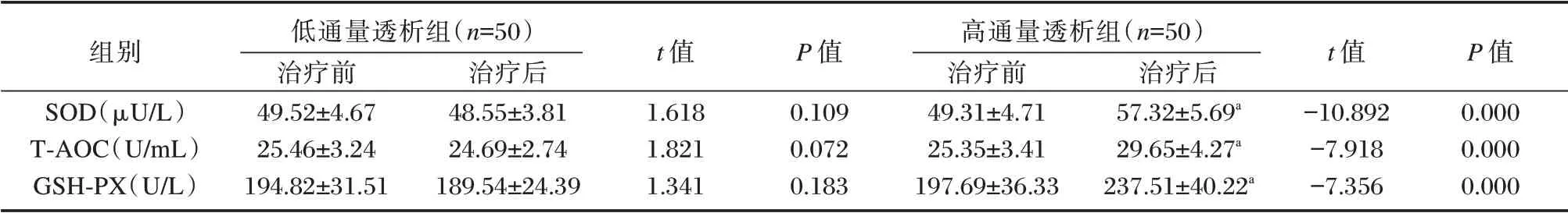
表5 两组患者治疗前后氧化应激指标变化比较(±s)Table 5 Comparison of oxidative stress indexes changes before and after treatment between the 2 groups(±s)
注:与低通量透析组比较,aP<0.05。
组别SOD(μU/L)T⁃AOC(U/mL)GSH⁃PX(U/L)低通量透析组(n=50)治疗前49.52±4.67 25.46±3.24 194.82±31.51治疗后48.55±3.81 24.69±2.74 189.54±24.39 t 值1.618 1.821 1.341 P 值0.109 0.072 0.183高通量透析组(n=50)治疗前49.31±4.71 25.35±3.41 197.69±36.33治疗后57.32±5.69a 29.65±4.27a 237.51±40.22a t 值-10.892-7.918-7.356 P 值0.000 0.000 0.000
3 讨论
尿毒症患者因为肾功能受损导致患者血液中P、BUN、Scr 等小分子毒素以及β2⁃MG 等中分子毒素水平急剧上升,在未经对症治疗时病情逐渐进展为尿毒症,致使患者出现代谢性中毒,威胁患者生命,患者常使用MHD 进行治疗[7⁃8]。本研究中治疗后高通量透析组患者β2⁃MG 水平显著低于治疗前,而低通量透析组患者β2⁃MG 水平治疗前后差异不显著,证实低通量透析方式在清除中分子量毒素上的局限性。高通量透析组毒素指标水平显著低于低通量透析组,说明高通量透析对于患者血液中毒素清除效果更佳。不同通量透析材料对毒素清除差异可能是由于低通量透析材料透析膜孔径较小导致其仅可以清除小分子毒素,而对于中分子毒素清除效果不佳,中分子毒素β2⁃MG 在体内浓度过高容易出现糖基化,致使患者关节出现病变甚至慢性疼痛等症,影响患者生活及生存质量[9⁃10]。高通量透析所用透析膜孔径较大,通透性较好,可以将中分子毒素有效清除。本研究结果与李文静等[6]研究结果透析总有效率趋势一致。
尿毒症患者进行MHD 可以有效降低患者血液中毒素含量,改善患者生存质量,患者长期接受MHD 时微炎症状态导致患者出现氧化应激异常,其会诱导患者出现心血管疾病以及相关性淀粉样病变等并发症[11]。患者体内氧化应激状态使其体内活性氧含量大幅增加,氧化和抗氧化状态失去平衡。马志宏等[12]类似研究中选取丙二醛、GSH⁃PX以及过氧化物歧化酶作为氧化应激状态变化指标。本研究选取SOD、T⁃AOC 和GSH⁃PX 作为评价患者氧化应激状态。患者体内SOD、GSH⁃PX 为抗氧化酶,SOD 可以通过清除氧自由基来抑制脂质氧化介导的氧化作用,GSH⁃PX 是重要的过氧化物分解酶,T⁃AOC 则可以反映患者总抗氧化能力[13]。本研究结果提示高通量透析组患者体内各种抗氧化酶和抗氧化物质合成加快或释放增多,可能是由于患者体内毒素减少,代谢紊乱状态得以纠正。本研究结果,与肖白丽等[14]研究结果不同,其认为低通量透析患者治疗后氧化应激水平增强。
研究显示过度氧化应激导致患者体内炎症反应被激活,从而刺激炎症因子释放,同时炎症因子又可以促进氧化应激反应发生[15]。微炎症状态下患者体内巨噬细胞被激活,导致TNF⁃α、CRP 和IL⁃6等炎症因子释放,形成恶性循环加重患者病情[16]。本研究中高通量透析组炎症因子水平显著低于低通量透析组。微炎症状态导致患者体内炎症因子经由激活机体免疫系统引起患者炎性细胞大量合成,促进炎症因子大量释放,高通量透析对于患者氧化应激状态改善较为显著,患者抗氧化能力有效提高,氧化应激状态的改善使炎性细胞合成和释放的炎症因子减少,患者体内炎症因子水平下调。
综上所述,尿毒症患者MHD 时选取高通量透析方式进行血液净化可以有效清除患者血液中毒素,通过降低患者体内氧化应激水平来调节患者炎症反应,透析效果显著,临床应用价值较高。

