脂肪间充质干细胞外泌体miR⁃212⁃3p对成纤维样滑膜细胞的影响
贾丙申 于鹏 焦拓 李君 李明 曲国欣 纪志华 付昆
类风湿性关节炎(rheumatoid arthritis,RA)是一种慢性全身性自身免疫性疾病。临床表现为滑膜慢性炎症性增生和肥大及手足关节损伤[1]。研究证实,成纤维样滑膜细胞(fibroblast⁃like synovio⁃cytes,FLS)在RA 的发病过程中发挥关键作用,其增殖和侵袭能力的增强与RA 的发展密切相关[2⁃3]。因此,探究调控RA⁃FIS 细胞增殖和侵袭迁移的分子机制对于改善RA 至关重要。近期研究证实,脂肪间充质干细胞(adipose mesenchymal stem cell,ADSC)可通过改变早期适应性T 细胞反应来调节实验性自身免疫性关节炎[4];ADSCs 分泌的外泌体能够降低骨关节炎软骨细胞的炎症反应[5]。此外有文献报道,外泌体miRNAs 在RA 中发挥重要调控作用[6],miR⁃212⁃3p 定位于17p13.3,参与调控多种疾病的发展,且能够抑制RA⁃FLS 细胞增殖,促进其凋亡[7]。但鲜有文献报道ADSC 外泌体对RA⁃FLS 细胞生物学行为的影响及作用。本研究将从细胞水平探究ADSC 外泌体中miR⁃212⁃3p 对RA⁃FLS 细胞行为的调控及其分子机制。
1 材料与方法
1.1 标本来源与试剂
收集海南医学院第一附属医院骨科类风湿性关节炎(RA)患者(20 例)和健康者(20 例)血清,患者均已签署知情同意书,并通过医院伦理委员会批准。人正常滑膜细胞FLS、人类风湿性关节炎滑膜细胞RA⁃FLS 和ADSCs 细胞购于北纳生物细胞库。DMEM 和胎牛血清购自美国Biological Indus⁃tries 公司;Lipofectamine 2000 购于日本TaKaRa 公司;CCK⁃8 试剂盒购于日本同仁公司;Transwell 小室购买于美国Corning Incorporated 公司;双荧光素酶报告基因检测试剂盒购于Promega 公司;RT⁃qPCR引物、antagomiR⁃212⁃3p、miR⁃212⁃3p mimics 及阴性寡核苷酸由上海吉玛制药技术有限公司提供;抗体均购自美国CST 公司。
1.2 ADSCs 细胞培养及外泌体分离
将ADSCs 细胞于含10%胎牛血清的DMEM培养基中培养,或在培养液中加入antagomiR⁃212⁃3p;培养24 h 后收集培养液,4℃、800 g 离心10 min 沉淀细胞,再于12 000 g 离心20 min 清除细胞碎片。收集上清,于4℃、100 000 g 离心2 h 收集沉淀,用PBS 洗涤1 次,最后用200 μL PBS 重悬外泌体沉淀,-80℃保存备用。
1.3 RA⁃FLS 细胞培养及转染
RA⁃FLS 细胞培养于含10% 胎牛血清的DMEM 培养基中,然后置于37℃、5%CO2培养箱中进行培养。根据Lipofectamine 2000 转染试剂说明书分别转染阴性对照物(NC)、miR⁃212⁃3p mimics和si⁃SMAD1 质粒。分为NC 组:RA⁃FLS 细胞单独培养;Exo 组:RA⁃FLS 细胞+Exo⁃ADSCs 共培养;Exo⁃antagomiR⁃212⁃3p 组:RA⁃FLS 细胞+沉默外泌体miR⁃212⁃3p 共培养;si⁃SMAD1+Exo⁃antagomiR⁃212⁃3p 组:敲降RA⁃FLS 细胞SMAD1+沉默外泌体miR⁃212⁃3p 共培养。
1.4 RT⁃qPCR
采用Trizol 法提取血清及细胞中总RNA,反转录成cDNA;用StepOnePlus™仪进行qPCR 反应,以U6 作为内参,反应条件为:95℃30 s,95℃5 s、60℃30 s,循环40 次。实验重复3 次。结果采用2⁃ΔΔCt法进行计算。引物序列见表1。
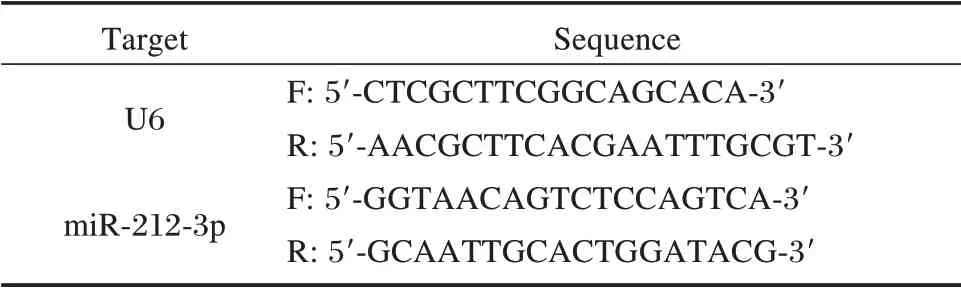
表1 RT⁃qPCR 引物序列Table 1 The primer sequence for RT⁃qPCR
1.5 Western blotting
收集并提取各组细胞总蛋白,BCA 法检测蛋白浓度,再进行SDS⁃PAGE 凝胶电泳,分离目的条带。用湿式转移法将蛋白转印至PVDF 膜上,将PVDF 膜置于5%脱脂奶粉中,室温封闭1.5 h;加入一抗(1∶1 500),4℃孵育过夜;次日,加入HRP 二抗(1∶3 000),37℃孵育1 h,加入ECL 显色进行凝胶成像,并用Image J 对蛋白条带进行定量分析。
1.6 CCK⁃8
将RA⁃FLS 细胞以每孔加入100 μL(104个/孔)接种于96 孔板,每孔再加10 μL ADSCs 细胞外泌体悬液。于检测前1 h,每孔加入10 μL CCK⁃8溶液混匀,于培养箱中孵育1~4 h。用酶标仪测定450 nm 处的光密度(OD)值。
1.7 Transwell
将密度 为1×105个/mL 细胞悬液和10 μL ADSCs 细胞外泌体悬液接种于预先包被Matrigel基质胶的Transwell 上室。下室加250 μL 含10%胎牛血清的完全培养基,培养48 h,取出小室,棉签擦去上室细胞,4%的多聚甲醛固定下室细胞15 min,结晶紫染色15 min,PBS 洗净,干燥后置于倒置显微镜下观察拍照。
1.8 双荧光素酶报告
根据Starbase 数据库预测miR⁃212⁃3p 与SMAD1 的结合序列,同时构建SMAD1 突变型载体,分别将SMAD1 野生型和突变型载体与miR⁃212⁃3p、miR⁃NC 共转293T 细胞。按照双荧光素酶报告基因说明书进行检测各组荧光素酶活性。
1.9 统计学分析
采用SPSS 20.0 软件进行数据统计分析,采用GraphPad Prism 7.0 软件绘图。所有实验均重复3次及以上,计量数据采用(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 成功分离ADSCs 细胞外泌体
培养ADSCs 细胞并分离培养液上清中的外泌体,透射电子显微镜观察分离的外泌体(图1A)。采用Western blotting 检测发现外泌体特异性标志物CD9、CD63 和CD81 均表达阳性,而阴性标志物CD31 未表达(外 泌体不表达CD31、CD116 和CD34 等内皮性或造血性表面标记物)(图1B)。
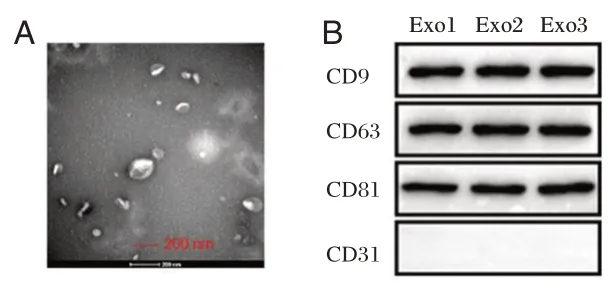
图1 成功分离的ADSCs 细胞外泌体Figure 1 The exosomes of ADSCs cells were successfully isolated
2.2 ADSCs 细胞外泌体抑制RA⁃FLS 细胞增殖、迁移和侵袭
在48、72 h 时,Exo 组RA⁃FLS 细胞增殖活力较NC 组显著降低,差异有统计学意义(P<0.05)(图2A);与NC 组相比,Exo 组迁移和侵袭能力明显降低(P<0.05)。(图2B 和2C)。
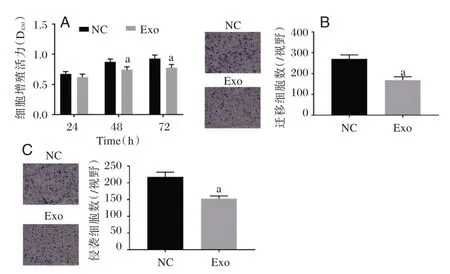
图2 ADSCs 细胞外泌体抑制RA⁃FLS 细胞增殖、迁移和侵袭Figure 2 ADSCs cell exosome inhibited the proliferation,migration and invasion of RA⁃FLS cells
2.3 ADSCs 细胞外泌体上调RA⁃FLS 细胞中miR⁃212⁃3p 的表达
与NC组相比,Exo组中miR⁃708⁃5p、miR⁃212⁃3p、miR⁃650 及miR⁃92a 的表达水平均显著上调,差异有统计学意义(P<0.05)。(图3A)。miR⁃212⁃3p 在RA 患者血清中的表达水平显著低于健康组血清,差异有统计学意义(P<0.05)。(图3B)。
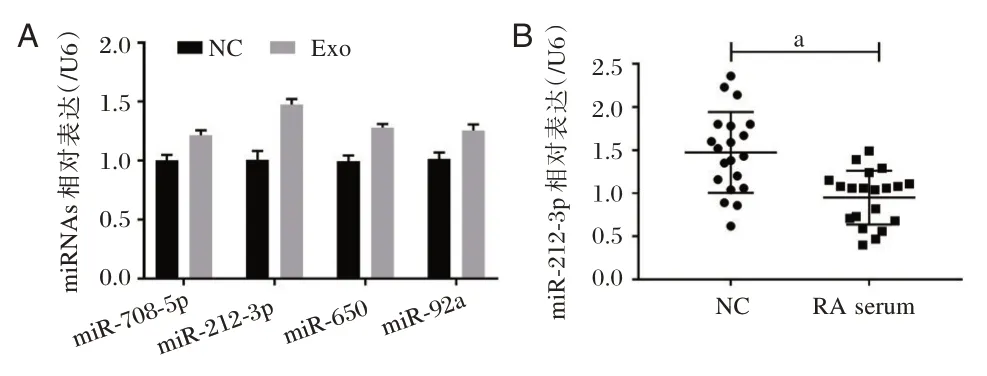
图3 ADSCs 细胞外泌体上调RA⁃FLS 细胞中miR⁃212⁃3p的表达Figure 3 ADSCs cell exosome upregulated the expression of miR⁃212⁃3p in RA⁃FLS cells
2.4 miR⁃212⁃3p 靶向下调SMAD1 的表达
与NC 组相比,miR⁃212⁃3p mimics 与SMAD1⁃Wt 质粒共转293T 细胞时荧光素酶活性显著降低,差异有统计学意义(P<0.05)(图4A);而miR⁃212⁃3p mimics 与SMAD1⁃Mut 质粒共转时荧光素酶活性与NC组比较,差异无统计学意义(P>0.05)。miR⁃212⁃3p过表达组中SMAD1 的表达水平显著低于NC 组,差异有统计学意义(P<0.05)。(图4B)。
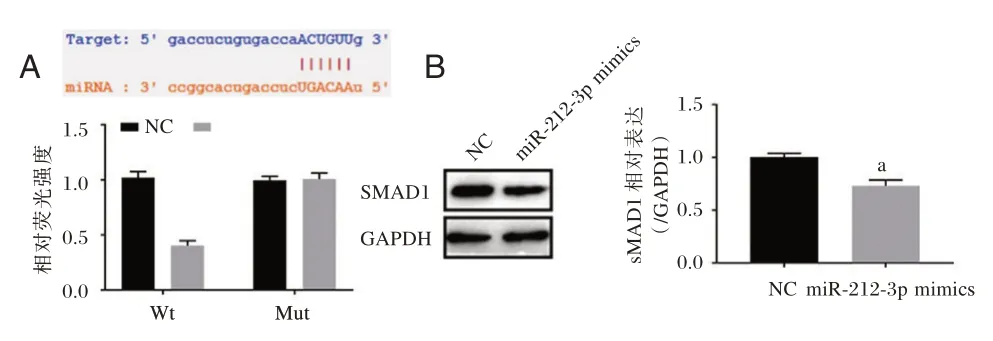
图4 miR⁃212⁃3p 靶向下调SMAD1 的表达Figure 4 miR⁃212⁃3p targeted downregulate the expression of SMAD1
2.5 ADSCs 细胞外泌体miR⁃212⁃3p 通过SMAD1抑制RA⁃FLS 细胞增殖、迁移和侵袭
与NC 组,Exo 及si⁃SMAD1+Exo⁃antagomiR⁃212⁃3p 组中SMAD1 的表达水平比较,差异均有统计学意义(P<0.05),Exo⁃antagomiR⁃212⁃3p 组中SMAD1 表达水平,差异无统计学意义(P=0.657),见图5A。与NC 组,Exo 组及si⁃SMAD1+Exo⁃an⁃tagomiR⁃212⁃3p 组RA⁃FLS 细胞迁移数和侵袭数均显著降低(P<0.05),Exo⁃antagomiR⁃212⁃3p 组中RA⁃FLS 细胞迁移数和侵袭数较NC 组,差异无统计学意义(P>0.05),见图5B、图5C 和表2和表3。CCK⁃8 结果显示,处理24 h 时,各组之间差异无统计学意义;而当处理48 h 与72 h 时,相比于NC 组,Exo及si⁃SMAD1+Exo⁃antagomiR⁃212⁃3p 组RA⁃FLS 细胞活力显著降低,而Exo⁃antagomiR⁃212⁃3p 组中RA⁃FLS 细胞活力比较差异无统计学意义(P>0.05),见表2。
表2 Transwell 实验结果(±s)Table 2 Transwell experimental results(±s)
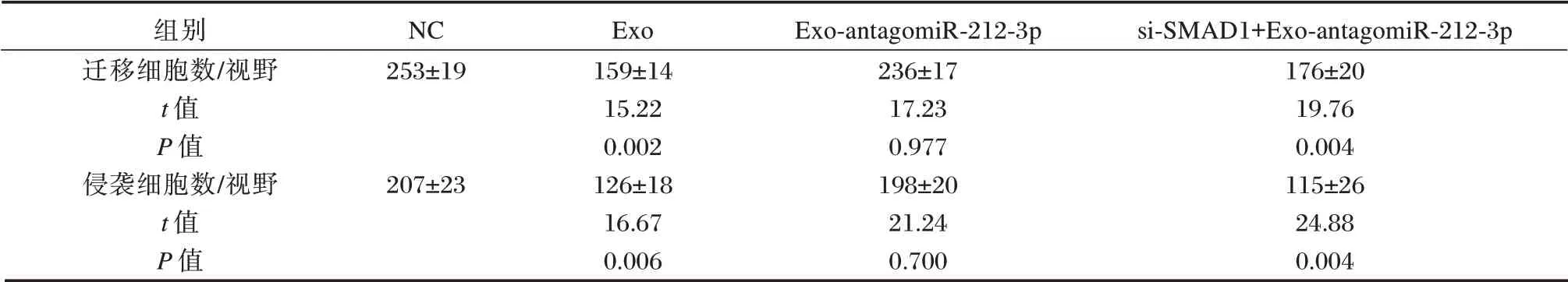
表2 Transwell 实验结果(±s)Table 2 Transwell experimental results(±s)
组别迁移细胞数/视野t 值P 值侵袭细胞数/视野t 值P 值NC 253±19 si⁃SMAD1+Exo⁃antagomiR⁃212⁃3p 207±23 Exo 159±14 15.22 0.002 126±18 16.67 0.006 Exo⁃antagomiR⁃212⁃3p 236±17 17.23 0.977 198±20 21.24 0.700 176±20 19.76 0.004 115±26 24.88 0.004
表3 CCK⁃8 实验结果(±s)Table 3 CCK⁃8experimental results(±s)

表3 CCK⁃8 实验结果(±s)Table 3 CCK⁃8experimental results(±s)
组别细胞增值活力(OD450)t 值P 值si⁃SMAD1+Exo⁃antagomiR⁃212⁃3p 24 h 48 h 72 h NC 0.56±0.19 0.78±0.12 0.87±0.15--Exo 0.53±0.14 0.6±0.18 0.78±0.14 1.043 0.007 Exo⁃antagomiR⁃212⁃3p 0.55±0.15 0.77±0.11 0.84±0.13 1.267 0.856 0.54±0.14 0.67±0.15 0.76±0.14 1.056 0.006
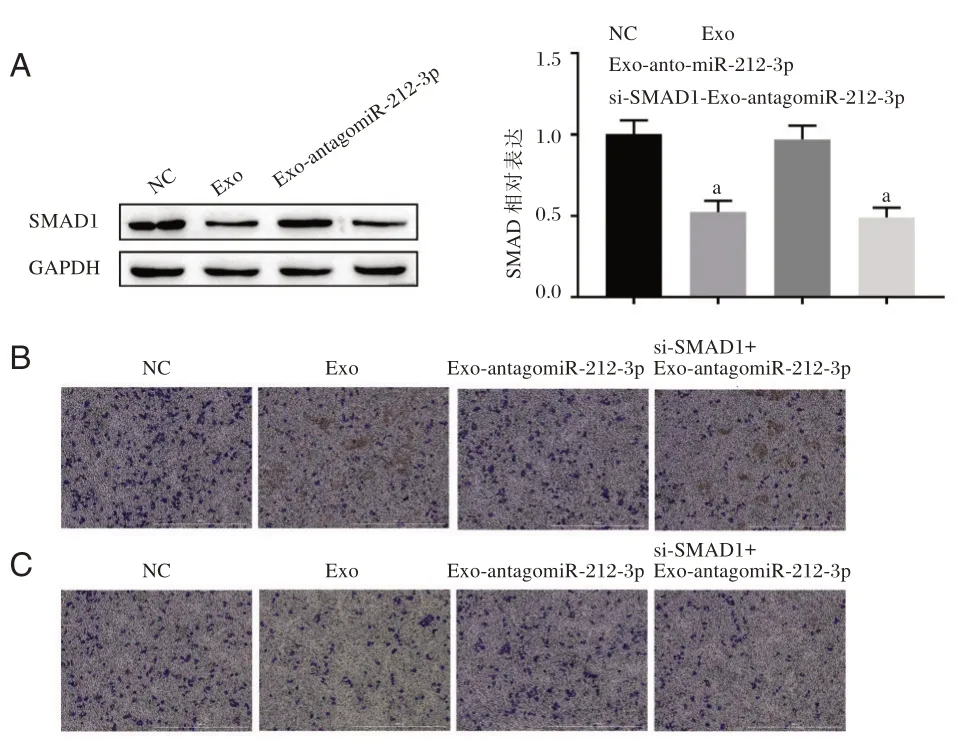
图5 ADSCs 细胞外泌体miR⁃212⁃3p 下调SMAD1 抑制RA⁃FLS 细胞增殖、迁移和侵袭Figure 5 ADSCs cell exosome miR⁃212⁃3p inhibited the proliferation,migration and invasion of RA⁃FLS cells by downregulating SMAD1
3 讨论
RA 已成为最常见的结缔组织疾病之一。其主要病理改变为滑膜组织增厚,大量炎性细胞浸润,间质严重水肿,严重破坏关节软骨和骨骼,以及血管生成。RA 已成为致残和丧失劳动力的主要原因之一[8]。RA⁃FLS 细胞是参与RA 滑膜组织发展的主要细胞群,在RA 发病机制中起着至关重要的作用,有助于类风湿血管的形成[9]。有文献报道,通过体外扩增培养自体ADSCs 细胞及全身输注,能够治疗自身免疫性疾病,如多发性硬化、多发性肌炎和RA 等[10]。此外有文献证实,ADSCs细胞来源的外泌体在疾病发展过程中扮演着重要角色。例如,在乳腺癌细胞模型中,ADSCs 细胞外泌体通过Wnt 信号通路促进乳腺癌细胞迁移[11]。本研究发现,ADSCs 细胞来源的外泌体能够抑制RA⁃FLS 细胞增殖、迁移和侵袭。
研究证实,ADSCs 细胞来源的外泌体中含有丰富的miRNAs,并在疾病发展过程中发挥重要调控作用。例如,人ADSCs 细胞来源的外泌体miR⁃NAs 是诱导A2780 和SKOV⁃3 卵巢癌细胞抗增殖信号转导的关键因子[12]。同时研究证实,miRNAs在RA 的发展过程中具有重要调控作用。例如,miR⁃124a 靶向PI3K/NF⁃κB 通路抑制RA⁃FLS 细胞增殖和炎性反应[13];miR⁃506 通过靶向下调TLR4抑制RA⁃FLS 细胞增殖,且诱导凋亡[14];miR⁃320a靶向MAPK⁃ERK1/2 信号通路抑制RA⁃FLS 细胞增殖[15]。有研究报道,miR⁃212⁃3p 在RA 患者滑膜组织、血清和RA⁃FLS 细胞中低表达,过表达miR⁃212⁃3p 能够显著抑制RA⁃FLS 细胞增殖[7]。本研究的结果与以前的研究结果相似,发现miR⁃212⁃3p 在RA 患者血清中低表达。此外,本研究发现ADSCs 外泌体能够通过提高RA⁃FLA 细胞miR⁃212⁃3p 的表达水平抑制RA⁃FLS 细胞增殖、迁移和侵袭,而敲降miR⁃212⁃3p 后,能够回复ADSCs外泌体对RA⁃FLS 细胞增殖、迁移和侵袭的抑制作用。这说明ADSCs 细胞通过分泌外泌体miR⁃212⁃3p 上调RA⁃FLS 细胞中miR⁃212⁃3p 的表达,进而抑制RA⁃FLS 细胞恶性生物学行为。
SMAD1 蛋白是SMADs 细胞质蛋白家族重要成员,是TGF⁃α/SMADs 信号通路的重要递质。Chen 等人[16]研究表明,SMAD1 在前列腺癌中高表达,抑制SMAD1 的表达可抑制前列腺癌细胞增殖、迁移和侵袭。本研究发现,miR⁃212⁃3p 可靶向结合SMAD1 的3′UTR;同时,回复实验证实,miR⁃212⁃3p 通过靶向下调SMAD1 进而抑制RA⁃FLS 细胞增殖、迁移和侵袭。
综上所述,miR⁃212⁃3p 在ADSCs 细胞外泌体中高表达,ADSCs 细胞通过分泌外泌体miR⁃212⁃3p上调RA⁃FLS 细胞中miR⁃212⁃3p 的表达水平,且靶向下调SMAD1 的表达水平,进而抑制RA⁃FLS 细胞增殖、迁移和侵袭。
——外泌体与老年慢性疾病相关性的研究进展

