血清VEGF、PDGF和ES水平与湿性年龄相关性黄斑变性的关系
解鹏亮 郑陆芳 董明霞 董如娇 陈芳
年龄相关性黄斑变性(age⁃related macular de⁃generation,AMD)是与年龄密切相关的黄斑退行性疾病,是中老年人致盲的首要原因[1]。AMD 包括干性AMD 和湿性AMD,发病机制均尚不明确,干性AMD 疾病进展缓慢,湿性AMD 病情则呈现渐进性发展。因湿性AMD 患者存在黄斑下脉络膜血管新生并呈现病理性渗出改变,诱发血管新生的细胞因子成为湿性AMD 研究的热点[2]。其中,血管内皮生长因子(vascular endothelial growth factor,VEGF)是诱发血管新生的关键细胞因子,在新生血管形成、血管渗透增加中发挥重要的作用[3]。此外,有研究表明,血小板源性生长因子(platelet⁃derived growth factor,PDGF)、内皮抑素(endostatin,ES)在眼内病理性新生血管的形成中也发挥着举足轻重的作用[4⁃5]。基于此,本研究将对湿性AMD 患者血清VEGF、PDGF 和ES 水平及其临床意义进行分析,现报道如下。
1 资料与方法
1.1 一般资料
选择2019年10月至2020年10月本院收治的78 例湿性AMD 患者为病例组。纳入标准:①符合AMD 诊断标准[6],经光学相干断层扫描、眼底荧光造影检查确诊为湿性AMD;②此前未接受AMD相关治疗;③对研究知情且签署知情同意书。排除标准:①合并白内障、青光眼、视网膜病变等其他眼部疾病;②有眼部手术史;③有玻璃体腔及球后、球周注射激素史;④合并恶性肿瘤、心脑血管疾病、活动性感染、严重代谢性疾病;⑤凝血功能异常。疾病分期标准[6]:早期:黄斑区色素脱失,中心凹反射不清或消失,同时存在多个小的玻璃膜疣和少量中等大小的玻璃膜疣;中期:黄斑区出现浆液性和(或)出血性盘状脱离,广泛存在中等大小的玻璃膜疣,至少有1 个大的玻璃膜疣,或有未涉及黄斑中心凹的地图样萎缩;晚期:视网膜下和视网膜上皮层下纤维血管增殖,盘状瘢痕。另选择同期于本院健康体检的性别、年龄与病例组相匹配40 例健康者为对照组,对照组体检者既往无眼部疾病。两组性别、年龄资料比较差异无统计学意义(P>0.05),见表1。本研究经医院医学伦理委员会批准通过。
表1 两组一般资料比较(±s)Table 1 Comparison of general data between 2 groups(±s)

表1 两组一般资料比较(±s)Table 1 Comparison of general data between 2 groups(±s)
组别对照组病例组χ2/t 值P 值n 患眼病程(月)患眼疾病分期(早/中/晚)40 78 94性别(男/女)18/22 36/42 0.014 0.905年龄(岁)60.54±6.89 62.57±7.94 1.373 0.172 6.89±1.23 20/66/8
1.2 方法
研究对象均采集清晨空腹肘静脉血3 mL,3 000 r/min 离心10 min(离心半径10 cm),取上层清液与-80℃冰箱保存待测。采用酶联免疫吸附法检测血清VEGF、PDGF、ES 水平,试剂盒购自武汉默沙克生物科技有限公司。
1.3 统计学方法
采用SPSS 19.0 软件进行统计分析,计量资料以(±s)表示,组间比较行t检验、多组间比较行F检验;采用Pearson 相关分析法分析AMD 患者血清VEGF、PDGF、ES 水平,采用Spearman 相关分析法分析AMD 患者血清VEGF、PDGF、ES 水平与病情分期的关系,并绘制受试者工作特征曲线(ROC)评价血清VEGF、PDGF、ES 对AMD 的临床意义,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组血清VEGF、PDGF、ES 水平比较
病例组血清VEGF、PDGF 水平显著高于对照组,ES 水平显著低于对照组,差异均有统计学意义(P<0.05)。见表2。
表2 两组血清VEGF、PDGF、ES 水平比较(±s)Table 2 Comparison of levels of serum VEGF,PDGF and ES between 2 groups(±s)
表2 两组血清VEGF、PDGF、ES 水平比较(±s)Table 2 Comparison of levels of serum VEGF,PDGF and ES between 2 groups(±s)
组别对照组病例组t 值P 值n 40 78 VEGF(ng/L)65.52±26.23 155.58±72.35 7.610<0.001 PDGF(μg/L)39.66±10.41 60.26±19.32 6.283<0.001 ES(ng/L)164.28±33.85 136.82±38.86 3.791<0.001
2.2 病例组不同患者血清VEGF、PDGF、ES 水平
病例组血清VEGF、PDGF 水平:晚期>中期>早期,ES 水平:晚期>中期>早期,两两比较差异均有统计学意义(P<0.05)。见表3。
表3 病例组不同病情患者血清VEGF、PDGF、ES 水平比较(±s)Table 3 Comparison of levels of serum VEGF,PDGF and ES in case group of patients with different disease status(±s)

表3 病例组不同病情患者血清VEGF、PDGF、ES 水平比较(±s)Table 3 Comparison of levels of serum VEGF,PDGF and ES in case group of patients with different disease status(±s)
注:与早期患者比较,aP<0.05;与中期患者比较,bP<0.05。
?
2.3 AMD 患者血清VEGF、PDGF、ES 水平间的关系及与病情分期的关系
AMD 患者血清VEGF 水平与PDGF 水平呈正相关(r=0.613,P<0.05),而血清VEGF 水平和PDGF水平的表达情况均与ES 的表达水平无关(r=0.165,0.197,P>0.05)。AMD 患者VEGF 、PDGF 水平与病情分期呈正相关(r=0.754,0.664,P<0.05),ES 水平与病情分期呈负相关(r=-0.706,P<0.05)。
2.4 血清VEGF、PDGF、ES 水平对AMD 患者的预测价值
分别以VEGF、PDGF、ES 水平绘制诊断AMD患者 的ROC 曲线,AUC 对应为0.868、0.833、0.694,敏感性为83.33%、57.69%、55.13%,特异性为92.50%、100.00%、82.50%。见图1。

图1 ROC 曲线Figure 1 ROC curve
2.5 血清VEGF、PDGF、ES 水平对AMD 中晚期患者的预测价值
分别以VEGF、PDGF、ES 水平绘制诊断AMD中晚期患者的ROC 曲线,AUC 对应为0.945、0.874、0902,敏感性为100.00%、68.33%、81.67%,特异性为77.78%、100.00%、88.89%。见图2。
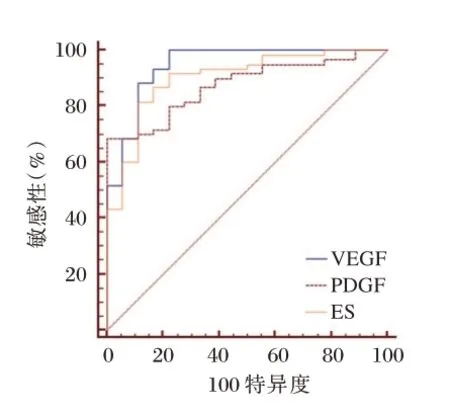
图2 ROC 曲线Figure 2 ROC curve
3 讨论
湿性AMD 是我国患者失明的主要原因,其发病机制错综复杂,临床表现为视网膜色素上皮严重的脱位和(或)脉络膜新生血管生成[8]。异常的脉络膜新生血管生成后会穿透脉络膜和Bruch 膜朝向视网膜生长,出现渗出、出血等病理改变,最终导致中心视力丧失与组织瘢痕形成。有研究发现促血管生成因子与抗血管生成因子的平衡在脉络膜新生血管生成中发挥着重要作用,影响湿性AMD 的发生、发展[9]。
本研究结果显示,病例组血清VEGF、PDGF 水平较对照组升高,而ES 水平降低,说明湿性AMD发病后,因促血管生成因子与抗血管生成因子失衡,血清VEGF、PDGF、ES 水平均处于异常状态。VEGF 是促进血管新生作用最强的细胞因子之一,其过度表达会增加血管渗透性,诱导血管内皮细胞增殖并以出芽的方式形成新的血管,是目前湿性AMD 抗VEGF 治疗的靶点[10]。既往研究已证实VEGF 在湿性AMD 患者患眼房水中处于高表达,参与湿性AMD 的发病、发展[11]。但 仅 有VEGF 作用,新生血管未必能够形成结构和功能健全的血管,尚需多种信号通路和血管周围微环境的调节[12]。PDGF、ES 是影响AMD 促血管生成因子与抗血管生成因子平衡的重要细胞因子,其中PDGF 正常生理状态下存在于血小板内,而湿性AMD 新生血管形成后,血管内皮细胞开始分泌相关因子促进血管稳定和内皮细胞分化,PDGF 由崩解的血小板释放并被激活,刺激特定细胞趋化、生长,促进新生血管形成[13]。ES 则具有抗血管增生活性,能抑制脉络膜新生血管内皮细胞的异常增殖,是控制脉络膜新生血管的靶点之一,已成功用于治疗发生脉络膜新生血管的眼部疾病[14]。相关性分析显示,三个指标中仅VEGF 水平与PDGF 水平正相关,与陈烨等[15]研究结果一致,这与VEGF的过度表达可刺激PDGF 表达有关。此外,湿性AMD 患者VEGF、PDGF 水平与病情分期呈正相关,ES 水平与病情分期呈负相关,表明湿性AMD患者VEGF 和PDGF 水平越高、ES 水平越低病情越严重。ROC 曲线结果提示VEGF、PDGF、ES 均可作为湿性AMD 潜在的诊断检测指标,且以VEGF 诊断效能最佳。病情评估时,VEGF、PDGF、ES 水平诊断湿性AMD 中晚期的AUC 为0.945、0.874、0902,且VEGF 评估的敏感性和PDGF 评估的特异性均达100.00%,表明VEGF、PDGF、ES 水平还可为湿性AMD 病情分期提供诊断信息,筛查早期、中晚期患者,其中VEGF 在三者指标中诊断效能最高,对病情判断更为准确。
综上所述,湿性AMD 患者处于高VEGF、PDGF水平和低ES 水平状态,三者可作为AMD 潜在的诊断和病情评估指标,且VEGF 对疾病诊断和病情评估的效能最高。但本研究样本量较小,且未能比较不同预后患者指标的差异,后期将进一步深入研究。

