不同分期糖尿病视网膜病变患者脉络膜厚度及体积变化的计算机自动分割方法分析
范雯 陈强 戈伟中 刘庆淮 袁松涛
1南京医科大学第一附属医院(江苏省人民医院)眼科,南京 210029;2南京理工大学计算机科学与工程学院,南京 210094;3宜兴市人民医院眼科,宜兴 214200
糖尿病发病率呈逐年升高趋势,预计2040年世界范围内糖尿病患者将达到6.42亿[1]。糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病引起的主要视网膜血管并发症,是全球工作年龄人群视力障碍和盲的主要原因[2]。视网膜的氧气和营养不仅来源于自身血管,还来源于脉络膜血管,DR、年龄相关性黄斑变性等大部分视网膜疾病的病理生理学机制都与脉络膜异常有关[3-4]。然而脉络膜厚度和体积的变化与DR之间的关系尚未明确。增强深部成像的光相干断层扫描(enhanced depth imaging optical coherence tomography,EDI-OCT)可将光源聚焦于更深层的脉络膜,呈现出更清晰的脉络膜影像。EDI-OCT可清晰显示全层脉络膜并进行定量检测,使人们对视网膜脉络膜疾病的研究发生了跨越式进步。近年国内外广泛开展了基于EDI-OCT图像的脉络膜厚度相关研究,但各个研究结论并不完全一致。Kim等[5]研究发现随着DR严重程度的增加,脉络膜厚度也相应增加,并且有黄斑水肿患者的脉络膜增厚。而Querques等[6]和Regatieri等[7]研究发现存在黄斑水肿的DR患者脉络膜会进一步变薄。脉络膜体积与视网膜疾病的关系比脉络膜厚度更重要,但是脉络膜体积通常无法在机器上直接获取。本课题组前期通过合并EDI-OCT图像和128个三维B型扫描的频域光相干断层扫描(spectral domain optical coherence tomography,SD-OCT)图像来进行计算机自动脉络膜分割,获得黄斑中心凹下脉络膜厚度(subfoveal choroidal thickness,SFCT)和脉络膜体积,相较于传统手动测量方法展现出高效、便捷、稳定、精确的优点[8]。本研究拟采用计算机自动分割方法来测量2型糖尿病患者不同DR分型OCT图像SFCT和脉络膜体积变化,进一步探索脉络膜异常在DR的病理生理机制中所扮演的角色,为DR的疾病进展预测和治疗提供新的线索。
1 资料与方法
1.1 一般资料
采用横断面研究方法,纳入2016年5月至2017年5月于南京医科大学第一附属医院确诊的2型糖尿病患者64例88眼,其中,男27例32眼,女37例56眼;年龄44~86岁,平均(62.7±7.4)岁;平均糖尿病病程(13.7±7.2)年。纳入标准:(1)年龄>18岁;(2)符合WHO 1999年2型糖尿病诊断标准;(3)接受正规糖尿病治疗,血糖控制平稳;(4)无高血压、高血脂等其他系统性疾病。排除标准:(1)屈光度>+2.00 D或<-2.00 D者;(2)合并年龄相关性黄斑变性、视网膜静脉阻塞、黄斑前膜、中心性浆液性脉络膜视网膜病变等其他视网膜脉络膜疾病者;(3)既往有青光眼、眼部肿瘤、除白内障手术外的其他眼部手术史者;(4)既往接受过玻璃体腔注射糖皮质激素或抗新生血管药物治疗、黄斑区格栅样激光光凝或全视网膜激光光凝治疗者;(5)屈光间质混浊导致OCT检查成像质量不佳者;(6)合并黄斑水肿的患者。同期纳入年龄、性别相匹配的健康志愿者19人32眼作为正常对照组。参照早期DR治疗研究组(ETDRS)制定的分级诊断标准[9],将患者分为糖尿病无DR(non-diabetic retinopathy,NDR)组28眼、非增生型糖尿病视网膜病变(nonproliferative diabetic retinopathy,NPDR)组36眼和增生型糖尿病视网膜病变(proliferative diabetic retinopathy,PDR)组24眼。各组受试者性别构成比、年龄等基线资料比较,差异均无统计学意义(均P>0.05)(表1)。本研究遵循《赫尔辛基宣言》,研究方案经南京医科大学第一附属医院伦理委员会审核批准(批文号:2017-SR-176)。所有受试者均知晓研究目的。
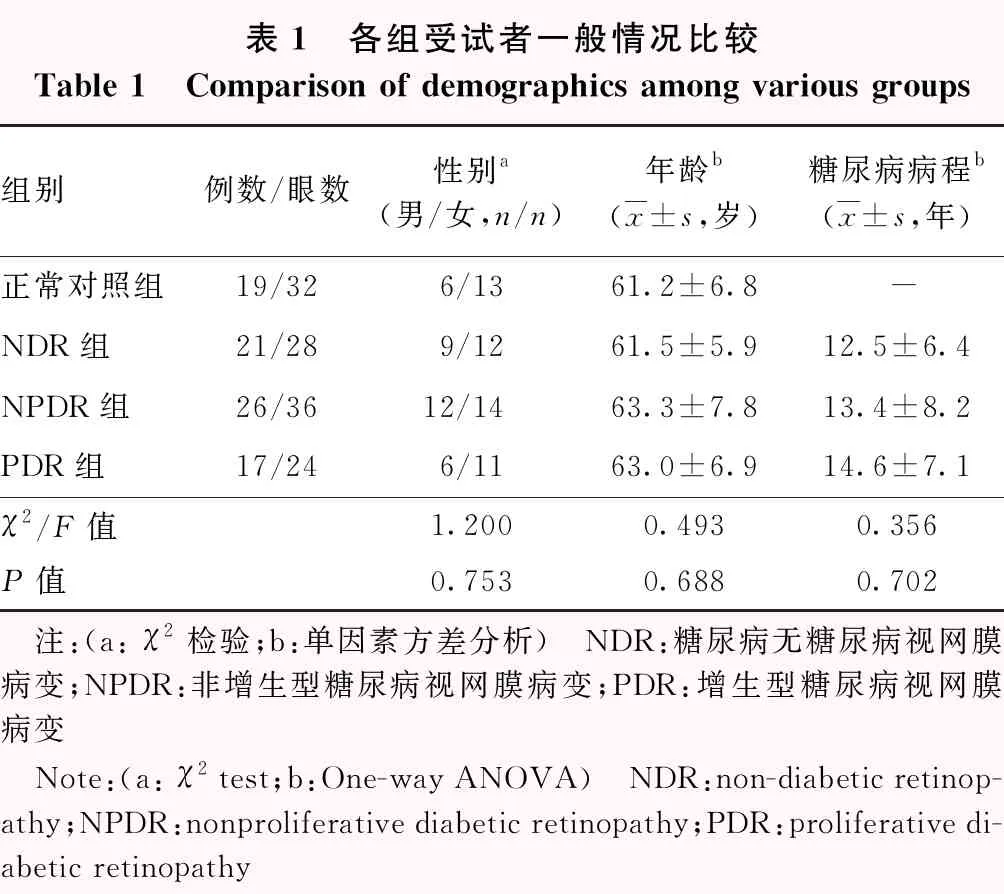
表1 各组受试者一般情况比较Table 1 Comparison of demographics among various groups组别例数/眼数性别a(男/女,n/n)年龄b(x±s,岁)糖尿病病程b(x±s,年)正常对照组19/326/1361.2±6.8-NDR组21/289/1261.5±5.912.5±6.4NPDR组26/3612/1463.3±7.813.4±8.2PDR组17/246/1163.0±6.914.6±7.1χ2/F值1.2000.4930.356P值0.7530.6880.702 注:(a: χ2检验;b:单因素方差分析) NDR:糖尿病无糖尿病视网膜病变;NPDR:非增生型糖尿病视网膜病变;PDR:增生型糖尿病视网膜病变 Note:(a: χ2 test;b:One-way ANOVA) NDR:non-diabetic retinop-athy;NPDR:nonproliferative diabetic retinopathy;PDR:proliferative di-abetic retinopathy
1.2 方法
1.2.1一般检查 所有患者均行屈光度、裂隙灯显微镜、间接检眼镜和SD-OCT检查。NPDR组和PDR组患者均行荧光素眼底血管造影检查。
1.2.2脉络膜厚度和体积测量 采用Cirrus HD-OCT 4000(德国卡尔蔡司公司)cube模式和HD 5 Line Raster EDI模式对所有受检眼行黄斑区扫描。通过合并EDI-OCT图像获得自动分割脉络膜的三维SD-OCT图像,进而分析得到SFCT和脉络膜体积。采用基于EDI-OCT图像的脉络膜分割方法对SD-OCT图像中的脉络膜进行指导分割。同一眼的EDI-OCT图像和SD-OCT图像均由同一时间同一仪器扫描获得。
1.2.3数据收集及评估 自动分割方法的基本过程如下:(1)对原始图像进行降噪处理;(2)根据视网膜层的结构特点,采用基于反射率的方法[10]对视网膜神经纤维层(retinal nerve fiber layer,RNFL)和Bruch膜边界进行分割;(3)根据图1中绿色虚线标记的Bruch膜边界上下移动HD-OCT图像,使Bruch膜为直线;(4)根据脉络膜血管区域的反射率拟合表面估计脉络膜区域的血管位置;(5)在估计得到的脉络膜血管区域的下边界领域采用三维图搜索算法得到脉络膜-巩膜界面;(6)利用Bruch膜和脉络膜-巩膜界面边界计算分割得到SFCT和脉络膜体积(图1)。脉络膜体积为整个cube的脉络膜层厚度之和。
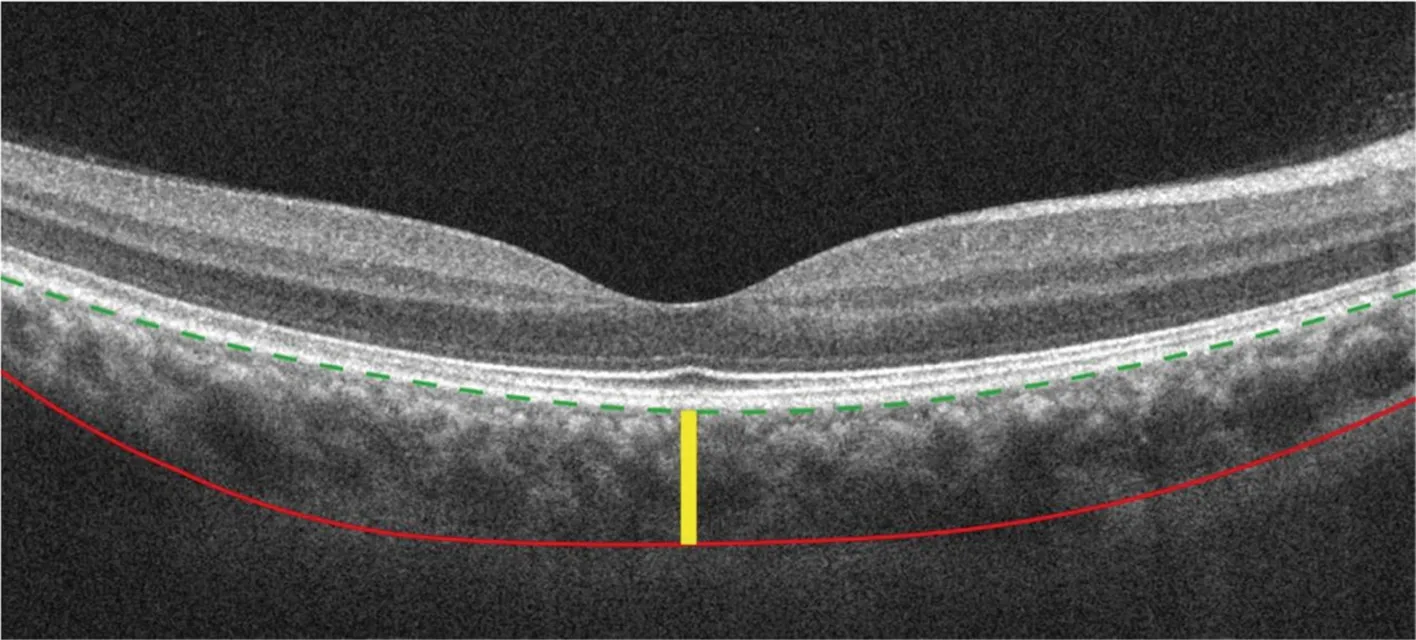
图1 脉络膜自动分割方法示意图 绿色虚线为脉络膜内界面,红色实线为脉络膜巩膜界面,黄色实线为SFCT测量线Figure 1 Diagrammatic sketch of automatic segmentation of choroidThe green dotted line was the inner interface of choroid.The red line was the choroid-sclera interface.The yellow line was the SFCT measurement line
1.3 统计学方法
2 结果
2.1 各组SFCT比较
正常对照组、NDR组、NPDR组和PDR组平均SFCT总体比较差异有统计学意义(F=14.615,P<0.001),其中NDR组和NPDR组SFCT较正常对照组变薄,PDR组SFCT较NDR组增厚,差异均有统计学意义(均P<0.05);PDR组与正常对照组SFCT比较,差异无统计学意义(P=0.076)(表2)。
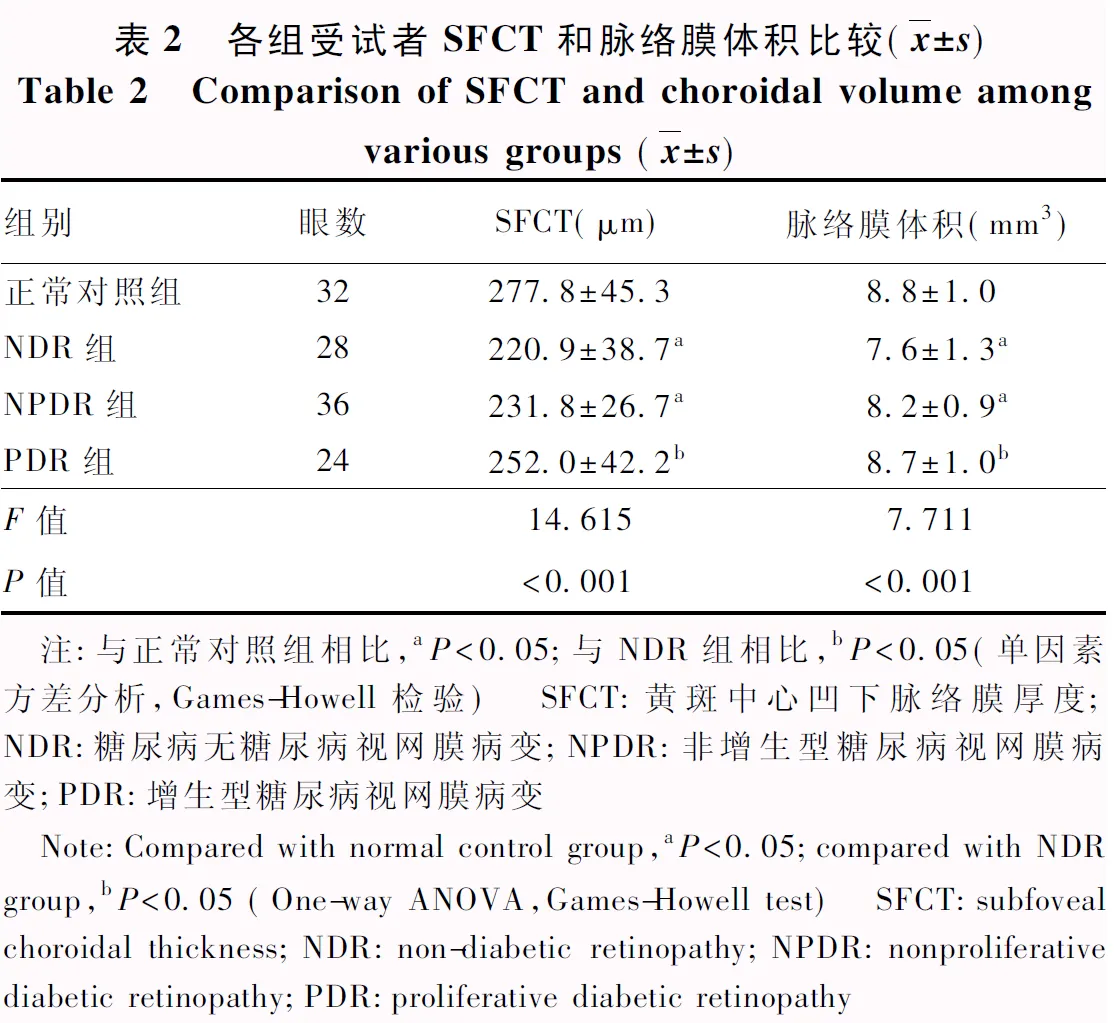
表2 各组受试者SFCT和脉络膜体积比较(x±s)Table 2 Comparison of SFCT and choroidal volume amongvarious groups (x±s)组别眼数SFCT(μm)脉络膜体积(mm3)正常对照组32277.8±45.38.8±1.0NDR组28220.9±38.7a7.6±1.3aNPDR组36231.8±26.7a8.2±0.9aPDR组24252.0±42.2b8.7±1.0bF值14.6157.711P值<0.001<0.001 注:与正常对照组相比,aP<0.05;与NDR组相比,bP<0.05(单因素方差分析,Games-Howell检验) SFCT:黄斑中心凹下脉络膜厚度;NDR:糖尿病无糖尿病视网膜病变;NPDR:非增生型糖尿病视网膜病变;PDR:增生型糖尿病视网膜病变 Note:Compared with normal control group,aP<0.05;compared with NDR group,bP<0.05 (One-way ANOVA,Games-Howell test) SFCT:subfoveal choroidal thickness;NDR:non-diabetic retinopathy;NPDR:nonproliferative diabetic retinopathy;PDR:proliferative diabetic retinopathy
2.2 各组脉络膜体积比较
正常对照组、NDR组、NPDR组和PDR组平均脉络膜体积总体比较差异有统计学意义(F=7.711,P<0.001),其中NDR组和NPDR组脉络膜体积较正常对照组变小,差异均有统计学意义(P=0.002、0.031);PDR组脉络膜体积较NDR组增大,差异有统计学意义(P=0.010);PDR组与正常对照组脉络膜体积比较,差异无统计学意义(P=0.946)(表2)。
3 讨论
脉络膜是眼内的一个血管组织层,是视网膜外层组织的主要氧气和营养来源,其与青光眼、年龄相关性黄斑变性和小柳-原田综合征等多种眼病相关,在DR的发病机制中也起着重要作用。糖尿病患者体内持续的高糖环境会对脉络膜血管组织造成损伤,使脉络膜毛细血管扩张和阻塞,形成无灌注区和新生血管等[11]。此外,脉络膜的损伤可能破坏紧邻的血-视网膜外屏障,导致视网膜下液形成,由于内、外屏障关系紧密,一旦外屏障遭到破坏,将进一步导致内屏障的损伤[12]。Manjunath等[13]的研究也显示,脉络膜血管异常可引起光感受器细胞功能障碍,甚至坏死。EDI模式的发展使得OCT的光束聚焦于更深层的脉络膜和巩膜,能呈现出更清晰的脉络膜影像,为脉络膜厚度和体积的测量提供了新方法。目前Spectralis OCT仪和Cirrus HD-OCT仪均带有EDI模式[14-15],但其自带的分析软件无法完成SFCT的自动测量和分析,而对于更有意义的脉络膜体积亦缺少直接的测算方法,无法进行随访和评估。本研究采用我们团队自行设计的计算机自动分割方法来获取SFCT和脉络膜体积,基于EDI-OCT图像对脉络膜边界的清晰显影和SD-OCT图像的三维数据,将两者图像叠合并计算脉络膜体积。自动分割方法可以更加精确和便捷地对脉络膜的厚度和体积等参数进行测量,从而辅助脉络膜疾病的诊断。在脉络膜边界分割和脉络膜厚度、体积的测量方面,自动分割方法和专家人工测量方法的准确性一致[8],由于使用三维图像搜索,所以自动分割方法获得的脉络膜表面比人工获得的更加光滑,使得自动分割方法的稳定性优于人工测量,并且更节省人力和时间。
本研究中排除了屈光度、年龄、糖尿病病程等对脉络膜的影响,并设立年龄、性别相匹配的对照组来排除混杂因素的影响。本研究结果显示,NDR组和NPDR组SFCT较正常对照组变薄,与之前报道结果一致[5,16-18]。组织病理学证据表明,在DR早期患者中存在脉络膜毛细血管萎缩和内皮细胞损伤[19];激光多普勒血流计检查结果显示,DR早期患者脉络膜血流量下降[20];上述研究结果表明早期DR患者脉络膜变薄可能是由于脉络膜缺氧引起的血管收缩和毛细血管病变。另一方面,脉络膜变薄会加重缺氧,从而提高VEGF和其他细胞因子的水平,进一步导致血-视网膜屏障破坏和DR的进展[21]。本研究结果也显示,NDR组、NPDR组的SFCT显著小于正常对照组,且NDR组和NPDR组脉络膜体积较正常对照组明显减小。而Lee等[22]的研究结果显示,NDR组与正常对照组SFCT比较差异无统计学意义,可能是由于该研究中受试者年龄较小,疾病初期脉络膜循环的改变尚未达到有显著差异的程度。Savage等[23]的研究结果表明,PDR患者的脉络膜血流量增加,本研究同样提示PDR组SFCT较NDR组增厚,脉络膜体积较NDR组增大,可能与脉络膜血管扩张和血流量增加引起的脉络膜增厚有关。但本研究未结合吲哚菁绿荧光血管造影或血管多普勒等相关检查结果进行综合分析,对于机制的推测证据仍存在不足,未来我们将进行更深入的验证。由于本研究样本量不够大,涉及的人群也比较局限,未来仍需进一步行多中心、大样本、前瞻性试验检测糖尿病患者脉络膜厚度及体积的总体人群变化,进一步探索糖尿病患者脉络膜的病理改变及其影响DR的具体机制。
综上所述,本研究采用计算机自动分割方法测定并分析了不同分型DR患者的脉络膜厚度和体积,发现早期DR患者SFCT变薄,脉络膜体积缩小,随病变程度加重,SFCT逐渐增厚,脉络膜体积增加。脉络膜变薄或损坏都将影响视网膜,导致其缺氧,出现DR及病情进展。了解脉络膜在糖尿病患者视网膜中的作用及其参与DR的病理生理机制,可以帮助我们更好地了解DR的病程。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明范雯:酝酿和设计试验、实施研究、分析和解释数据、文章撰写;陈强:分析和解释数据;戈伟中:采集数据、统计分析;刘庆淮:指导研究、文章审阅和修改;袁松涛:参与设计试验,对文章的知识性内容作批评性审阅

