高通量测序在一罕见脊柱肋骨发育不全病例诊断中的应用
曾玉坤 丁红珂 刘玲 余丽华 张彦★
脊椎肋骨发育不全(spondylocostal dysostosis,SCDO)是一种以脊柱/脊椎严重分节障碍和肋骨发育不良为表现的罕见先天性疾病,一般呈常染色体隐性遗传,其临床特点主要表现为椎骨和肋骨发育异常,包括椎骨节段异常、胸骨变短、肋骨排列异常,同时常伴肋骨减少,胸廓畸形等[1⁃3]。该疾病发病机制较复杂,通过临床表型明确诊断及分型十分困难。本研究通过对一例超声结构明显异常胎儿及其父母采用高通量测序的方法进行检测,后续针对发现的基因变异位点进行致病性预测分析,检测结果为孕妇本人及临床医生进行遗传咨询及指导提供了科学依据。
1 研究对象与方法
1.1 病例资料
孕妇,29 岁,孕19 周,2019年8月因超声发现胎儿脊柱发育异常来本院产前诊断中心就诊。检测结果提示:胎儿全段脊柱排列不齐,椎体大小不一,多个椎体缺失、融合,脊柱长度缩短(约56 mm)(图1)。孕妇曾有不良孕产史:2013 足月曾剖宫产脊柱裂畸形患儿,2017年再次因超声发现胎儿脊柱裂引产。受检者先后进行羊水染色体核型分析及染色体微阵列基因芯片检测(chromosomal microar⁃ray,CMA),均未见异常。为进一步明确病因,通过采用高通量测序的方法针对孕妇本人及丈夫以及胎儿进行医学外显子组序列分析。
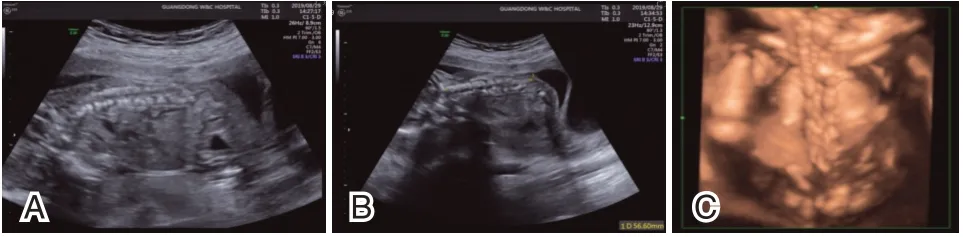
图1 胎儿脊柱超声影像图Figure 1 Ultrasound image of fetal spine
1.2 方法
1.2.1 DNA 提取
使用乙二胺四乙酸二钾抗凝管抽取孕妇本人及丈夫外周血各3 mL。采用血液基因组DNA 提取试剂盒(厦门致善生物科技股份有限公司),培养过的羊水样本采用Qiagen DNA MINI Kit 50 试剂盒进行DNA 提取,提取的全基因组DNA 均使用nanodrop2000(Thermo,美国)检测,外周血DNA大于80 ng/μL,羊水DNA 大于100 ng/μL,A260/A280 在(1.8~2.0)之间,于-20℃中保存备用。
1.2.2 羊水样本母体污染鉴定
采用荧光PCR⁃毛细管电泳法同时检测胎儿和母亲13 个微卫星多态标记位点,防止因母源污染而引起误诊。
1.2.3 医学外显子组序列分析
将提取的孕妇及丈夫外周血全基因组DNA 及羊水DNA 各100 μL,送至广州嘉检医学检测有限公司进行与人类疾病相关的4 000 个已知基因编码外显子区域及侧翼区的序列分析。测序后获得的原始数据通过使用BWA 软件进行序列比对,采用GATK和Var Scan 软件对变异进行识别,包括单核苷酸多态性(single nucleotide polymorphism,SNP)、插入与缺失等进行检测、注释和统计分析。利用Annovar软件从外部数据库进行变异位点注释,以评估给定的序列变异的影响。根据数据分析结果,参考db SNP 数据库和HGMD 数据库找出可能的致病突变。
1.2.4 Sanger 测序验证
根据经医学外显子组高通量测序后分析结果,使用Sanger 测序方法对胎儿及父母变异位点进行验证。采用Primer5 软件设计引物,用聚合酶链反应(PCR)技术扩增HES7基因(NM_001165967)变异位点c.674T>C(p.F225S)相应外显子及其侧翼序列,引物由天一辉远广州基因科技有限公司合成,引物序列为:HES7⁃EX4F:CTTGG⁃TATCTCTGCGCCC,HES7⁃EX4R:CCTCGGGCT⁃GGAGTCTCTAC。按以下条件进行进行PCR 扩增:LATaq 预混液12.5 μL,甜菜碱5 μL,正、反向引物各1 μL,样本DNA 1 μL,无核酸水至25 μL;PCR 反应条件为94℃预变性5 min;94℃变性30 s,62℃退火30 s,72℃延伸40 s,进行40 个循环;最后72℃延伸10 min。PCR 产物送至天一辉远广州基因科技有限公司进行Sanger 测序。
1.2.5 变异位点致病性分析
1.2.5.1 突变部分氨基酸物种间保守性分析 通过数据库查找具有代表性的不同物种间该位点氨基酸保守性分析,以期揭示突变区域是否高度保守。
1.2.5.2 蛋白质一级结构比对分析 通过TheEx⁃PASY 软件的Protparam 工具(http://www.expasy.org/tools/protparam.html)对正常蛋白和突变蛋白计算主要理化性质。
1.2.5.3 蛋白二级结构比对分析 应用TheEx⁃PASY(http://www.expasy.ch/)和蛋白质二级结构预测软件predictprotein(https://www.predictprotein.org/)对蛋白二级结构进行预测和比对,分析鉴别正常与突变蛋白在变异位点附近是否会造成二级结构的改变,进而推断变异是否存在致病性。
1.2.5.4 蛋白三级结构对比分析 应用SWISS⁃MODEL(http://swissmodel.expasy.org/)对正常蛋白和突变蛋白三级结构进行预测和比对,初步推断突变对HES7蛋白三级结构的影响情况,进一步推测变异是否存在致病性。
1.2.5.5 PolyPhen⁃2 软件预测变异是否存在致病性通过登录软件polyphen⁃2 在线网址(http://genetics.bwh.harvard.edu/pph2/),按照要求输入相关信息,对变异位点进行致病性预测分析。
2 结果
2.1 医学外显子组测序结果
2.1.1 高通量测序数据质控参数
基因包检测区间覆盖有人类基因组中致病机制明确的4 000 个相关基因,74 566 个编码区总共含有12 424 088 个碱基。平均覆盖深度256+/-180X,大于10X 覆盖区间占97.4%,大于20X 覆盖区间占94.4%,参考序列版本号:GRCh37/hg19。
2.1.2 相关基因医学外显子检测突变结果
通过数据分析后发现先证者HES7基因存在(NM_001165967)c.674T>C(p.F225S)位点纯合变异。
2.2 Sanger测序验证
对PCR 产物进行Sanger 测序,发现先证者HES7基因c.674T>C(p.F225S)纯合变异,父母分别为该位点变异携带者,与高通量测序结果一致。见图2。

图2 HES7 基因c.674T>C(p.F225S)位点sanger 测序图Figure 2 Sanger sequencing of c.674T>C(p.f225s)ofHES7 gene
2.3 变异位点的致病性分析
2.3.1 突变部分氨基酸物种间保守性分析
通过查找数据库,分析HES7基因第225 位氨基酸在已知的不同物种间的保守性。见图3。
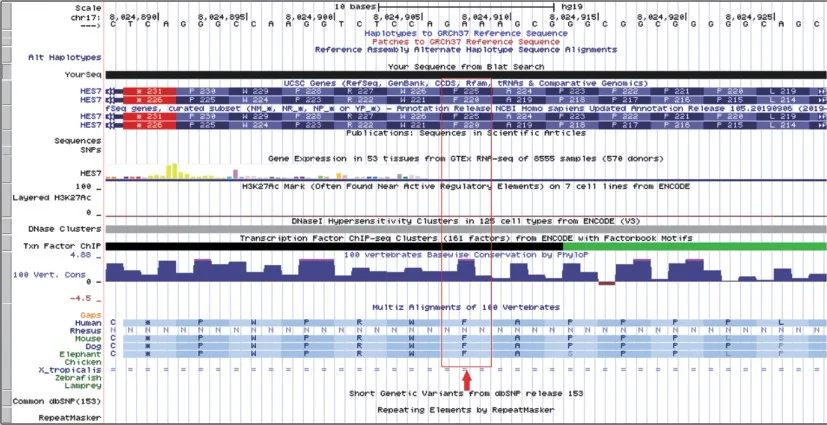
图3 HES7 基因c.674T>C(p.F225S)在不同物种间保守性分析Figure 3 HES7 gene c.674T>c(p.f225s)conservative analysis in different species
2.3.2 蛋白一级结构比对分析
通过TheExPASY 软件的Protparam 工具计算分析正常蛋白和突变蛋白主要理化性质。见表1。

表1 野生型及突变型理化性质对比Table 1 physical and chemical properties between wild type and mutant type
2.3.3 蛋白二级结构及三级结构比对分析 比对发现B 蛋白的α 螺旋与β 片层结构域发生了变化;C 表示野生型蛋白的三级结构,D 表示突变型蛋白的三级结构,分析后发现C 与D 结构也发生了部分空间结构变化(箭头所指位置)。见图4。
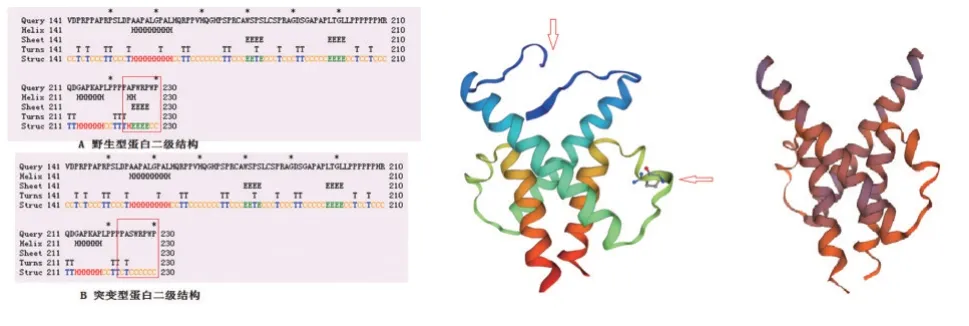
图4 野生型与突变型蛋白质的二级结构与三级结构比对图Figure 4 Comparison of secondary and tertiary structures of wild⁃type and mutant⁃type proteins
2.3.4 PolyPhen⁃2 软件初步预测结果
将蛋白质ID 号与突变氨基酸位置及突变前后的氨基酸简写输入相应位置,初步预测分值为0.957。见图5。

图5 PolyPhen⁃2 预测HES7 基因c.674T>C(p.F225S)位点变异致病可能性Figure 5 Polyphen⁃2 predicted the pathogenicity of HES7 gene c.674T>C(p.f225s)
3 讨论
SCDO 是一种罕见的先天性轴向骨骼发育异常,其在胚胎发育过程中因体节(椎骨,肋骨及相关肌腱和肌肉的前体组织)破裂而形成,脊椎肋骨发育不全可分为五型,相关类型及致病基因分别为:DLL3(SCDO1:MIM277300),MESP2(SCDO2:MIM 608681),LFNG(SCDO3:MIM609813),HES7(SCDO4:MIM613686)和TBX6(SCDO5:MIM122600)[4⁃10]。研究发现这些基因均为Notch 信号通路的重要组成部分,而Notch 信号通路通过调节成骨和破骨细胞谱系细胞的分化和功能,进而对软骨形成、骨形成和破骨过程产生重要的调控作用,因而该信号通路的失控将导致骨骼发育异常[11⁃13]。目前国内外与SCDO 相关致病变异报道较为少见,亦无明确的SCDO 发病率数据。本研究中的人类HES7基因位于17p13.1,共有4 个外显子,是Notch 信号传导的直接靶基因,通过信号通路调控体节形成从而参与调控脊椎的正常发育。相关文献报道HES7基因还通过调控LFNG(Notch 信号通路核心基因)等多个效应基因构成复杂的分节时钟,精密地调控体节的分节过程[14]。Sparrow 等学者[9]研究发现HES7基因上的致病突变会导致神经管缺陷,Bessho 等[15]研究发现在敲除HES7基因的小鼠中因为体节分节不能完全正常进行,最终会导致肋骨和脊椎的严重畸形。
本研究中常规超声检查发现胎儿存在脊柱异常,孕妇本人又曾多次孕育脊柱异常胎儿,这些均在较大程度上提示该异常可能为某种遗传因素所导致的遗传性疾病,但常规羊水染色体及CMA 检测结果均未发现异常。为进一步探寻可能存在的致病原因,后续采用高通量测序的方法针对胎儿、孕妇及孕妇丈夫进行家系分析,最终在HES7基因上发现了一个与胎儿超声表型密切相关的变异位点。通过分析突变位点所在氨基酸在已知不同物种间高度保守性情况,突变前后蛋白的主要理化性质,二级结构与三级结构,结合相关软件预测结果,综合判断分析后认为该位点为致病变异位点的可能性大,与胎儿的异常表型关系较密切。
由于导致脊柱肋骨发育不全的因素十分复杂,目前国内外与HES7基因导致的SCD04 相关研究报道也较少见,因而针对散发、罕见的遗传疾病的诊断,如果仅凭借影像学及临床医生的经验进行诊断,明确致病因素无疑存在较大困难和漏诊风险。高通量测序的发展以及其在检测基因变异中表现出较高的灵敏度,使得这种技术在临床检测尤其是罕见单基因遗传疾病的诊断中应用越来越普遍。随着技术的进一步发展及检测成本的不断下降,高通量测序技术为今后进一步高效准确寻找到罕见遗传病的相关致病基因,为临床医生更快更有效地进行疾病诊断及后续遗传咨询提供了科学依据。本研究虽然在一定程度上发现了可能的致病基因及位点,但针对于位点的分析均基于生物信息学预测所得,进一步的蛋白表达及功能实验将更有利于进一步阐明变异位点与疾病的关系,这也是本研究下一步需要研究的内容。

