齐墩果酸类似物合成及其体外抗肿瘤活性研究
周 颖, 孟艳秋
(沈阳化工大学 制药与生物工程学院, 辽宁 沈阳 110142)
齐墩果酸(oleanolic acid,OA)是一种常见的五环三萜类天然产物,具有广泛的生物活性,并具有保肝、降糖降脂、抗肿瘤、抗HIV等作用[1-6].但由于其水溶性差、生物利用度低、活性不高,因而限制了其在临床方面的应用.齐墩果酸的结构改造方法主要是围绕着C-3位羟基和C-28位羧基等官能团的结构修饰,从而合成一系列齐墩果酸衍生物.我们课题组自2000年以来,利用CADD对化合物与蛋白靶点的结合过程进行模拟和解析,对熊果酸、齐墩果酸、积雪草酸等五环三萜衍生物进行半合成,并已取得一定的进展[7-10].
尿激酶型纤溶酶原激活剂(uPA)简称纤溶酶.纤溶酶通过破坏细胞的结构来介导细胞入侵细胞基质,参与细胞的入侵和组织重塑,包括伤口修复、骨修复重建、血管生成、肿瘤的生长和扩散等重要过程,纤维蛋白溶解系统在恶性肿瘤的浸润和转移过程中可能起着非常重要的作用[11].肿瘤是严重危害人类健康的疾病.研究表明,实体瘤周围环境中的胞外基质蛋白、浸润性免疫细胞和间充质细胞分泌的蛋白质组等均与肿瘤的发生、发展以及肿瘤治疗的耐受性等密切相关.肿瘤微环境中一个重要调控因子——纤溶酶原激活物抑制剂1 (plasminogen activator inhibitor-1,PAI-1),不仅与组织型纤溶酶原激活物(tissue-type plasminogen activators,tPA)构成调节纤溶活性的一对关键物质,而且参与肿瘤的侵袭、浸润和转移等多个环节,并扮演重要角色[12].
结合PDB数据库中纤溶酶受体的三维晶体结构(PDB:2VNT),运用分子模拟对接方法分析了已知2VNT受体小分子抑制剂与靶酶的相互作用,解析靶蛋白发挥活性作用的关键氨基酸残基片段,确定能够与关键位点结合的活性基团,并将部分抑制剂结构中的活性基团片段创新性地引入到五环三萜母体中,主要结构改造集中在2位,引入相应活性基团[13].设计合成5个新型齐墩果酸类似物,并进行体外抗肿瘤活性测试.新合成的齐墩果酸类似物抗肿瘤活性明显高于母体化合物,值得进一步研究.
1 目标化合物的计设
CADD模拟技术在最近几年得到了迅猛发展,其能够优化设计先导化合物、进行多维模拟对接、建立药效团模型,使其在新药研发中发挥越来越重要的作用.采用分子对接方法模拟发现齐墩果酸与尿激酶型纤溶酶原激活物抑制受体(PDB编号:2VNT)中的配体(如图1)的胍基可以连接到齐墩果酸C-28位.因此,本文选用胍基为药效基团,以课题组前期研究方向为导向设计了下述化合物,对化合物进行计算机虚拟筛选、构效关系及体内外活性等进行评价(如图2).首先,将3-位羟基氧化为羰基,28-位羧基连接上胍基;其次,A环2-位生成羟亚甲基,再与苯胺反应得到化合物(如图3),以期找到抗肿瘤活性好的化合物.
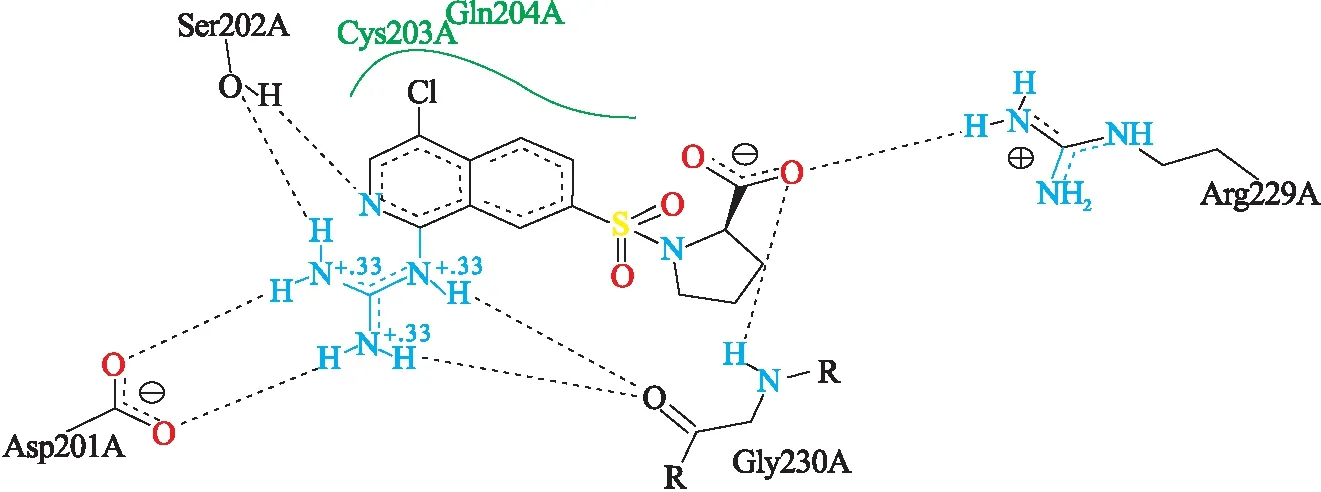
图1 2VNT配体
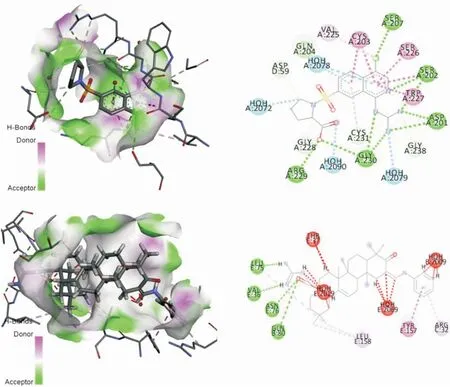
图2 2VNT配体及目标化合物活性口袋和相互作用平面图
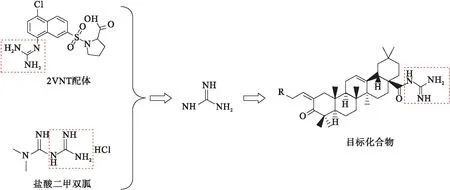
图3 新型齐墩果酸衍生物设计分析图
采用分子对接方法模拟发现,齐墩果酸衍生物OA-3、OA-4、Ⅰ1~Ⅰ3(见图4)与尿激酶型纤溶酶原激活物抑制受体(PDB编号:2VNT)都有较强的亲和能力.利用软件MVD预测并计算蛋白质与化合物的相互作用和能量,通过函数打分的形式将结果用数值来直观表达,分数表示结合自由能(escore).MVD评估2VNT与目标化合物之间的连接情况如表1所示.能量分数的绝对值越大,结合能力越强.结合分数显示:化合物Ⅰ1与受体(2VNT)的结合能力为-105.036,化合物Ⅰ3与受体(2VNT)的结合能力为-114.987,自身小分子配体与受体(2VNT)的结合能力为-100.450.化合物Ⅰ1和化合物Ⅰ3表现出与受体(2VNT)有较强的结合能力,值得进一步研究.
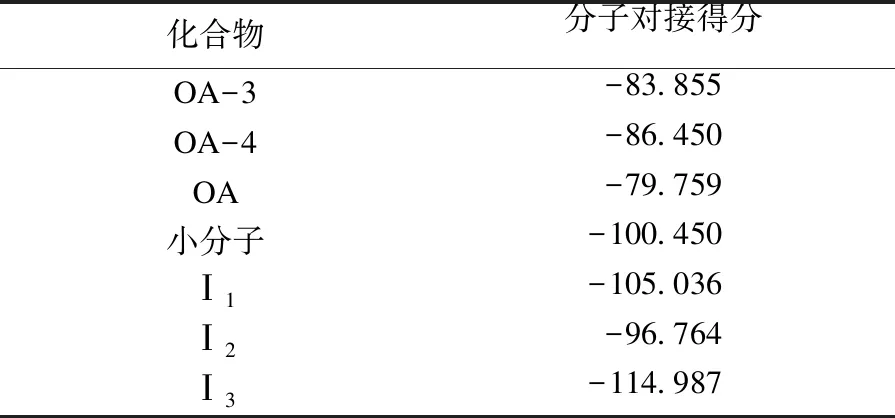
表1 纤溶酶与不同化合物能量评分的比较
2 实验部分
2.1 实验仪器
ARX-600型核磁共振分析仪,Bruker公司生产; LCQ型质谱仪,菲尼根公司生产; B-540熔点测定仪、V-855真空控制器、R-200旋转蒸发仪,Büchi公司生产; FD-5N冷冻干燥机,EYELA生产; DZF-6020真空干燥箱,上海精宏公司生产; DHG-9070A电热恒温鼓风干燥箱、TGL-16B低速台式离心机,浙江巩义予华公司生产; MCO-15AC CO2恒温培养箱,三洋公司生产; HPG-280BX光照培养箱,南京维美特科学仪器有限公司生产; SPECTRA MAX plus型酶标仪,美谷分子仪器(上海)有限公司生产; XDS-1B倒置显微镜,武汉提沃克科技有限公司生产; LDZX-40SBI型立式自动电热压力蒸汽灭菌器,上海楚工实业有限公司生产; SB-5200D超声波清洗机,江苏迅迪仪器科技有限公司生产.
2.2 合成路线
先将齐墩果酸3位羟基氧化成羰基,得到3-羰基-齐墩果烷型-12-烯-28-羧酸(OA-1),在此基础上,将28位的羧基连酰氯,得到3-羰基-齐墩果烷型-12-烯-28-酰氯(OA-2)后,在28位连上胍基,得到3-羰基-齐墩果烷型-12-烯-28-酰胺胍(OA-3),然后与甲酸乙酯反应,在碱性条件下反应12 h,得到2-羟亚甲基-3-羰基-齐墩果烷-12-烯-28-酰胺胍(OA-4),在2位上进一步引入苯胺,形成2-苯胺亚甲基-3-羰基-齐墩果烷-12-烯-28-酰胺胍类化合物Ⅰ1~Ⅰ3.目标化合物路线如图4.
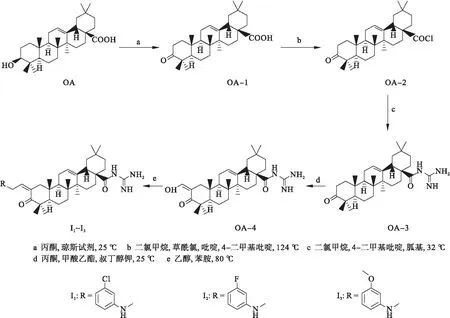
图4 合成路线
2.3 目标化合物合成
2.3.1 3-羰基-齐墩果烷型-12-烯-28-羧酸(OA-1)的制备
取OA(5.00 g,11.00 mmol)溶于丙酮(250 mL)中,冰浴下缓慢滴加新配制的Jones′试剂(500滴),10 min后撤去冰浴,并在室温下反应2.5 h,TLC跟踪检测终点[展开剂:V(丙酮)/V(石油醚)=1/5],体积分数为10 %的硫酸乙醇溶液显色.反应结束后淬灭,加入异丙醇室温搅拌45 min.减压蒸馏除丙酮和异丙醇,加入乙酸乙酯和饱和食盐水萃取,收集上层乙酸乙酯.加入无水Na2SO4和无水MgSO4混合干燥4 h,过滤,减压蒸馏浓缩,放入真空干燥箱60 ℃烘干,得粗品4.86 g,其为白色粉末状固体,产率96.9 %,mp 219.5~222.5 ℃.
2.3.2 3-羰基-齐墩果烷型-12-烯-28-酰氯(OA-2)的制备
取OA-1(4.86 g,10.68 mmol),加入经无水处理后的DCM(200 mL),搅拌溶解后加入草酰氯(1.40 mL,12.00 mmol),加热回流,TLC检测[展开剂:V(乙酸乙酯)/V(石油醚)=1/5],显色剂为体积分数为10 %的硫酸乙醇溶液.待反应完毕后,除干后的残余物中加入环己烷反复旋蒸3次,每次加入环己烷150 mL.减压蒸馏浓缩,放入真空干燥箱60 ℃烘干,得白色固体3.60 g(7.60 mol),产率69.2 %,mp 124.4~126.7 ℃.
2.3.3 3-羰基-齐墩果烷型-12-烯-28-酰胺胍(OA-3)的制备
取盐酸胍(1.10 g,12.00 mmol),溶于150 mL甲醇溶液中,搅拌溶解后加入KOH(0.70 g,12.00 mmol),反应5~10 min后对溶液进行抽滤,抽滤结束后将甲醇旋蒸.烘干后得到游离胍,其性状为白色块状固体.取中间体OA-2(3.60 g,7.60 mmol)充分溶于150 mL无水二氯甲烷中,加入游离胍1.00 g,待充分溶解后加入吡啶(10 mL)、DMAP(0.20 g,1.60 mmol),TLC检测[展开剂:V(乙酸乙酯)/V(石油醚)=1/5].反应结束后,用乙酸乙酯和饱和食盐水萃取3次,收集上层乙酸乙酯.加入无水Na2SO4干燥4 h,抽滤,蒸馏除溶剂,放入真空干燥箱60 ℃烘干,得3.276 g白色片状固体OA-3,产率89.0 %,mp 208.3~209.5 ℃.
2.3.4 2-羟亚甲基-3-羰基-齐墩果烷-12-烯-28-酰胺胍(OA-4)的制备
取上一步中间体OA-3(3.276 g,6.552 mmol),溶于100 mL无水甲苯溶液中,冰浴下加入叔丁醇钾(3.00 g,26.80 mmol),并缓慢滴加10 mL甲酸乙酯,20 min后将温度升为室温,反应12 h,TLC检测反应终点[展开剂:V(乙酸乙酯)/V(石油醚)=1/5],显色剂为体积分数为10 %的硫酸乙醇溶液.反应结束后,减压蒸馏除甲醇溶剂,得淡黄色油状物,先用稀盐酸调pH后,加入乙酸乙酯和饱和食盐水萃取3次,留乙酸乙酯层.加入无水Na2SO4和无水MgSO4混合干燥4 h,过滤,减压蒸馏除溶剂,放入真空干燥箱60 ℃烘干,得2.498 g淡黄色片状固体OA-4,产率76.25 %,mp 195.5~197.6 ℃.
2.3.5 2-间氯苯胺亚甲基-3-羰基-齐墩果烷-12-烯-28-酰胺胍(Ⅰ1)的制备
取上一步中间体OA-4(0.400 g,0.75 mmol),溶解于15 mL无水乙醇中,并加入0.80 mL间氯苯胺(0.87 g,9.34 mmol)溶液,加热回流,TLC检测[展开剂:V(乙酸乙酯)/V(石油醚)=1/5],显色剂为体积分数为10 %的硫酸乙醇溶液,4 h反应结束.加入乙酸乙酯和饱和食盐水萃取3次,留乙酸乙酯层.加入无水Na2SO4干燥4 h,过滤,减压蒸馏除溶剂,放入真空干燥箱60 ℃烘干.粗品经硅胶柱色谱纯化[洗脱剂:V(石油醚)/V(乙酸乙酯)=40/1],得0.275 g淡黄色粉末状固体Ⅰ1,产率70.0 %,mp 200.9~203.3 ℃.
2.3.6 2-间氟苯胺亚甲基-3-羰基-齐墩果烷型-12-烯-28-酰胺胍(Ⅰ2)的制备
按照Ⅰ1的制备方法,由中间体OA-4(0.400 g,0.75 mmol)与间氟苯胺(0.80 mL,4.95 mmol)反应,得0.261 g白色粉末状固体Ⅰ2,产率69.8 %,mp 212.3~213.9 ℃.
2.3.7 2-间甲氧基苯胺亚甲基-3-羰基-齐墩果烷型-12-烯-28-酰胺胍(Ⅰ3)的制备
按照Ⅰ1的制备方法,由中间体OA-4(0.400 g,0.75 mmol)与间甲氧基苯胺(1.00 g,11.23 mmol)反应,得到0.259 g白色粉末状固体Ⅰ3,产率65.3 %,mp 221.4~224.0 ℃.
2.4 初步体外活性测试
采用MTT比色法对合成的目标化合物进行体外抗肿瘤活性测试.选择人肺癌A549细胞和人胃癌SGC7901细胞为靶细胞,以阿霉素和吉非替尼为阳性对照.取体积分数为0.25 %的胰酶适度消化单层培养的细胞,用体积分数为10 %的胎牛血清细胞培养液调整细胞浓度至细胞数为每毫升2×104~4×104的单细胞悬液,接种于多孔平行培养板内.多孔平行培养板在CO2恒温培养箱中培养,在体积分数为5 %CO2、37 ℃及饱和空气湿度下培养,待细胞贴壁后,给药组加入含有不同浓度(将起始质量浓度为1000 mg/L的药品依次稀释成500 mg/L、50 mg/L、5 mg/L、0.5 mg/L、0.05 mg/L)的测试物,至少3个平行孔,实验的空白对照组继续放入CO2培养箱培养72 h.然后每孔加入50 μL MTT溶液,37 ℃继续培养4 h.离心除去上清液,每孔加入150 μL DMSO溶解甲臜颗粒,震荡溶解.在酶联免疫吸附检测仪波长为490 nm条件下测定光密度值(OD),计算所合成化合物对细胞的抑制率和IC50值.
抑制率=
3 结果与讨论
3.1 目标化合物的表征
以OA为原料,设计并合成了两类共5个化合物,即合成了5个新的齐墩果酸类似物,其结构经过NMR确证(如表2).

表2 目标化合物核磁数据
3.2 生物活性评价
采用MTT比色法对合成的目标化合物进行体外抗肿瘤活性测试.选择人肺癌A549细胞和人胃癌SGC7901细胞为靶细胞,以多柔比星和吉非替尼为阳性对照,计算所合成化合物对细胞的抑制率和IC50值,实验结果见表3.结果表明,在齐墩果酸母体中引入胍基可以显著提高其抗肿瘤活性.这对齐墩果酸类似物进行进一步的药理研究及其衍生物结构设计和优化具有一定的参考价值.
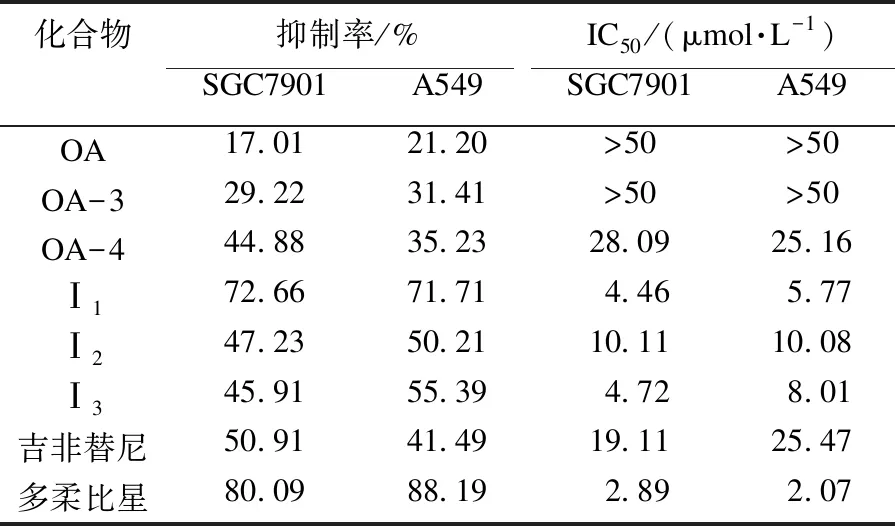
表3 靶化合物对SGC7901和A549细胞增殖的抑制活性
4 结 论
运用CADD分析已知抗肿瘤靶点纤溶酶受体和抑制剂相互作用,设计了5个新的OA衍生物目标化合物,将其与纤溶酶受体蛋白对接,并用MVD计算预测合成的所有化合物与纤溶酶受体蛋白的结合情况.结果表明,合成的化合物与纤溶酶受体蛋白均具有良好的结合能力.经化学合成得到5个新的OA衍生物,目标化合物结构经NMR确认.同时,体外药理实验表明,所合成的化合物对人肺癌A549细胞和人胃癌SGC7901细胞均具有抑制活性.初步构效关系表明,在齐墩果酸的2位引入苯胺亚甲基可增强活性,C-28位胍基化也具有一定的增强活性的作用,且苯环上的吸电子基团不利于抗肿瘤活性(Ⅰ1>Ⅰ3>Ⅰ2).其中Ⅰ1和Ⅰ3对人肺癌A549细胞的IC50值分别为5.77 μmol/L、8.01 μmol/L,对人胃癌SGC7901细胞的IC50值分别为4.46 μmol/L、4.72 μmol/L,对肿瘤细胞显示出较强的抑制作用.纤溶酶体蛋白抑制实验表明,化合物Ⅰ3对纤溶酶受体表现出较强的抑制活性.本研究结果对进一步优化设计齐墩果酸衍生物作为纤溶酶受体抑制剂的研究具有参考价值.此外计算机辅助药物设计方法显示,目标化合物与受体蛋白2VNT结合能力强弱基本与纤溶酶受体抑制实验显示的抑制活性一致,表明计算机辅助药物设计方法在新药发现与开发中的研究具有参考价值.

