HOTAIR与miR-613表达对食管鳞癌细胞增殖和凋亡影响
陈志军 曹克鑫 朱德奇 甘绍印 王忠民


[摘要] 目的 探討HOX转录反义RNA(HOTAIR)和微小RNA(miR)-613在食管鳞癌细胞中的调控关系及其对细胞增殖与细胞凋亡的影响。
方法 采用实时荧光定量聚合酶链反应(RT-qPCR)检测食管鳞癌细胞中HOTAIR和miR-613的表达情况,双荧光素酶报告基因实验检测HOTAIR和miR-613靶向关系,CCK-8法和流式细胞仪检测细胞增殖和凋亡。
结果 与其他食管鳞癌细胞相比,人食管鳞癌细胞株Eca-109细胞中HOTAIR表达最高而且miR-613表达水平最低(F=48.56、56.28,P<0.05)。HOTAIR可靶向调控miR-613的表达。下调HOTAIR的表达明显抑制了Eca-109细胞增殖,提高了细胞凋亡和miR-613表达水平(F=205.28~396.53,P<0.05);抑制miR-613表达后,Eca-109细胞增殖能力明显增强,而细胞凋亡能力明显减弱(F=51.04、511.37,P<0.05)。
结论 下调HOTAIR可通过调控miR-613表达抑制食管鳞癌Eca-109细胞增殖并促进其凋亡。
[关键词] 食管鳞状细胞癌;HOX转录反义RNA;RNA,长链非编码;微RNAs;细胞增殖;细胞凋亡
[中图分类号] R735.1;R342.2
[文献标志码] A
[文章编号] 2096-5532(2021)05-0736-06
doi:10.11712/jms.2096-5532.2021.57.171
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.r.20211029.1732.002.html;2021-11-02 13:27:02
EFFECT OF THE EXPRESSION OF HOX TRANSCRIPT ANTISENSE INTERGENIC RNA AND MICRORNA-613 ON THE PROLIFERATION AND APOPTOSIS OF ESOPHAGEAL SQUAMOUS CELL CARCINOMA CELLS
CHEN Zhijun, CAO Ke-
xin, ZHU Deqi, GAN Shaoyin, WANG Zhongmin
(Department of Thoracic Surgery, The First Affiliated Hospital of Xinxiang Medical University, Xinxiang 453100, China)
[ABSTRACT] Objective To investigate the regulatory role of HOX transcript antisense intergenic RNA (HOTAIR) and microRNA-613 (miR-613) in esophageal squamous cell carcinoma cells and their effect on cell proliferation and apoptosis.
Me-
thods Quantitative real-time PCR was used to measure the expression of HOTAIR and miR-613 in esophageal squamous cell carcinoma cells; dual luciferase reporter gene assay was used to detect the targeting relationship between HOTAIR and miR-613; CCK-8 assay and flow cytometry were used to measure cell proliferation and apoptosis.
Results Compared with other esophageal squamous cell carcinoma cell lines, the human esophageal squamous cell carcinoma cell line Eca-109 had the highest expression level of HOTAIR and the lowest expression level of miR-613 (F=48.56,56.28;P<0.05). HOTAIR showed targeted regulation of miR-613 expression. Downregulation of HOTAIR expression significantly inhibited the proliferation of Eca-109 cells and increased cell apoptosis and the expression level of miR-613 (F=205.28-396.53,P<0.05). After the expression of miR-613 was inhibited, Eca-109 cells showed a significant increase in proliferation and a significant reduction in apoptosis (F=51.04,511.37;P<0.05).
Conclusion Downregulation of HOTAIR can inhibit the proliferation and promote the apoptosis of Eca-109 cells by regulating the expression of miR-613.
[KEY WORDS] esophageal squamous cell carcinoma; HOX transcript antisense intergenic RNA; RNA, long noncoding; microRNAs; cell proliferation; apoptosis
食管癌是一种发病率和病死率均很高的消化道恶性肿瘤,其中腺癌和鳞状细胞癌是常见的病理类型,而我国以食管鳞状细胞癌最为常见。过去十几年来,全球食管癌的发病率急剧升高[1],而预计未来几十年,其发病率还将持续升高,严重威胁着人类身体健康[2]。尽管手术切除、新辅助放化疗等使食管癌病人的疗效有所改善,但病人5年内的总生存率仍然较低[1,3]。因此,为了更好地治疗食管癌而深入研究其发病机制是十分必要的。HOX转录反义RNA(HOTAIR)是一种具有反式转录调控作用的长链非编码RNA(lncRNA),定位于hoxc基因座,全长2 158 nt,在多种实体瘤中异常高表达,通过与微小RNA(miRNA)的相互作用,参与肿瘤的发生发展[4]。HOTAIR在多种肿瘤中异常高表达并发挥着重要的促癌作用[5],在食管鳞癌中HOTAIR参与了肿瘤细胞增殖、侵袭和凋亡等的调控[6],但其在食管鳞癌中的作用机制尚不完全明确。miR-613是一类与肿瘤发生和发展密切相关的短链非编码RNA(NcRNA),被证实在喉鳞癌和胃癌等肿瘤中异常表达,并在癌细胞增殖、侵袭和迁移等生物学过程中发挥着重要作用[7-8]。miR-613在食管鳞癌组织和血清中异常低表达,与病人肿瘤分期和预后不良密切相关[9],但其在食管鳞癌中的作用并不清楚。本研究通过体外细胞实验观察HOTAIR和miR-613在食管鳞癌细胞中的表达,并进一步探讨了二者的相互作用关系及其在食管鳞癌细胞增殖和凋亡中的作用。
1 材料与方法
1.1 实验材料
青链霉素双抗和RPMI 1640培养基(加拿大Gibco公司),胎牛血清(杭州四季青公司),RNA反转录试剂盒和实时荧光定量聚合酶链反应(RT-qPCR)检测试剂盒(大连宝生物工程),miR-613 模拟物(mimics)、miR-613抑制剂(inhibitor)及模拟物对照(mimics-NC)、抑制剂对照(inhibitor-NC)和HOTAIR干扰序列si-HOTAIR(5′-CAUAUUA-
UAGAGUUGCUCUGUGCUG-3′)及其阴性对照si-NC(5′-GAGUAUGUGAGAUUAACUGGUGG-
C-3′)(上海吉玛公司),Trizol试剂和转染试剂脂质体3000(美国Invitrogen公司),膜联蛋白 V-FITC(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒(大连美仑生物公司),细胞计数(CCK-8法)试剂盒(上海碧云天生物公司),双荧光素酶活性检测试剂盒(上海泽叶生物公司)。
1.2 实验方法
1.2.1 细胞来源及其培养 人食管鳞癌细胞株Eca-109和EC9706购于中国科学院上海生物研究所细胞库,而人食管鳞癌细胞株KYSE450购自上海雅吉生物公司。使用含体积分数0.10胎牛血清和RPMI 1640的培养基,在含体积分数0.05 CO2、37 ℃和湿度饱和的细胞培养箱中常规培养Eca-109、EC9706和KYSE450细胞株,每2 d换液1次。待细胞贴壁80%~90%时,加入2.5 g/L胰蛋白酶消化,并以1∶2比例传代。选取长势良好的第3代指数期细胞进行实验。
1.2.2 RT-qPCR方法检测HOTAIR和miR-613的表达 向待测的食管鳞癌细胞株中加入Trizol试剂提取细胞总RNA后,使用紫外线分光光度计检测总RNA的浓度与纯度。根据RNA反转录试剂盒说明书将RNA进行反转录后,以反转录产物为模板,根据上海吉玛公司合成的PCR引物,参照RT-qPCR检测试剂盒说明书进行PCR扩增,分别以GAPDH和U6为内参照,采用2-△△Ct法评价细胞中HOTAIR和miR-613表达水平。所用PCR引物及其序列见表1。实验重复3次。
1.2.3 双荧光素酶报告基因实验 本文为了验证HOTAIR是否能与miR-613相结合,将HOTAIR基因的3′UTR克隆并重组至荧光素酶报告基因载体psiCHECK-2上,并以其作为HOTAIR的野生型(HOTAIR-WT),另将miR-613与HOTAIR基因的3′UTR结合位点进行定点突变后克隆并重组至psiCHECK-2上,并以其作为HOTAIR突变型(HOTAIR-MUT)。按转染试剂脂质体3000说明书,将以250 μL无血清培养基稀释的HOTAIR-WT/MUT质粒(4.0 μg)、miR-613 mimics/mimics-NC(含量为100 pmol)与250 μL无血清培养基稀释的脂质体3000(10 μL)混匀后加入293T细胞,其中每个处理设3个重复。转染48 h后收集各组细胞,并参照双荧光素酶活性检测试剂盒说明书检测各组细胞的荧光素酶活性。实验重复3次。
1.2.4 细胞转染 ①HOTAIR基因影响Eca-109细胞增殖凋亡和miR-613表达的实验:分为对照组(a组,未转染)、si-NC组(b组,转染si-NC)和si-HOTAIR组(c组,转染si-HOTAIR),每组设3个重复。②miR-613影响Eca-109细胞增殖凋亡实验:分为si-HOTAIR组(a组,转染si-HOTAIR)、si-HOTAIR+inhibitor-NC组(b组,共转染si-HOTAIR和inhibitor-NC)和si-HOTAIR+miR-613 inhibitor組(c组,共转染si-HOTAIR和miR-613 inhibitor),每组设3个重复。将指数期Eca-109细胞以每孔4×105个接种至6孔细胞板上,置于细胞培养箱内常规培养。待细胞达70%~80%融合度时,根据实验分组参照转染试剂脂质体3000说明书步骤,将以250 μL无血清培养基稀释的si-NC、si-HOTAIR、inhibitor-NC和miR-613 inhibitor(母液为20 μmol/L,1.56 μL)分别与250 μL无血清培养基稀释的脂质体3000(10 μL)混合,混匀后加入到Eca-109细胞中。转染5 h后更换新鲜培养基,继续培养48 h后,收集各组细胞并采用RT-qPCR检测细胞中HOTAIR和miR-613的表达水平以评价转染效果。
1.2.5 CCK-8法检测细胞增殖 将转染48 h后的si-NC组、si-HOTAIR组和未转染的对照组以每孔105个接种至96孔细胞板上后,置于细胞培养箱中常规培养。待培养至所需时间12、24、48和72 h后,弃培养液并参照CCK-8试剂盒说明书分别检测各组细胞的光密度(OD)值。另外,转染48 h后si-HOTAIR组、si-HOTAIR+inhibitor-NC组和si-HOTAIR+miR-613 inhibitor组细胞的增殖活力检测方法同上。实验重复3次。
1.2.6 流式细胞仪检测细胞凋亡 收集转染48 h后的si-NC组、si-HOTAIR组和未转染的对照组细胞,分别以磷酸缓冲液洗涤3次后,参照Annexin V-FITC/PI细胞凋亡检测试剂盒说明书检测各组细胞凋亡率。同时,采用相同方法检测转染48 h后si-HOTAIR组、si-HOTAIR+inhibitor-NC组和si-HOTAIR+miR-613 inhibitor组细胞凋亡率。实验重复3次。
1.3 统计学处理
采用SPSS 22.0软件进行统计学分析。计量资料数据以±s表示,3组间均数的比较使用单因素方差分析,组间多重比较采用SNK法,两组间均数的比较采用独立样本t检验,3组间细胞增殖均数随时间变化采用析因设计的方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 HOTAIR和miR-613在食管鳞癌细胞株中的表达
采用RT-qPCR检测3种食管鳞癌细胞株Eca-109、KYSE-450和EC9706中HOTAIR的相对表达水平。单因素方差分析结果显示,3种细胞株HOTAIR的相对表达水平差异有统计学意义(F=56.28,P<0.05);多重比较结果显示,与KYSE-450细胞和EC9706细胞相比,HOTAIR在Eca-109细胞中的表达水平相对较高(P均<0.05)。单因素方差分析结果显示,3种细胞株miR-613的相对表达水平差异有统计学意义(F=48.56,P<0.05);多重比较结果显示,miR-613在Eca-109细胞中的表达水平均明显低于KYSE-450细胞和EC9706细胞(P均<0.05)。见图1A、B。故选用Eca-109细胞株进行后续实验。
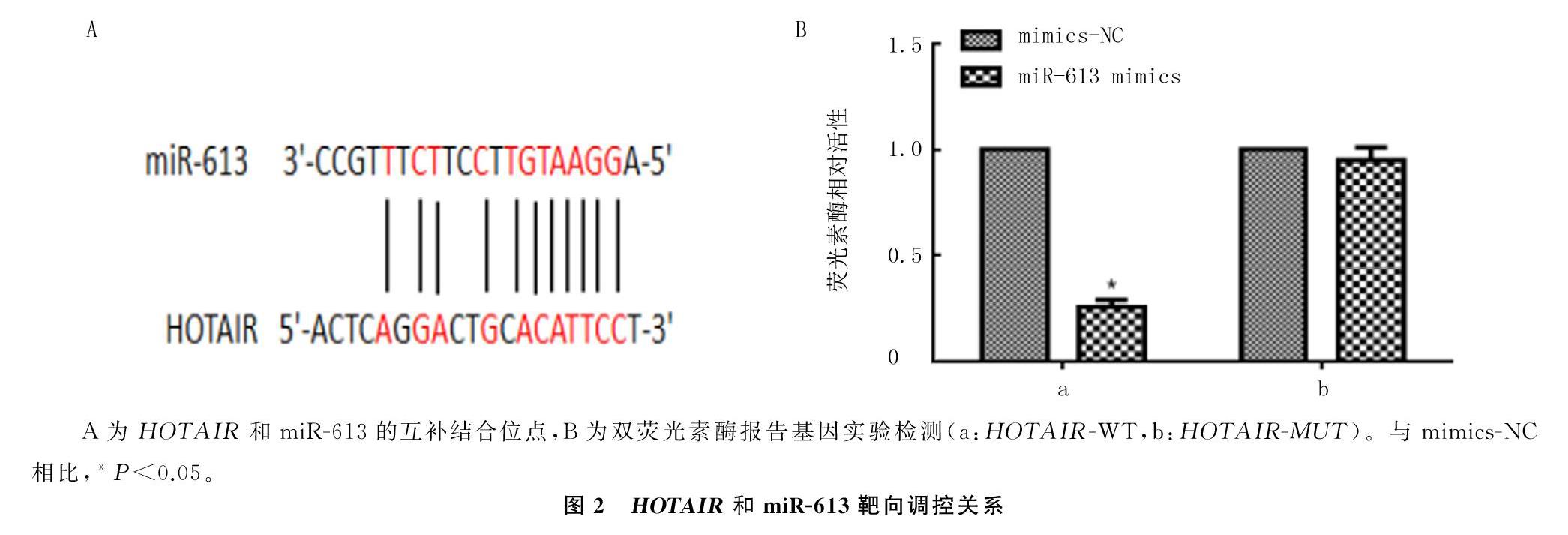
2.2 HOTAIR和miR-613靶向关系的验证
采用PicTar、miRanda、TargetScan和Microcosm Targets生物信息学软件预测显示,HOTAIR和miR-613存在互补的结合位点。双荧光素酶报告基因实验的检测结果显示,与mimics-NC相比,miR-613 mimics可使转染HOTAIR-WT质粒细胞的荧光素酶活性降低(t=33.09,P<0.05),但对转染HOTAIR-MUT质粒细胞的荧光素酶活性无明显影响(P>0.05)。见图2A、B。
2.3 HOTAIR对食管鳞癌Eca-109细胞增殖凋亡和miR-613表达的影响
本文RT-qPCR的检测结果显示,在3组细胞中HOTAIR和miR-613表达整体比较有显著差异(F=346.54、396.53,P<0.05),轉染si-HOTAIR后细胞中HOTAIR表达水平明显低于对照组(P<0.05),而miR-613的表达水平则明显高于对照组(P<0.05),但转染si-NC对HOTAIR和miR-613的表达无明显影响(P>0.05)。见图3A、E。CCK-8法检测结果的析因设计方差分析显示,F组别=26.58、P<0.05,F时间=40.62、P<0.05,F组别×时间=12.85、P<0.05;单独效应结果显示,作用12 h和24 h时间下,3组细胞的OD值差异无显著性(P>0.05);作用48 h和72 h时间下,3组细胞的OD值存在显著差异(F=94.92、35.48,P<0.05);转染si-HOTAIR 48、72 h后Eca-109细胞增殖活力较对照组明显受到抑制(P<0.05),但转染si-NC对Eca-109细胞增殖无明显影响(P>0.05)。见图3B。同时,流式细胞仪检测结果显示,3组细胞凋亡率之间存在着明显差异(F=205.28,P<0.05)。与对照组相比,转染si-NC后Eca-109细胞凋亡率无明显变化(P>0.05),但转染si-HOTAIR 可使Eca-109细胞凋亡率明显升高(P<0.05)。见图3C、D。
2.4 miR-613对食管鳞癌Eca-109细胞增殖和凋亡的影响
本文RT-qPCR检测结果显示,miR-613在si-HOTAIR组、si-HOTAIR+inhibitor-NC组和si-HOTAIR+miR-613 inhibitor组细胞中的表达存在显著差异(F=511.37,P<0.05);转染miR-613 inhibitor后Eca-109细胞中miR-613表达水平较si-HOTAIR组降低(P<0.05),而转染inhibitor-NC后细胞中的miR-613表达与对照组比较则无明显变化(P>0.05)。见图4A。CCK-8法检测结果的析因设计方差分析显示,F组别=29.22、P<0.05,F时间=48.87、P<0.05,F组别×时间=16.74、P<0.05;单独效应结果显示,转染12 h和24 h后3组细胞的OD值无明显差异(P>0.05);作用48 h和72 h时间下,3组细胞的OD值存在显著差异(F=66.74、59.64,P<0.05);与si-HOTAIR组相比较,转染miR-613 inhibitor 48 h后Eca-109细胞增殖活力明显升高(P<0.05),而转染inhibitor-NC对Eca-109细胞增殖活力无明显影响(P>0.05)。见图4B。另外,3组细胞凋亡率有显著性差异(F=51.04,P<0.05);转染miR-613 inhibitor后Eca-109细胞凋亡率较si-HOTAIR组明显降低(P<0.05),而转染inhibitor-NC后其细胞凋亡率与si-HOTAIR组比较无显著差异(P>0.05)。见图4C、D。
3 讨 论
食管癌的发病机制十分复杂,与多种致癌基因和抑癌基因的异常改变和调控失调密切相关[10-11]。而人类大约有98%的DNA会转录成lncRNA和NcRNA[12],其中lncRNA是一类长度超过200 nt的RNA,可通过与肿瘤相关的miRNA相互作用,参与肿瘤的发生与发展;而miRNA是一类长度约为22 nt的NcRNA,可以通过调控相关靶基因的表达,在细胞增殖、凋亡中发挥着重要作用;部分异常表达的lncRNA或miRNA在肿瘤中发挥着癌基因或抑癌基因的作用[13-14]。因此,深入研究lncRNA和miRNA在食管癌中的作用十分必要。
HOTAIR是首个被发现的有反式调控作用的lncRNA,可通过与甲基化酶复合体RPC2共同作用,调控与肿瘤相关的PTEN和p21等基因的表达,在肿瘤细胞增殖和凋亡等过程中发挥着重要作用,被作为恶性肿瘤早期诊断、预后预测和基因治疗的分子标记物和潜在治疗靶点[5]。HOTAIR在乳癌、宫颈癌和结直肠癌等肿瘤中异常高表达,可以通过调控miR-20a-5p、miR-143-3p和miR-203a-3p等的表达影响细胞增殖和凋亡等促进肿瘤的发生发展[15-17]。本研究通过转染HOTAIR干扰序列成功下调食管鳞癌细胞株Eca-109细胞中HOTAIR表达,结果显示,Eca-109细胞增殖能力明显减弱且细胞凋亡能力明显增强。这与崔广晖等[6]报道的干扰HOTAIR可抑制食管鳞癌EC9706细胞增殖并促进其凋亡的结果相吻合。该结果在另一种食管鳞癌Eca-109细胞中证实了HOTAIR的促癌作用。
miR-613在不同肿瘤组织中存在异常表达,且发挥的作用不尽相同。在宫颈癌中miR-613表达较邻近正常组织高表达,而上调其表达可通过靶向调控酪氨酸蛋白磷酸酶非受体型9促进肿瘤细胞增殖、侵袭和迁移[18]。在骨肉瘤中miR-613表达下调,miR-613表达升高可通过直接抑制趋化因子受体4表达抑制骨肉瘤细胞的增殖、迁移和诱导凋亡[19]。miR-613被证实在食管鳞癌中异常低表达,被认为是食管鳞癌病人总生存率和无进展生存率独立预后因子[9]。有研究证实,HOTAIR可通过竞
争性吸附miR-613调控胰腺癌细胞增殖、细胞周期和凋亡等发挥促癌作用[20]。本研究先在生物信息学软件中预测到HOTAIR和miR-613存在着互补的结合位点,两者之间可能在食管鳞癌细胞中存在着相互作用关系;通过双荧光素酶报告基因实验检测证实miR-613可与HOTAIR 3′UTR靶向结合;同时,RT-qPCR检测证实下调HOTAIR表达可引起食管鳞癌Eca-109细胞中miR-613表达升高;另外,转染miR-613 inhibitor成功下调miR-613表达后明显促进了Eca-109细胞增殖并抑制其凋亡。本文研究结果表明,在食管鳞癌中HOTAIR可靶向调控miR-613表达,低表达的miR-613可通过调控细胞增殖和凋亡促进食管癌的发生发展。
综上所述,HOTAIR可通过靶向调控miR-613在食管鳞癌Eca-109细胞增殖和凋亡过程中发挥着重要作用,该结果进一步丰富了HOTAIR促进食管鳞癌恶性发展的分子机制,为HOTAIR有望成为靶向治疗食管鳞癌的后续靶基因提供了新的参考依据。
[参考文献]
[1]HUANG F L, YU S J. Esophageal cancer: risk factors, genetic association, and treatment[J]. Asian Journal of Surgery, 2018,41(3):210-215.
[2]赵超,王寒. 阿司匹林与消化道肿瘤关系的发现及研究进展[J]. 河北医科大学学报, 2018,39(9):1091-1095.
[3]SHORT M W, BURGERS K G, FRY V T. Esophageal Can-
cer[J]. American family physician, 2017,95(1):22-28.
[4]羅宝洋,蔡辉华,安勇,等. 长链非编码RNA-HOX转录反义RNA与微小RNA的相互调控在肿瘤中的研究进展[J]. 中华实验外科杂志, 2018,35(3):585-588.
[5]TANG Q, HANN S S. HOTAIR: an oncogenic long non-coding RNA in human cancer[J]. Cellular Physiology and Biochemistry, 2018,47(3):893-913.
[6]崔广晖,崔明威,李宇航,等. 长链非编码RNA HOTAIR对食管鳞癌细胞EC9706恶性生物学行为的影响[J]. 中华实验外科杂志, 2014,31(8):1657-1658.
[7]WANG J, YANG S J, GE W S, et al. MiR-613 suppressed the laryngeal squamous cell carcinoma progression through regulating PDK1[J]. Journal of Cellular Biochemistry, 2018,119(7):5118-5125.
[8]谢琼,胡桂明,王洪涛. miRNA-223-3p调控JAK2/STAT3信号通路对胃癌细胞增殖、凋亡、迁移的影响[J]. 郑州大学学报(医学版), 2018,53(5):629-634.
[9]管尚慧. miR-613在食管鳞癌诊断和预后中的作用[D]. 济南:山东大学, 2017.
[10]KANG M, LI Y, ZHU S T, et al. MicroRNA-193b Acts as a tumor suppressor gene in human esophageal squamous cell carcinoma via target regulation of KRAS[J]. Oncology Letters, 2019,17(4):3965-3973.
[11]刘灿,陈丹杰,余军林,等. 晚期食管鳞癌患者血清sPD-L1与组织PD-L1的表达及与预后的关系[J]. 郑州大学学报(医学版), 2019,54(4):500-503.
[12]张常,王新文,王亮,等. “垃圾”DNA的奥秘[J]. 科学通报, 2016,61(Z2):3079-3084.
[13]ZHANG R, XIA L Q, LU W W, et al. LncRNAs and cancer[J]. Oncology Letters, 2016,12(2):1233-1239.
[14]REDDY K B. MicroRNA (miRNA) in cancer[J]. Cancer Cell International, 2015,15:38.
[15]ZHAO W Y, GENG D H, LI S Q, et al. LncRNA HOTAIR influences cell growth, migration, invasion, and apoptosis via the miR-20a-5p/HMGA2 axis in breast cancer[J]. Cancer Medicine, 2018,7(3):842-855.
[16]LIU M Z, JIA J Y, WANG X J, et al. Long non-coding RNA HOTAIR promotes cervical cancer progression through regulating BCL2 via targeting miR-143-3p[J]. Cancer Biology & Therapy, 2018,19(5):391-399.
[17]XIAO Z G, QU Z, CHEN Z K, et al. LncRNA HOTAIR is a prognostic biomarker for the proliferation and chemoresistance of colorectal cancer via MiR-203a-3p-mediated wnt/β-catenin signaling pathway[J]. Cellular Physiology and Biochemistry: International Journal of Experimental Cellular Physiology, Biochemistry, and Pharmacology, 2018,46(3):1275-1285.
[18]LI W T, WANG B L, YANG C S, et al. MiR-613 promotes cell proliferation and invasion in cervical cancer via targeting PTPN9[J]. European Review for Medical and Pharmacological Sciences, 2018,22(13):4107-4114.
[19]劉春杰,刘宇,邓学坤,等. miR-32通过调控PI3K/Akt信号通路影响骨肉瘤细胞的增殖[J]. 河北医科大学学报, 2018,39(6):662-667.
[20]CAI H H, YAO J, AN Y, et al. LncRNA HOTAIR Acts a competing endogenous RNA to control the expression of notch3 via sponging miR-613 in pancreatic cancer[J]. Oncotarget, 2017,8(20):32905-32917.
(本文编辑 于国艺)

