囊胚形态学评分对单囊胚移植围产儿结局的影响
高亚谊,张琍钧,王兴玲,刘 慧,王静静,田萌萌
(1.郑州大学第三附属医院生殖中心,郑州 450052;2.河南省人民医院,郑州 450003;3.焦作市妇幼保健院生殖中心,焦作 454100)
辅助生殖技术治疗的目标是单胎、足月、健康婴儿的诞生[1]。研究发现,选择性单囊胚移植能在不损害临床妊娠率的情况下显著降低多胎妊娠率[2-3],从而降低与多胎妊娠相关的围产期并发症[4-5]、产后抑郁和焦虑[6],以及减少社会和家庭医疗经济压力[7]等。鉴于专家共识建议减少囊胚移植数目[8],选择出发育潜能更高的胚胎就显得尤为重要。
目前临床上普遍通过Gardner评分[9]方法对囊胚质量进行评估,但关于囊胚形态学指标对围产儿结局独立影响的研究较少。因此,评估囊胚每个形态学特征对围产儿结局的独立影响,可为临床单囊胚移植的安全性和有效性提供依据。
1 资料和方法
1.1 研究对象 检索2015年8月01日至2019年12月25日在郑州大学第三附属医院生殖中心接受新鲜或冷冻第5/6天单囊胚移植的妇女的临床资料。纳入标准:(1)接受体外受精(in vitro fertilization,IVF)或卵胞浆内单精子显微注射(intracytoplasmic sperm injection,ICSI)助孕治疗的患者;(2)单囊胚移植周期;(3)首次进行新鲜或冷冻胚胎移植的周期。排除标准:(1)受卵周期;(2)接受胚胎植入前基因检测(preimplantation genetic testing,PGT);(3)妊娠结局为死胎或同卵双胎;(4)子宫因素不孕;(5)复发性流产;(6)重要数据缺失。研究遵循《赫尔辛基宣言》。
1.2 促排卵方案 新鲜周期促排卵方案使用本中心常规的早卵泡期长方案和黄体中期长方案。当双侧卵巢有1~3个卵泡直径≥20mm或≥50%~60%的主导卵泡群径线≥18mm时,肌肉注射重组人绒毛膜促性腺激素(艾泽,意大利Merck Serono公司)250μg扳机。扳机后36~38h于阴道超声引导下行阴道后穹窿穿刺取卵术。
1.3 囊胚培养及评分 取卵后3~6h,根据精液样本和夫妇的病史采用IVF或ICSI对卵母细胞进行分组受精,在16~18h观察卵母细胞受精情况,培养至第3天,根据胚胎的细胞数量及碎片进行评分[10],选择1~2枚Ⅲ级以上的卵裂胚进行新鲜周期移植或冷冻保存。将剩余胚胎继续培养至第5天或第6天,根据Garnder评分标准对形成的囊胚进行评估。为了减小主观误差,由两位实验室胚胎学家共同进行评估,之后或进行新鲜囊胚移植,或将囊胚冷冻保存。胚胎培养过程均在37℃、6%CO2、5%O2和89%N2的培养箱中进行。
Garnder评分标准[9]:囊胚分期:1期:囊胚腔小于胚胎总体积的1/2;2期:囊胚腔体积大于或等于胚胎总体积的1/2;3期:完全扩张囊胚,囊胚腔完全占据了胚胎的总体积;4期:扩张囊胚,囊胚腔完全充满胚胎,透明带变薄;5期:囊胚的一部分从透明带中逸出;6期:囊胚全部从透明带中逸出。囊胚ICM分级:A级,细胞数目多,排列紧密;B级,细胞数目少,排列松散;C级,细胞数目很少。TE分级:A级,上皮细胞层由较多的细胞组成,结构致密;B级,上皮细胞层细胞不多,结构松散;C级,上皮细胞层稀疏。我中心将3期及3期以上且内细胞团评分≥B的囊胚评为可利用囊胚,用于临床移植。
1.4 胚胎冷冻及复苏 玻璃化冷冻、复苏试剂和冷冻载体均购自日本Kitazato公司。胚胎冷冻和复苏按说明书标准流程执行。胚胎解冻后移入G-2液(Vitrolife瑞典)中培养等待移植。
1.5 子宫内膜准备方案 冷冻周期内膜准备方案采用本中心常规方案,分为自然周期、人工周期和刺激周期[11]。对月经周期规律、有自发排卵且内膜生长良好的患者采用自然周期;对于排卵不规律、无排卵、黄体功能不全或子宫内膜较薄的患者,排除雌激素使用禁忌证后采用人工周期;对于月经周期不规律、有规律月经但自然周期无优势卵泡或卵泡发育停滞的患者,采用刺激周期。于内膜转化后第5天解冻囊胚进行移植。
1.6 胚胎移植后黄体支持 从内膜转化日开始持续黄体支持至胚胎移植后14天,抽血检测血β-HCG,若血β-HCG阳性,则继续进行黄体支持至胚胎移植后6周。移植后6~7周行阴道超声检查,以宫腔内见孕囊及胎心搏动确定为临床妊娠,随后根据患者情况继续黄体支持或逐渐减量至停药。
1.7 观察指标 主要的观察指标包括大于胎龄儿(large for gestational age,LGA)、小于胎龄儿(small for gestational age,SGA)、早产(preterm birth,PTB)、巨大儿(fetal macrosomia,FM)、低出生体重(low birth weight,LBW)以及子代性别比(secondary sex ratio,SSR)。小于胎龄儿和大于胎龄儿分别为出生体重≤第10百分位数和≥第90百分位数[12],早产定义为妊娠≥28周且<37周分娩,巨大儿定义为出生体重≥4000g,低出生体重指出生体重<2500g,子代性别比以男性新生儿所占百分比表示[13]。

2 结 果
2.1 患者的基线数据 研究共纳入1627个新鲜周期和3052个冷冻周期,其中812个新鲜周期和1332个冷冻周期获得了单胎活产,单胎活产率分别是49.9%和43.6%。将研究对象分为活产组与未活产组,活产组较未活产组患者的年龄、不孕年限、基础FSH值、Gn总量(仅在新鲜周期中)、起始Gn量(仅在新鲜周期中)较低,而AMH值、HCG日子宫内膜厚度(仅在新鲜周期中)、移植日子宫内膜厚度、移植优质囊胚比例较高。活产组的移植优质囊胚数明显高于未活产组。新鲜周期移植优质囊胚、囊胚形态学指标评分较高的比例高于冷冻周期。见表1。

表1 新鲜周期和冷冻周期的活产组与未活产组患者的基线数据比较
2.2 囊胚形态学评分对活产的影响 影响活产的因素非常复杂,在检索数据时排除了部分非胚胎质量因素的干扰,同时以活产结局为因变量进行二元logistic回归分析时,调整了年龄、子宫内膜厚度、体质量指数(body mass index,BMI)、抗缪勒管激素(anti-Müllerian hormone,AMH)、囊胚培养天数等混杂因素后结果显示:囊胚扩张分期与活产无明显相关(新鲜周期:P=0.117;冷冻周期:P=0.907);ICM分级是活产的独立影响因素[新鲜周期:OR(95%CI)为0.64(0.51~0.82),P<0.001;冷冻周期:OR(95%CI)为0.74(0.61~0.93),P=0.008]。TE分级是冷冻周期活产的独立影响因素(P<0.001)。见图1。
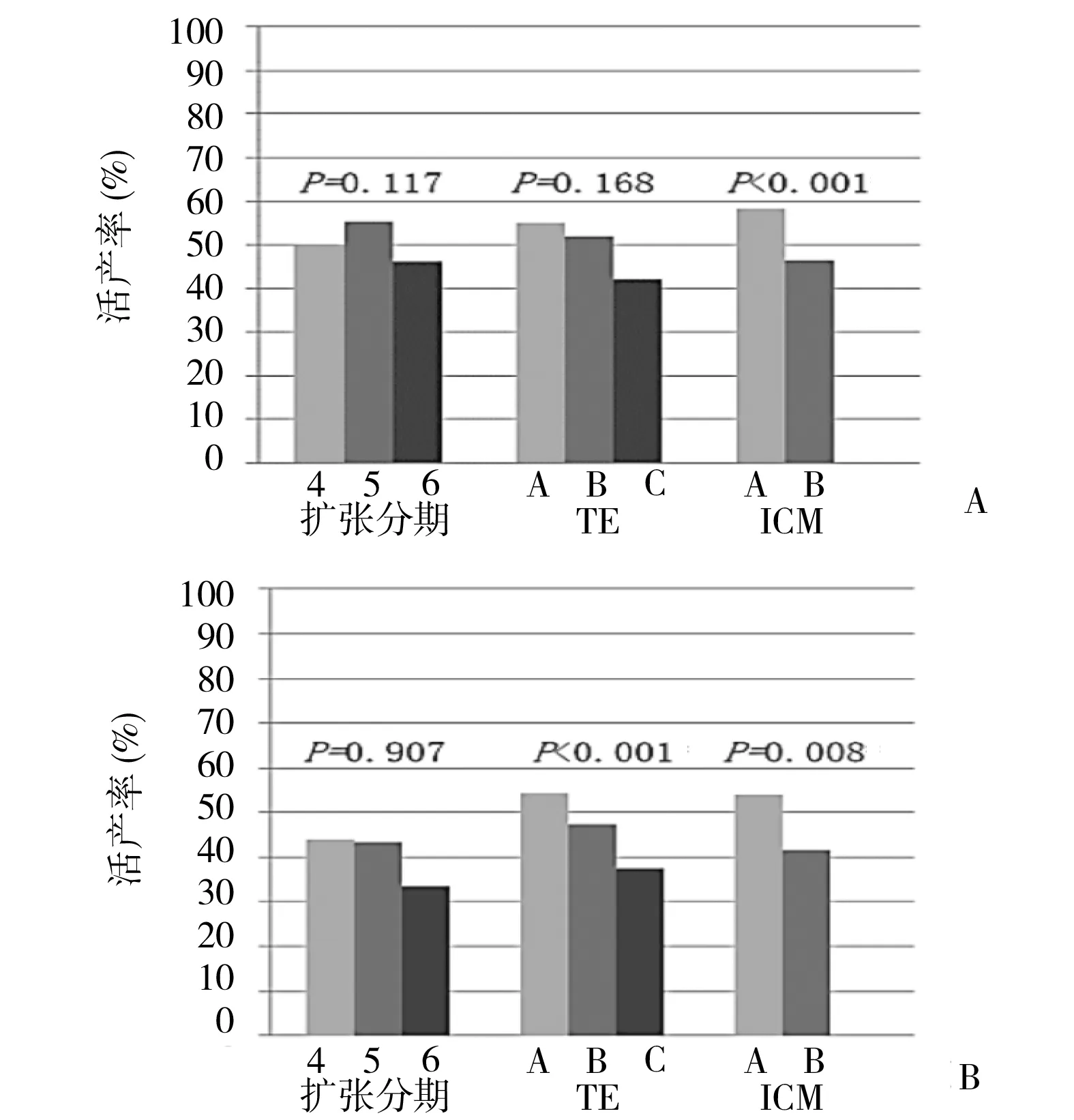
图1 新鲜周期和冷冻周期囊胚形态学评分对活产的影响A:新鲜周期;B:冷冻周期
2.3 囊胚形态学评分对围产儿结局的影响 在活产组中,以围产儿结局为因变量分别进行二元logistic回归分析,以其中一个形态学特征为因变量时,将其他两个形态学特征也作为混杂因素进行矫正,调整囊胚发育天数、年龄、BMI、AMH、移植日子宫内膜厚度等混杂因素后结果显示:囊胚扩张分期与围产儿结局(LGA、SGA、FW、LBW、PTB)无明显相关(P均>0.05)。然而,由于新鲜周期6期囊胚活产数量极少,部分变量结局发生率为0,关于新鲜周期囊胚扩张分期与围产儿结局相关性的研究结果意义有限,将来需更大样本数据进行分析。见表2。
方法同上,调整混杂因素后结果显示:囊胚ICM分级和TE分级与LGA、SGA、FW、LBW、PTB无显著相关(P均>0.05),见表2。ICM评分与子代性别比趋势相反,新鲜周期ICM分级为“B”的性别比是“A”的2.17倍(95%CI为1.51~2.94,P<0.001)。冷冻周期ICM分级为“B”的性别比是“A”的1.33倍,但差异无统计学意义(P=0.059)。不管是在新鲜周期还是在冷冻周期中,TE分级都是子代性别比的独立影响因素,TE评分越高,子代性别比就越大,调整混杂因素后,TE分级为“B”、“C”较“A”的囊胚子代性别比均降低(P均<0.05)。见表3、4。
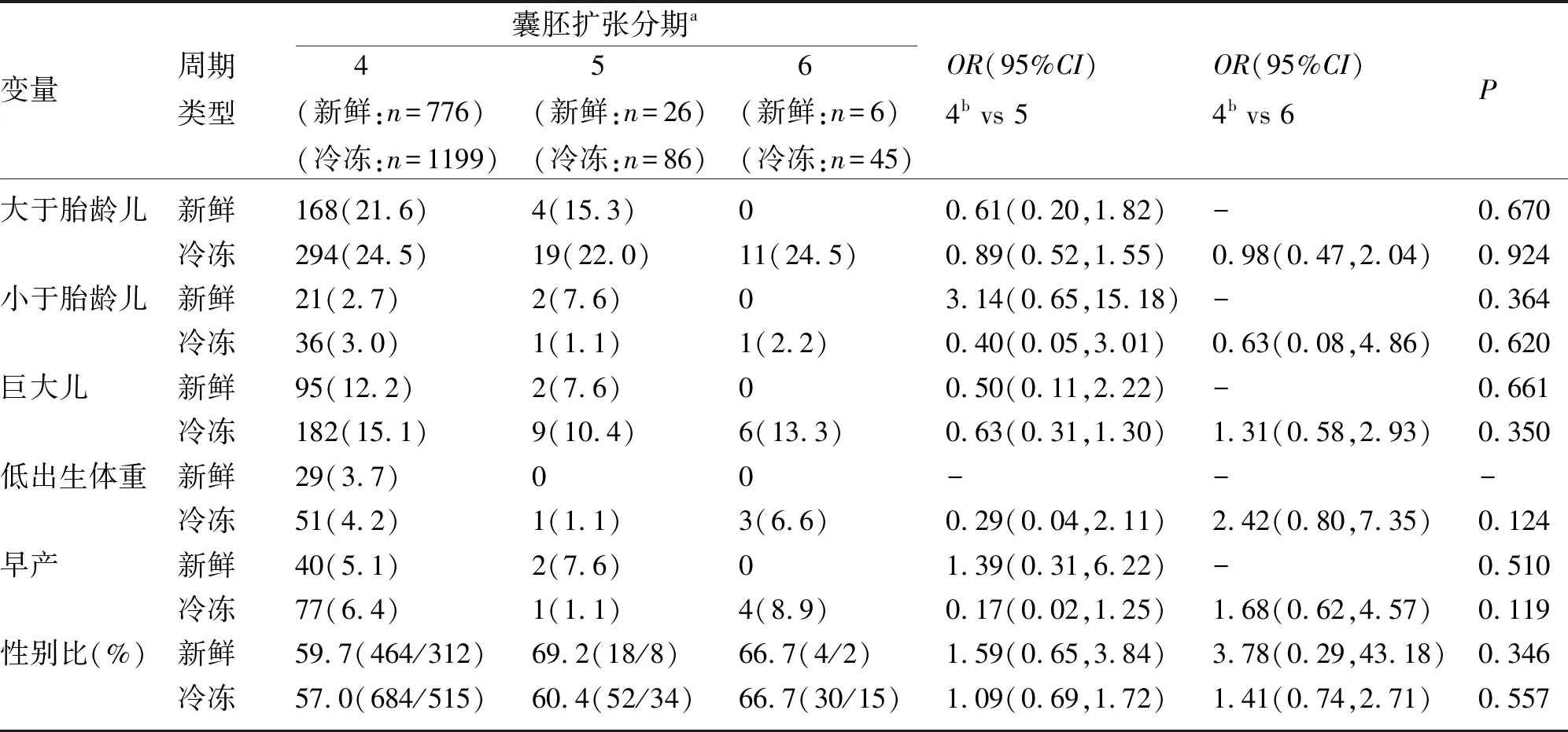
表2 囊胚扩张分期对围产儿结局的影响

表3 囊胚TE分级对围产儿结局的影响[n(%)]
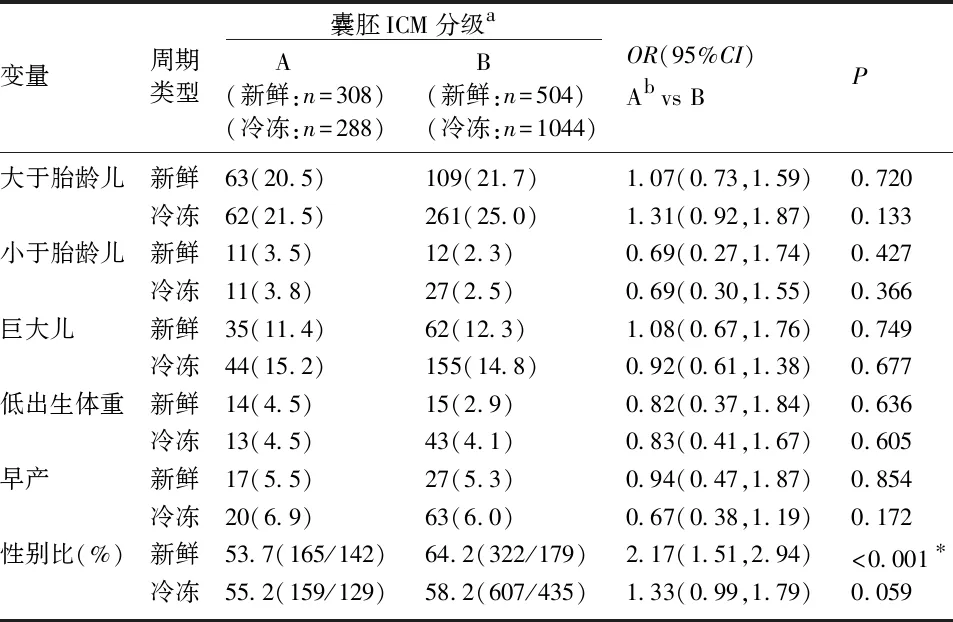
表4 囊胚ICM分级对围产儿结局的影响[n(%)]
3 讨 论
由于ICM最终会发育成胚胎,传统上认为ICM是预测妊娠结局的重要因素[14]。但最近有研究发现,TE是妊娠结局的重要预测因子[15-17],考虑到TE最终会发育成胚外组织从而支持胎儿发育,其重要性可以预见。本结果显示,囊胚ICM分级和TE分级是影响单囊胚移植活产的重要因素,但在新鲜周期和冷冻周期中的结果并不完全一致。ICM分级是活产的独立影响因素。TE分级只有在冷冻周期中与活产表现出明显的相关性。
囊胚TE分级和ICM分级与妊娠结局之间的相关机制,目前尚不明确,但在促进胚胎植入中的关键作用无可置疑。高级别TE细胞可能更容易分泌人绒毛膜促性腺激素,从而更有效且快速地启动母胎沟通[18],而ICM可能通过分泌Fgf4来促进TE细胞的增殖[19]。这些数据表明,TE和ICM之间的各种相互作用对于促进正常的胚胎发育至关重要,因此,这两类评分都应该尽量选择高级别的,以确保最佳的发育潜能。
Bakkensen等[17]发现,囊胚形态学评分与不良的围产期结局无明显相关性。张建瑞等[20]对新鲜周期和冷冻周期的妊娠结局和新生儿结局进行比较发现,优质囊胚的临床妊娠率明显高于非优质囊胚,但是不同质量囊胚的新生儿早产率、低出生体重率等无明显差异。Bouillon等[21]将799个单胎活产的周期根据移植的单囊胚质量分为4组,结果发现一旦临床妊娠,无论囊胚的形态学如何,其早产率、流产率无显著差异。本研究结果也支持这一观点,即囊胚形态学评分与不良围产儿结局无明显相关。
以往的研究显示,胚胎发育阶段与性别相关的差异非常显著,男性胚胎产生5级或6级囊胚的可能性比女性胚胎高2.6倍[22]。Wang等[23]通过对233例PGS患者的1559枚胚胎进行TE活检发现,雄性胚胎更有可能具有更高的TE等级(P<0.02)。Ebner等[24]也报道了男性囊胚显示出TE为“A”的几率高出女性2.53倍。然而Lou等[25]结果发现,TE分级为“B”的囊胚子代男性比例可能是最高的。本研究发现,新鲜周期和冷冻周期中TE分级与子代性别比具有独立相关性,TE分级越高,子代男性比例就越高。事实上,已有研究发现,人类女性胚胎比男性胚胎具有更高的葡萄糖消耗[24],这可能反映了女性胚胎为了使第二个X染色体失活而需要更多的能量,从而降低了有丝分裂速度[26]。
与TE分级相反,本结果显示ICM分级与新鲜周期单胎子代性别比呈负相关,ICM分级为“B”的囊胚子代男性比例明显高于“A”级。可能的原因是囊胚ICM与TE发育不同步,TE细胞数量在第5天和第6天相似(分别为37.9±6.0和40.3±5.0),而ICM细胞数量在第5天和第6天之间增加了1倍(分别为20.4±4.0和41.9±5.0)[27]。也就是说,由于雄性囊胚发育较快,第5天囊胚的雄性胚胎比例较高,但ICM细胞数量少,评级较低;第6天囊胚雄性胚胎比例较第5天降低,但ICM细胞数量增多,评级可能反而增高。此外,孟庆霞等[28]研究发现,囊胚形态学指标并不能预测新生儿出生性别比,但样本量较小,其活产仅277例。
本研究结果显示,不管囊胚形态学如何,一旦活产,不良围产儿结局的发生风险似乎并不会增加,包括LGA、SGA、FM、LBW和PTB。囊胚TE分级与子代性别比具有独立相关性,新鲜周期中ICM分级为“B”的囊胚较“A”男性子代的比例明显增加。但本研究同既往研究一样对纳入人群进行了筛选,得出的结论针对的是特定人群,并且对性别比的研究来说样本量过小,所以,在得出普遍结论之前,还需要更高质量、更大样本、更全面的数据进一步研究。
本研究作为单中心研究减少了不同中心促排卵方案、培养条件、囊胚形态学评分等方面的偏倚。由于临床上囊胚移植往往选择形态学等级较高的囊胚,纳入的低级别囊胚数较少,且第7天囊胚、ICM分级为“C”的囊胚被评为不可利用胚胎,移植数量极少,并未纳入最终的模型,可能造成结果的偏差,所以需要更全面的数据研究每个形态学指标和新生儿结局的相关性。
预测胚胎移植后的结局是医患普遍关注的问题,滋养外胚层活检可以明显提高植入率和活产率和降低流产率[29-30],但囊胚活检的成本较高且在中国临床实践中具有局限性。囊胚形态动力学将延时成像技术整合到形态学评估中,可显著提高妊娠率和活产率,并减少早期妊娠流产[31]。但多中心研究证明了当不同的临床医生应用这些模型时的局限性[32],有关活产率的提高和在IVF实验室中实施该技术的成本效益的证据受到质疑。沈彦军等利用列线图开发复苏周期单囊胚移植的临床妊娠结局预测模型是对辅助生殖临床预测模型领域的一项尝试[33],但其纳入变量不完整,仍缺乏有效性的验证。
染色体异常对胚胎或胎儿常具有致死效应,因此理论上进行染色体异常的筛选可以获取高妊娠潜能的胚胎。囊胚形态学评分与胚胎倍性显著相关[23,34],而且形态学评估过程不损伤胚胎、简单快捷、对设备要求低,临床上可通过囊胚形态学指标为临床囊胚移植的选择提供参考依据。然而,由于囊胚移植的历史较短,囊胚形态学评分是否影响子代寿命和子代远期的安全性仍需进一步探索。

