PD-1单抗影响复发性宫颈癌后线化疗1例报道*
彭 瑾,付梦迪,张 溪,申祥瑞,钱秋红,韩 赛,赵 颖,步华磊,张友忠*
(1.山东大学齐鲁医院妇产科,济南 250012;2.山东大学临床医学院,济南 250012)
1 病例简介
患者,女,31岁,2014年10月因“宫颈非角化鳞状细胞癌Ⅱa2”行经腹广泛子宫切除术+盆腔淋巴结清扫术,保留双侧附件。术后病理示:宫颈中低分化鳞状细胞癌,肿物切面积4cm×2.5cm,侵达颈管壁约4/5,左右宫旁及阴道壁断端未查见癌;左髂血管淋巴结查见转移。根据宫颈癌NCCN指南,应给予术后放化疗,患者强烈拒绝放疗,术后行多西他赛+卡铂静脉化疗3周期,疗效达到完全缓解(complete response,CR)。2018年11月患者复查鳞状细胞癌相关抗原(SCC) 10.24μg/L,自述右侧腹部疼痛伴腿部肿胀1+月。盆腔CT示:盆腔偏右见团块状软组织密度影,最大截面积约为5.4cm×4.4cm;双侧腹股沟见多发肿大淋巴结,考虑转移。因“宫颈癌第一次复发”行腹腔转移病灶切除术+右侧附件切除术+双侧腹股沟淋巴结切除术。患者年龄35岁,仍给予保留健侧卵巢组织。术后病理示:(右盆腔包块)为宫颈鳞状细胞癌转移。淋巴结未查见转移癌。术后给予紫杉醇脂质体+洛铂静脉化疗2周期,盆腔姑息性放疗25次,紫杉醇脂质体+顺铂静脉化疗4周期,2019年5月结束治疗,最终疗效为部分缓解(partial response,PR)。2019年8月患者复查鳞状细胞癌相关抗原(SCC):16.15μg/L。CT示:膀胱右侧见软组织密度,约34mm×24mm。考虑宫颈癌第二次复发,给予吉西他滨+顺铂化疗2周期后,复查CT示:膀胱右侧见软组织密度,较前略增大,约32mm×47mm。2019年10月复查盆腔MRI示:右侧盆腔见团块状,病变长径约65mm;尿道右缘见团块样略不规则,长径约32mm。肿瘤学评估为病情进展(progressive disease,PD)(图1、图2A)。
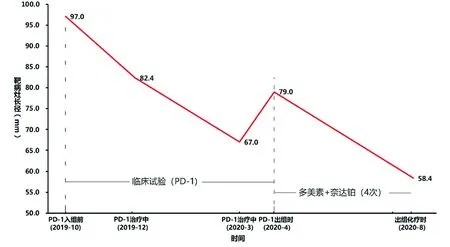
图1 PD-1单抗治疗至后线化疗期间靶病灶长径总和的变化

图2 复发性宫颈癌患者抗肿瘤治疗过程中的MR影像变化A:PD-1入组前(2019-10)基线(A1髂血管旁病灶长径:65mm;A2尿道旁病灶长径:32mm);B:PD-1治疗中(2020-03)疗效:PR(B1髂血管旁病灶长径:29mm;B2尿道旁病灶长径:38mm);C:PD-1出组时(2020-04)疗效:SD(C1髂血管旁病灶长径:15mm;C2尿道旁病灶长径:64mm);D:出组化疗时(2020-08)疗效:PR(D1髂血管旁病灶长径:28.5mm;D2尿道旁病灶长径:30.4mm)
经患者及家属知情同意后,患者于2019年10月参加嘉和生物药业有限公司关于杰诺单抗注射液(GB226)治疗含铂方案化疗失败的PD-L1阳性的复发或转移性宫颈癌患者的有效性及安全性的II期临床研究。2019年11月至2020年4月,每两周1次,剂量(mg)=体重(kg)×3,共行PD-1单抗(杰诺单抗)注射液免疫治疗9次。治疗期间,2020年3月行盆腔MRI评估示:右侧盆壁及尿道周围病灶,长径约为38mm;右侧髂血管旁病灶长径约为29mm。疗效为PR(图1、图2B)。2020年4月MRI示:右侧盆壁髂血管旁病灶长径约15mm,包绕尿道肿块长径约64mm(图1、图2C)。同时,患者出现排尿困难,尿潴留,给予留置导尿管。影像学评估为疾病稳定(stable disease,SD),因临床症状进展,患者退出PD-1单抗免疫治疗临床试验。患者在PD-1单抗免疫治疗过程中出现潮热、皮疹、尿路感染、中性粒细胞计数增高及淋巴细胞计数降低等不良反应,密切观察和对症处理后即可恢复,未出现3级及以上不良反应,未因药物不良反应降低药物剂量或停药。
患者退出临床试验后于2020年4月24日开始给予盐酸多柔比星脂质体注射液(PLD)+奈达铂静脉化疗,化疗后自觉疼痛减轻,排尿通畅,于2020年5月18日拔除导尿管。随后,行PLD +奈达铂方案28天/周期静脉化疗。2020年8月复查MRI示:尿道周围异常信号,考虑肿瘤复发或转移,肿块长径约30.4cm,范围较(2020年4月)明显缩小。影像学评估疗效为PR(图1、图2D)。
2 讨 论
宫颈癌是全球第四常见的恶性肿瘤,并且是造成全球女性死亡的第四大原因[1]。在局部晚期宫颈癌中,Ⅲa期5年生存率为35%,Ⅲb期为32%,IVa期为16%[2]。本例患者是局部晚期宫颈癌IIa2期,根据宫颈癌NCCN指南[3],本例患者在初次宫颈癌根治术后,应进行放化疗,然而患者因个人原因强烈拒绝放疗。曹泽毅等[4]曾对全国61所医院的1753例治疗后1年内未控与复发妇科肿瘤患者行回顾性分析,结果显示428例未控与复发的宫颈癌患者中,396例行放疗,放疗剂量适当者157例,仅占36.68%。孟志英等[5]研究显示,未行规范治疗的宫颈癌患者的5年生存率更低,同时局部复发率及远处转移率更高。因此,规范治疗方案是提高宫颈癌患者生活质量及远期预后的重要措施。
对于复发性宫颈癌的治疗,根据NCCN指南[3],一般认为局部复发既往无放疗史或复发灶位于既往放疗野外,可手术切除病灶,再行放疗+含铂方案化疗±近距离放疗。本例患者年轻且无放疗病史,初次复发后,给予再次手术治疗及放化疗,临床疗效达到PR。因化疗副作用中断治疗3个月后,给予吉西他滨联合顺铂化疗,临床疗效出现PD,考虑铂耐药。对于多线化疗后进展的宫颈癌患者,均存在反应率低,反应时间短的问题[6]。根据宫颈癌NCCN指南,PD-L1阳性患者可尝试PD-1单抗免疫治疗。本例患者肿瘤组织切片免疫组化提示PD-L1检测阳性,入组嘉和生物药业有限公司关于杰诺单抗注射液(GB226)治疗含铂方案化疗失败的PD-L1阳性的复发或转移性宫颈癌患者的有效性及安全性的Ⅱ期临床研究。
PD-1单抗免疫治疗持续6个月,期间无明显不良反应,同时延长无铂间期,之后出现临床进展退出临床试验,改用盐酸多柔比星脂质体(PLD)加奈达铂方案化疗。在妇科肿瘤方面,PLD已被批准用于治疗难治性卵巢癌,但在宫颈癌的治疗方面,国内研究还较为匮乏。Rose等[7]的Ⅱ期临床研究结果显示,在接受PLD治疗的晚期或复发性宫颈癌患者中,11.1%的患者达到部分缓解,未观察到4级不良反应。Le等[8]多中心研究采用卡铂联合PLD治疗复发或转移性宫颈癌,中位无进展生存期(progression-free survival,PFS)及总体生存期(overall survival,OS)分别为22.9和49.1个周,总体缓解率为33%。在《妇科恶性肿瘤聚乙二醇化脂质体多柔比星临床应用专家共识》中[9],PLD 联合或不联合卡铂被推荐用于治疗晚期或转移性或复发性子宫颈癌。
本例复发性宫颈癌患者在铂耐药后,经PD-1单抗免疫治疗结束后,再次使用PLD联合奈达铂方案化疗,肿瘤评估达到PR。证实PLD在复发性宫颈癌中具有一定疗效,同时提示免疫治疗可能逆转铂耐药,而PD-1单抗续贯化疗可作为复发性宫颈癌患者治疗的一个选择。研究表明[10],内源抗肿瘤介质(如干扰素 γ)或化疗诱导下某些肿瘤细胞可高表达 PD-L1,抑制T淋巴细胞活性。PD-1抗体应用于PD-L1阳性的宫颈癌肿瘤,通过阻断化疗药物引起的 PD-L1/PD-1 通路激活,可能增加对化疗药物敏感性或者逆转化疗耐药。宫颈癌术后化疗的疗效除了与肿瘤细胞对化疗药物的敏感性有关外,还与机体的免疫状态有关,PD-1 与肿瘤细胞的PD-L1结合,会抑制T细胞并阻断肿瘤免疫应答,同时影响整个肿瘤免疫微环境的改变,从而影响预后[11-12]。
因此,仍需进行多中心大样本前瞻性临床研究,进一步探索PD-1单抗续贯化疗应用于复发性宫颈癌的有效性,以及PLD用于复发性或转移性宫颈癌的有效率,遵循循证医学证据,为患者提供个体化治疗,获得最大的生存获益,以推动宫颈癌的精准治疗。

