一株分离自婴儿肠道的乳双歧杆菌BL-99的菌株鉴定
于学健,刘锦浲,赵婷,马霞,刘艺茹,刘伟贤,程坤,张欣,曹艳花, 辛迪,冯慧军,刘福东,赵雯,洪维鍊,姚粟*
1(中国食品发酵工业研究院有限公司,中国工业微生物菌种保藏管理中心,北京,100015) 2(内蒙古乳业技术研究院有限责任公司,内蒙古 呼和浩特,010110) 3(内蒙古伊利实业集团股份有限公司,内蒙古 呼和浩特,010110)
动物双歧杆菌(Bifidobacteriumanimalis)和乳双歧杆菌(Bifidobacteriumlactis)具有维护肠道微生态平衡、提升免疫力等作用,具备良好的安全性和长久的安全使用历史[1],已被列入我国《可用于食品菌种名单》[2]和欧盟安全资格认定(qualified presumption of safety, QPS)名单中[3],研究表明B.animalis等益生菌的功能性和安全性特征在菌株水平具有特异性[4]。随着分类学技术的发展,B.animalis和B.lactis的分类学地位已变迁为B.animalis的2个亚种,分别为动物双歧杆菌动物亚种(B.animalissubsp.animalis)和动物双歧杆菌乳亚种(B.animalissubsp.lactis),随着各类食品资源的开发利用,新的动物双歧杆菌菌株不断涌现,目前已有多株动物双歧杆菌商业化菌株在乳制品、婴幼儿食品、保健食品等领域广泛应用,在功能性、安全性等方面存在较大差异。动物双歧杆菌乳亚种菌株BL-99是1株分离自婴儿肠道的益生菌,该菌株耐胃酸和耐肠液性能良好,具有调节胃肠道菌群、促进肠道消化、提升宿主免疫力等功效,在发酵乳、固体饮料及保健食品等领域具有广泛的应用潜力[5-8]。
益生菌菌株的精确鉴定是功能开发、安全性评价、产品质控、市场监管等领域的重要基础,建立体系完善的菌株鉴定技术体系可有效促进行业的健康快速发展。益生菌菌株鉴定通常在菌种鉴定的基础上开展[9],菌种分类学地位的确认通常可通过菌落菌体形态、生理生化特征分析、基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry, MALDI-TOF MS)等表型鉴定技术结合16S rRNA基因、平均核苷酸一致性(average nucleotide identity, ANI)分析等分子生物学鉴定技术实现[10-13]。随着微生物分类鉴定技术尤其是分子生物学的发展,菌株鉴定技术方法发展日新月异。基于全基因组测序(whole genome sequencing, WGS)的单核苷酸多态性(single nucleotide polymorphism, SNP)分析和多位点序列分型(whole-genome multilocus sequence typing, wgMLST)分析技术凭借其全面的遗传信息和较高的分辨率成为菌株鉴定的可靠方法[14-17],在市场中的应用和需求日渐增加。但目前,国内外关于WGS技术用于益生菌菌株鉴定的评价方法仍无统一标准。
本研究针对动物双歧杆菌乳亚种B.animalissubsp.lactisBL-99,通过形态学、生理生化等表型鉴定技术,结合WGS、wgMLST、SNP分析等分子生物学技术,开展动物双歧杆菌菌株鉴定研究,为建立适用于动物双歧杆菌乳亚种B.animalissubsp.lactisBL-99的菌株鉴定流程奠定技术基础。通过菌株鉴定实现益生菌的精准溯源,为产品质量控制提供可靠的技术标准,同时为政府监管、行业标准法规制定提供技术参考,对促进益生菌在食品行业更加安全和广泛的应用具有重要意义。
1 材料和方法
1.1 实验材料
1.1.1 实验菌株
菌株BL-99,内蒙古伊利实业集团股份有限公司;模式菌株动物双歧杆菌动物亚种B.animalissubsp.animalisCICC 6250T、动物双歧杆菌乳亚种B.animalissubsp.lactisCICC 24210T,中国工业微生物菌种保藏管理中心。其他7株商业化参考菌株分离自有明确菌株声称的乳饮料、滴剂及菌剂等产品。菌株具体信息见表1。

表1 菌株信息Table 1 Information of selected strains
1.1.2 实验仪器
ECLIPSE 80i光学显微镜,尼康仪器(上海)有限公司;隔水式培养箱,上海一恒科学仪器有限公司;Hitachi SU8010扫描电镜,日立高新技术(上海)国际贸易有限公司;BAL-TEC SCD005喷金-离子溅射仪;基质辅助激光解吸电离飞行时间质谱仪,德国布鲁克公司;BGISEQ-500高通量基因测序仪、BGIDL-50全自动样本加载系统,深圳华大智造科技有限公司;微量可调移液器、小型台式冷冻离心机,德国Eppendorf公司;高压灭菌锅,日本HIRAYAMA公司;Q800R2超声打断仪,美国Sonicator公司;Qubit 3.0核酸荧光定量仪,赛默飞世尔科技(中国)有限公司。
1.1.3 实验试剂
MRS琼脂、强化梭菌培养基,美国BD公司;API 20 A培养基、API 20 A试验条,法国生物梅里埃公司;革兰氏染色液、0.85%生理盐水,北京陆桥技术股份有限公司;厌氧产气袋,日本三菱化学公司;溶菌酶、RNase A溶液、GoldView、琼脂糖,北京全式金生物技术有限公司;通用DNA文库制备试剂套装(MGIEasy)、BGISEQ-500RS(PE100)高通量测序试剂套装,深圳华大智造科技有限公司;Qubit®dsDNA HS Assay Kit、Qubit®ssDNA Assay Kit,赛默飞世尔科技(中国)有限公司;细菌基因组DNA提取试剂盒,天根生化科技(北京)有限公司。
1.2 实验方法
1.2.1 形态学观察
采用四区划线法将菌株BL-99接种于强化梭菌培养基平板,于36 ℃厌氧条件下培养48 h后,观察菌落形态,并进行革兰氏染色观察菌体形态。菌株BL-99经无菌生理盐水漂洗后用戊二醛固定过夜,将漂洗后的菌体加入到滤纸包中,乙醇梯度脱水,CO2临界点干燥3次后,将样品放置到喷金-离子溅射仪中喷金3次,使用扫描电镜进行菌体形态观察。
1.2.2 API鉴定
菌株BL-99于强化梭菌培养基上36 ℃厌氧培养24 h,用无菌棉签挑取足量菌落加入API 20 A培养基中制得混浊度相当于3 McFarland的菌悬液,接种于API 20 A实验条,36 ℃厌氧培养24~48 h后,加入附加试剂判读结果。试验条判读结果使用数据库API 20 A V3.0进行鉴定。
1.2.3 MALDI-TOF MS鉴定
采用甲酸萃取法制备检测样本,分别挑取培养皿中各实验菌株菌体,混匀于300 μL超纯水中,添加900 μL无水乙醇漩涡振荡1 min,离心菌体并去除上清液,完全去除乙醇后,用50 μL 体积分数70%的甲醇重悬菌体细胞,再加入50 μL乙腈,通过移液枪反复吹打混合悬液;将制备的悬液按照MALDI-TOF MS检测规程进行鉴定分析,确定菌种分类学地位。
1.2.4 WGS及分析
1.2.4.1 菌株DNA提取及测序
采用商业化细菌基因组DNA提取试剂盒提取菌株的基因组DNA,使用MGIEasy通用DNA文库制备试剂套装依照其说明书进行建库,文库经质控合格后按照BGISEQ-500RS高通量测序试剂套装(PE100)的操作说明依次完成上机测序。
1.2.4.2 菌株ANI分析
以模式菌株动物双歧杆菌乳亚种B.animalissubsp.lactisDSM 10140T(GCF_000022965.1)、动物双歧杆菌动物亚种B.animalissubsp.animalisATCC 25527T(GCA_000260715.1)为参考菌株,利用fastaANI(v 1.3)软件对测序菌株进行ANI分析。
1.2.4.3 菌株引物比对(Primer BLAST)分析
依托各菌株全基因组信息,以groEL基因特异性引物开展Primer BLAST分析,将得到的groEL序列通过NCBI BLAST比对分析,确定亚种的分类学地位。
1.2.4.4 wgMLST分析
针对所有待分析菌株的蛋白基因集进行CD-HIT(v 4.6.6)聚类分析,提取样品中共有基因和特有基因集,基于目标菌株和参考菌株的共有基因矩阵构建系统进化树。用TreeBeST(v 1.9.2)的PHYML(最大似然法)算法构建系统进化树,Bootstraps参数设置为1 000。
1.2.4.5 SNP分析
利用MUMmer 比对软件,将每个样品与参考序列进行全局比对,检出潜在SNP位点;提取参考序列SNP位点两边各100 bp序列,然后用BLAT将提取的序列和组装结果进行比对,验证SNP 位点。采用BLAST、TRF、Repeatmask 软件预测重复序列位点,过滤去除重复区SNP,最后得到可靠的SNP。
2 结果与分析
2.1 形态学观察
菌株BL-99在强化梭菌培养基上36 ℃厌氧培养48 h,菌落白色、圆形、表面湿润、不透明、边缘整齐(图1-a);光学显微镜下观察,菌体呈端部膨大的杆状,(0.5~0.7) μm×(0.8~2.3) μm,单个或成对排列,革兰氏阳性(图1-b)。扫描电镜观察,菌株BL-99菌体呈端部膨大的杆状,(0.5~0.6) μm×(1.3~2.5) μm,单个或成对排列(图1-c),其菌落和菌体形态符合动物双歧杆菌典型特征。
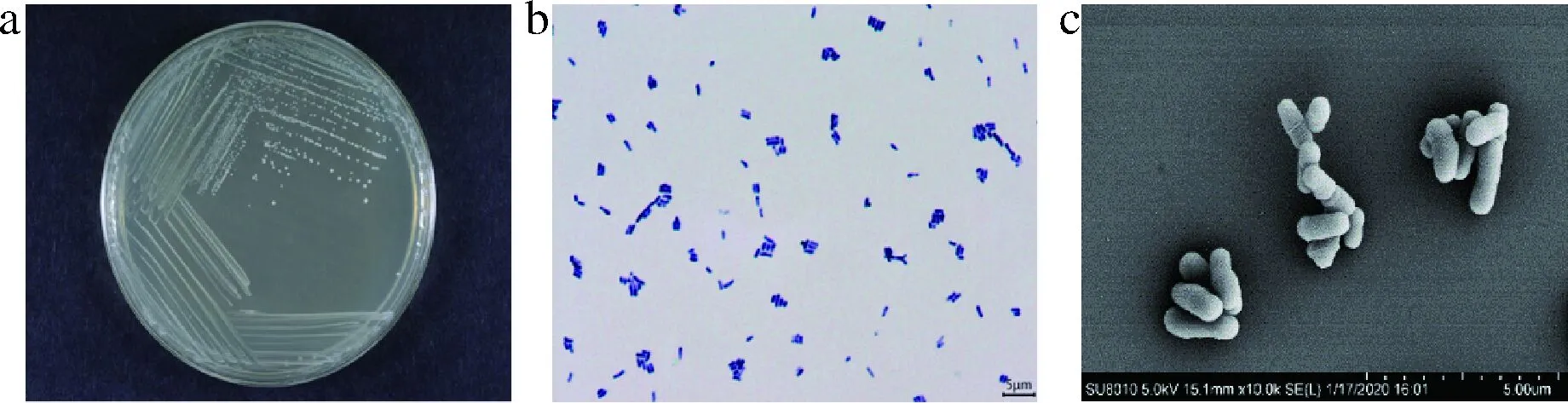
a-菌落形态;b-菌体显微形态;c-菌体扫描电镜形态图1 菌株BL-99菌落和菌体形态Fig.1 Colony and morphology of strain BL-99
2.2 API鉴定结果
菌株BL-99的API生理生化结果如表2所示。菌株BL-99经API 20 A系统鉴定为双歧杆菌属(Bifidobacteriumsp.),鉴定百分率为99.7%,T值为1.0。本研究中目标菌株BL-99鉴定至属水平,与鉴定系统中生理生化反应及数据库中菌株收集的数量有关,其提供的代谢特征可为后续菌株功能开发提供基础数据。

表2 菌株BL-99 的API分析结果Table 2 API analysis results of strain BL-99
2.3 菌株BL-99及参考菌株MALDI-TOF MS鉴定
本研究通过MALDI-TOF MS鉴定,确定菌株BL-99和参考菌株的菌种分类学地位。MALDI-TOF MS数据库中目前包含25种双歧杆菌图谱,其中动物双歧杆菌数据有3株,各试验菌株与数据库中标准菌株核糖体蛋白图谱的鉴定比对值达到2以上,专属菌株及参考菌株均鉴定为动物双歧杆菌B.animalis(表3),鉴定结果具有较高的可信度。MALDI-TOF MS是近年来新兴的微生物快速鉴定系统,通过检测微生物核糖体等高丰度稳定表达的特征蛋白指纹图谱,与已知微生物菌种蛋白指纹图谱数据库比对分析后,进行快速菌种鉴定,该方法已进入国家标准GB/T 33682—2017[10],在工业微生物(含乳杆菌属和双歧杆菌属)菌种鉴定方面有较好的应用效果[18]。

表3 不同动物双歧杆菌B.animalis参考菌株的MALDI-TOF MS检测结果Table 3 MALDI TOF MS results of different B.animalis strains
2.4 ANI分析
对菌株BL-99和参考菌株进行全基因组测序,测序结果显示试验菌株全基因组测序数据Q30均在90%以上,满足后续组装及分析要求,数据经基因组组装,动物双歧杆菌B.animalis菌株基因组大小和GC含量符合该菌种的正常水平,本研究中的所有菌株测序深度达300X以上,满足后续分析的数据需求。
选取模式菌株B.animalissubsp.lactisDSM 10140T(ref1)和B.animalissubsp.animalisATCC 25527T(ref2)的全基因组序列作为参考序列进行ANI分析,结果表明不同动物双歧杆菌B.animalis与参考模式菌株全基因组序列的ANI值均达到95%以上(表4),其中菌株BL-99-1为目标菌株的原始菌株,菌株BL-99-2为同一菌株传代培养5代的菌株。ANI于2007年由GORIS等[12]提出,指2个基因组序列之间的整体相似性,作者通过比较大量模式菌株的两两基因组指出,ANI值95%~96%可作为细菌菌种鉴定的有效判定指标。本研究选取不同培养代数菌株BL-99(BL-99-1/2)及相关参考菌株均鉴定为B.animalis。
通过对各菌株的Primer BLAST分析,得到了目标菌株及参考菌株的groEL基因序列,经过NCBI比对分析及系统发育分析表明,菌株BL-99及7株参考菌株均为动物双歧杆菌乳亚种(B.animalissubsp.lactis)。

表4 不同动物双歧杆菌B.animalis的ANI分析结果Table 4 ANI analysis results of different B.animalis strains
2.5 wgMLST分析
经过序列比对分析得到各菌株的核心基因共有1 562个(图2),以共有基因为基础,开展wgMLST分析(图3)。系统发育分析结果表明,菌株BL-99的两个序列处于同一分支,系统发育中Bootstrap值达99%以上,具备更近的亲缘关系,该方法可有效区分菌株BL-99与本研究中的其他参考菌株。多位点序列分析的分型(multilocus sequence typing, MLST)方法,通过串联多个基因内部片段序列,对菌株的等位基因进行多样性的比较,通过不同的序列型分析菌株间的关系,在流行病学监测和进化研究方面有较广泛的应用[19]。传统的MLST方法依托PCR扩增少数持家基因进行序列分析,由于选择的基因数量较少,可能不能得到较好的菌株区分效果[20]。基于WGS的wgMLST方法主要通过对菌株间的所有共有基因进行差异分析和系统发育分析来实现菌株分型。DURANTI等[16]对18株青春双歧杆菌(Bifidobacteriumadolescentis)进行全基因测序和wgMLST分析,结果表明通过对872个共有基因的进行差异分析和系统发育分析,不同株青春双歧杆菌(B.adolescentis)可得到良好区分。
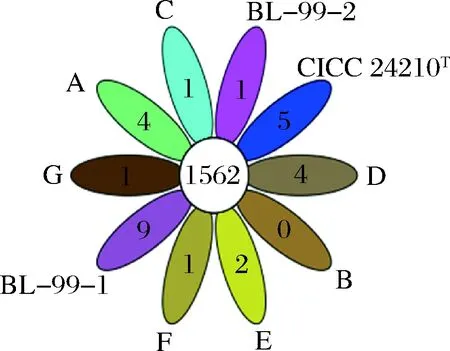
图2 实验菌株序列的共有基因分布Fig.2 Distribution of common genes in experimental strains

图3 基于wgMLST的动物双歧杆菌B.animalis系统发育分析Fig.3 Phylogenetic analysis of B.animalis strains based on wgMLST
本研究中通过全基因组序列数据分析,选取目标菌株和参考菌株的所有1 562个共有基因进行系统发育分析,可将目标菌株BL-99与参考菌株进行有效区分;通过对B.animalisBL-99基因组的系统分析,深入挖掘该菌株与参考菌株共有及特有基因差异,优选适合的基因组合,可为建立更快捷的基于PCR MLST的B.animalisBL-99菌株鉴定技术提供技术支撑。
2.6 SNP分析
以B.animalissubsp.lactisBL-99的基因组序列为参考,SNP分析结果如表5所示。经过5代传代培养的B.animalissubsp.lactisBL-99基因序列与参考序列相比,其SNP差异分别为0,其余菌株与参考基因组的SNP差异均大于32,结果表明B.animalissubsp.lactisBL-99可与9株其他菌株良好区分。基于SNP差异的系统发育分析也显示2株B.animalissubsp.lactisBL-99的基因序列聚集在同一分支,可与其他菌株进行明显区分(图4,单核苷酸位点变化由不同颜色表示)。通过对大肠埃希氏菌(Escherichiacoli)、单增李斯特氏菌(Listeriamonocytogenes)等致病菌的SNP分析研究表明,21个SNP差异是判断同一菌株的标准之一[21],SNP分析在益生菌领域的研究主要包括乳杆菌、双歧杆菌等不同菌株的分型分析,但目前缺少益生菌菌株鉴定的评判标准,该判定标准与目标菌株及参考菌株的种类与数量密切相关,同时需要菌株来源信息等溯源数据,基于本研究的菌株数量及数据结果分析,SNP分析可实现B.animalissubsp.lactisBL-99的菌株鉴定。

表5 动物双歧杆菌B.animalis 的SNP分析结果Table 5 SNP analysis results of different B.animalis strains

图4 菌株BL-99与参考菌株全基因组测序-单核苷酸多态性分析及系统发育树Fig.4 Phylogenetic analysis of B.animalis strains based on wgSNP
3 结论
本研究建立了一套适用于动物双歧杆菌乳亚种B.animalissubsp.lactisBL-99的菌株鉴定流程。通过形态学、生理生化(API)、MALDI-TOF MS鉴定、WGS、ANI及groEL基因分析等方法可实现动物双歧杆菌乳亚种B.animalissubsp.lactisBL-99的亚种鉴定;进一步通过wgSNP和wgMLST可有效区分动物双歧杆菌BL-99与本研究中的其他9株参考菌株。本研究构建的动物双歧杆菌乳亚种B.animalissubsp.lactisBL-99菌株鉴定技术流程,为益生菌菌株精确鉴定技术体系的构建提供了有效数据支撑和实践参考。wgSNP和wgMLST作为分辨率较高的益生菌菌株鉴定技术,其适用范围、判定标准与研究涵盖的目标菌株、参考菌株数量密切相关。随着试验菌株样本量的不断扩充,建立的益生菌菌株鉴定流程和评价标准将更具代表性、覆盖度和统计学意义。
——中国益生菌信息与技术交流平台

