胎儿宫内生长受限与氧化应激关系的Meta分析
李渊龙,逯军,王丹虹
中南大学湘雅医学院附属海口医院儿科,海口570208
宫内生长受限(IUGR)是指由于各种因素导致胎儿在宫内未能达到其遗传的生长潜能,胎儿预估体质量低于其同胎龄平均体质量的第10 百分位数或2 个标准差。若不及时干预,导致胎儿病理性小于胎龄儿(SGA),新生儿近远期并发症的发生率也随之增加[1]。IUGR 是围产期儿童患病和死亡的重要原因之一。IUGR发生的影响因素主要包括胎儿、母体及胎盘等,但具体机制尚未明确[2]。目前国内外已有多项关于氧化应激与IUGR 关系的报道,证实氧化应激参与了IUGR 的发生发展。本研究系统分析了IUGR与氧化应激的关系。现报告如下。
1 资料与方法
1.1 文献资料 数据库:包括中文数据库(中国知网、万方数据库、中国维普数据库、中国生物医学文献数据库)、英文数据库(Pubmed、Embase)。中文检索词:“宫内生长受限”或“胎儿生长受限”或“小于胎龄儿”且“氧化应激”或“晚期氧化蛋白产物”或“异前列腺素”或“丙二醛”或“非结合蛋白铁”等;英文检索词 :“IUGR”or“FGR”or“SGA”or“intrauterine growth restriction”or“fetal growth restriction”or“small for gestational age”AND“Oxidative stress”or“AOPP”or“8-iso-PGF2α”or“MDA”or“NPBI”。检索时间:2000年1月—2020年1月。
1.2 纳入与排除标准 纳入标准:①关于IUGR 与氧化应激相关性分析,且研究类型为病例对照研究或前瞻性队列研究;②病例组为诊断明确的IUGR患儿,对照组为具有可比性的同孕周或同胎龄的健康新生儿;③有明确的氧化应激检测指标(如丙二醛、异前列腺素、晚期氧化蛋白产物、非结合蛋白铁等),并有明确的实验检测方法;④全文发表的中英文文献,且可以获得全文。排除标准:①缺乏对照组;②动物实验;③个案报道、会议论文、综述等。
1.3 文献筛选、资料提取及质量评价 由2 名研究者按照文献纳入与排除标准独立筛选并提取信息,包括:①一般信息:文题、第一作者、论文发表时间、研究类型等;②研究对象疾病信息:病例组和对照组样本量、氧化应激指标[丙二醛(MDA)、4-羟基-2-壬烯醛加合物(HNE)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-PX)、热休克蛋白70(HSP70)、人 8-异构前列腺素 F2α(8-epi-PGF2α)、总抗氧化能力(TAC)、血清缺血修饰白蛋白(IMA)、血清氧化型低密度脂蛋白(OxLDL)、硫代巴比妥酸反应物(TBARS)、晚期血清氧化蛋白产物(AOPP)]。用纽卡斯尔—渥太华量表(NOS)[3]对纳入的观察性文献进行质量评价并计分,总分9分。2名研究者交叉核对所提取结果,遇到分歧时,请第3位研究者讨论后确定。
1.4 数据分析 采用Stata14.0 软件。若纳入文献结局效应量可合并,则用Q检验对纳入研究结果间的异质性进行检验,若I2<50 表示研究间无异质性,采用固定效应模型;若I2≥50,表示存在异质性,则采用随机效应模型。连续性变量采用标准化均数差(SMD)表示。P<0.05 为差异有统计学意义。用敏感性分析法检测结果的稳定性。若纳入文献结局效应量无法合并则仅对文献进行描述性分析。
2 结果
2.1 文献筛选结果 共检索出1 143 篇文献,最终纳入16篇符合标准的文献。其中英文文献14篇,中文文献2 篇;前瞻性队列研究3 篇,病例对照研究13篇,研究对象共1 234 例。16 篇文献的基本特征见表 1。纳入文献 NOS 评分为 6~8 分,中位数为 7 分,文献质量较高。
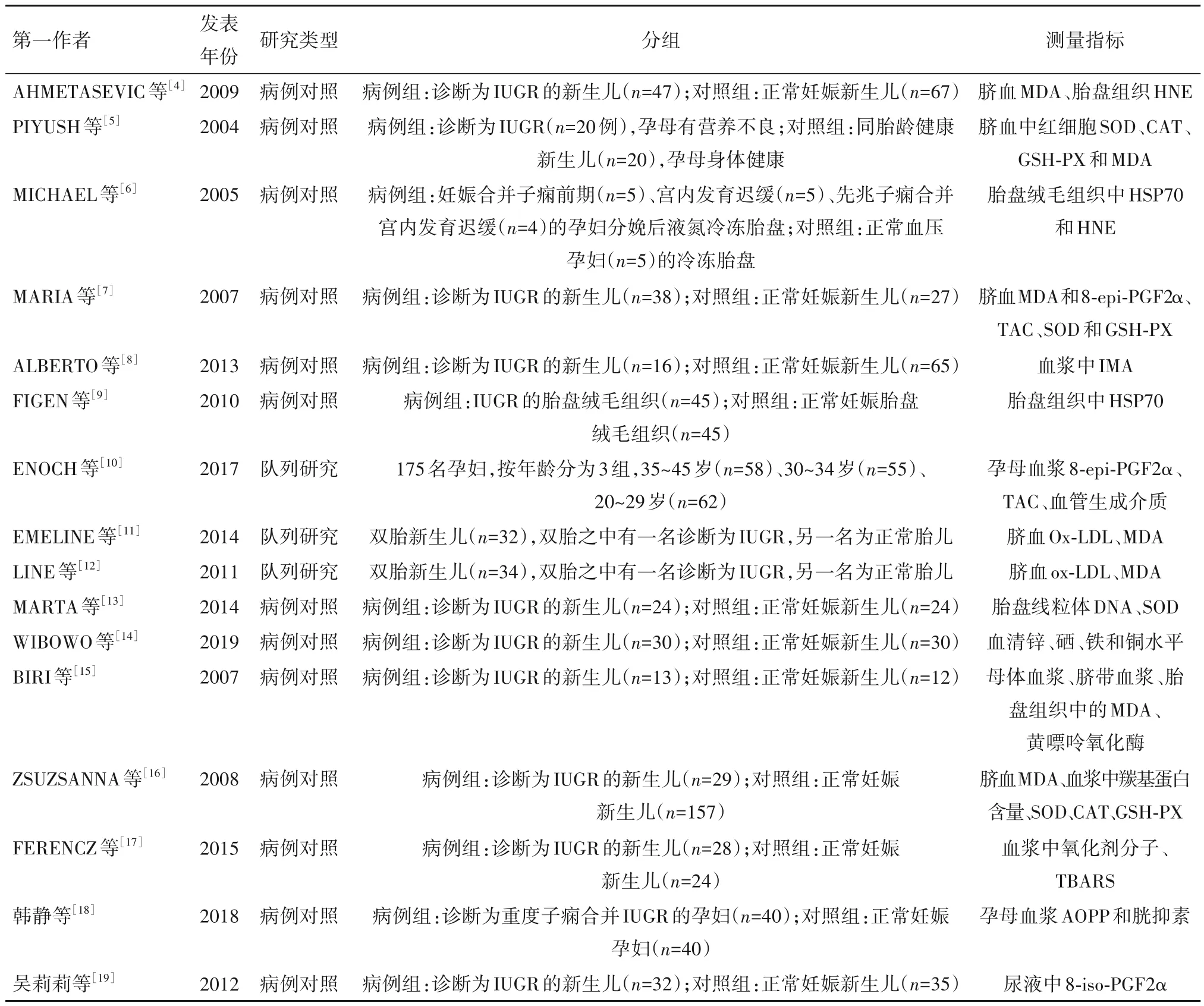
表1 16篇文献的基本特征
2.2 Meta分析结果
2.2.1 脂质过氧化物 共 7 篇文献[4-5,7,11-12,15-16]检测MDA,I2≥50,存在异质性,结果显示病例组MDA水平高于对照组(SMD=3.31,95%CI:2.183~4.434,P=0.001)。每次剔除1 篇文献对剩余6 篇进行敏感性分析 ,共计算 7 次 ,SMD最小为 3.053(95%CI:1.892~4.215,P=0.004),最大 为 3.675(95%CI:2.569~4.781,P=0.001),提示该结果稳定可靠。3篇文献[7,10,19]发现,病例组 8-iso-PGF2α 水平高于对照组(P<0.01);1 篇文献[4]发现,病例组胎盘组织基质细胞HNE表达阳性率高于对照组(P<0.01);以双胎妊娠为研究对象的研究中发现,在同一宫内生长环境,病例组脐血中的OxLDL水平高于对照组[11-12]。
2.2.2 抗氧化系统 3 篇文献[7,13,16]发现,病例组GSH-Px、SOD 水平升高(P均<0.05);1 篇文献[5]发现,病例组营养不良的孕妇体内GSH-Px 和SOD 水平比对照组正常孕妇低(P<0.05);1 篇文献[13]发现,病例组胎盘组织中SOD 水平高于对照组,而病例组胎盘组织线粒体DNA 水平低于对照组(P均<0.05)。
2.2.3 微量元素 1 篇文献[14]发现,病例组孕妇体内血清硒、铁水平高于对照组(P均<0.05)。
2.2.4 其他 2篇文献[6,9]发现,病例组胎盘合体滋养层细胞、细胞滋养层细胞和绒毛外滋养层细胞中HSP70 表达均高于对照组(P均<0.05)。1 篇文献[8]发现,病例组孕母孕早期体内的IMA 水平高于对照组(P<0.05)。1 篇文献[18]发现,病例组孕妇体内AOPP高于对照组(P<0.05)。
3 讨论
导致IUGR 的因素有很多,近年研究表明,母体内的氧化应激与胎儿的宫内生长发育有密切联系。本研究共纳入16篇文献,标本涵盖了血浆、红细胞、尿液以及胎盘组织等,还涉及了多种氧化与抗氧化的指标;同时,纳入的文献中还包括了多种导致IUGR 的高危因素,从不同角度阐述氧化应激在IUGR发病中的影响。从目前研究结果看,大部分纳入的文献质量较高,且其结果支持氧化应激参与IUGR的发生发展。
本研究结果显示,IUGR 患儿的MDA 明显高于对照组,其次母体或胎盘内8-iso-PGF3α、HNE 等脂质过氧化物的水平也高于其对照组,提示宫内发育迟缓可能与脂质过氧化物的增多有关。氧化应激产生的氧自由基能与细胞的脂质成分发生过氧化,生成大量脂质过氧化物,这些脂质过氧化物可继续与细胞膜、质膜上的不饱和脂肪酸发生同级联反应,加剧破坏胞膜、质膜,并在细胞膜上形成蛋白质孔,进一步导致细胞膜、质膜变薄失去其屏障作用,引起细胞内稳态紊乱[20],导致更严重的组织细胞损伤。另一方面,自由基损伤细胞的脂质结构,产生的脂质过氧化产物HNE 可作为细胞内信号转导中的第二信使,参与细胞的调控;同时HNE 也能干预血清中的生长因子,影响机体正常的生长发育[4]。
氧化应激还能通过影响脐带血流与胎盘功能从而影响胎儿的宫内生长发育。已有研究发现,胎盘氧化应激反应与胎儿生长受限呈现正向关联[21]。一项前瞻性研究发现,高龄产妇血浆中的氧化应激标志物水平显著高于最佳生育年龄的孕妇,而胎盘生长因子(PIGF)较对照组下降,他们认为氧化应激可能损害了PIGF 的功能,导致胎盘血管的生成不全,影响胎盘的形成与功能[10]。LIMOLI等[22]研究表明,脂质过氧化物还能抑制前列环素的合成,导致胎盘血管的痉挛收缩和增加血小板的聚集,引起胎盘的灌注不足,最终导致胎儿的缺血缺氧,生长迟缓;胎盘中的脂质过氧化会损害中性氨基酸和葡萄糖的运输,使胎儿生长所需的营养物质减少,限制了胎儿的宫内生长[23]。
微量元素(如锌、硒、铁和铜等)在备孕期到胎儿生长发育整个过程都发挥着重要作用,微量元素的失衡将会影响胎儿的生长。胎儿生长受限孕妇的血清铁水平较高,提示微量元素和氧化应激在胎儿生长受限的病理生理过程中具有重要作用[14]。铁是机体内最丰富的微量元素,主要参于氧的运输,线粒体呼吸及维持各种酶的生物活性,有研究表明过量的铁储存可能会导致氧化应激加剧[24]。在缺血、缺氧、低pH、炎症刺激的作用下,铁蛋白中的结合铁可游离出蛋白,游离铁可作为氧化应激反应的催化剂催化fenton 反应及参与Haber-weiss 循环,从而加速羟自由基的生成。羟自由基极强的氧化性可损害蛋白质、核酸、脂质等,阻碍细胞的生长发育或诱发细胞死亡[25]。这种铁依赖性的,导致细胞区别于细胞凋亡、细胞坏死、细胞自噬的新型的细胞程序性死亡方式称为“铁死亡”[26]。“铁死亡”在生化方面表现为机体内铁离子升高,大量活性氧类生成,谷胱甘肽过氧化物酶活性下降以及脂质代谢产物堆积;在形态学上,“铁死亡”细胞中可观察到线粒体膜固缩,膜密度增加,线粒体嵴模糊不清、减少或消失,表现为线粒体功能的不全。关于氧化应激与铁死亡的关系一直是近几年研究热点,国内外已有学者将“铁死亡”机制用于研发抗肿瘤药物的新靶点、探讨神经退行性病变机制等研究中[27],但是关于“铁死亡”与IUGR的相关性尚无文献报道。我们推测母亲或胎儿体内游离铁的过载可能通过“铁死亡”影响胎儿的生长潜能,从而导致IUGR 的发生,其具体机制仍需进一步探讨。
综上所述,IUGR 患儿体内的氧化应激增强,且不同标本来源的氧化应激指标的升高反映了氧化应激从多方面参与疾病的发生发展,对IUGR 的发病机制和防治策略具有一定的参考价值。本研究尚存在一定的局限性,本研究虽纳入16篇符合条件的文献,但仅7篇可通过Meta分析合并结局量,其余各研究同质性较差,可合并结局量的氧化应激指标较少,无法进行定量Meta 分析。故尚需更多高质量、同质性较好的研究进行分析,获得更严谨、更客观的循证医学证据,以便进一步定量揭示氧化应激与IUGR发病的关系。

