Thermoplasma volcanium来源β-葡萄糖苷酶的酶学性质分析
刘 阳,王 丹,纪 锐,顾少华,李继喜,季朝能
(1. 复旦大学 生命科学学院,上海 200438; 2. 复旦大学 遗传工程国家重点实验室,上海 200438)
当前全球能源负担和化石燃料的需求正在增加,化石燃料的使用还以污染物的形式带来了各种环境危害.国际能源署(IEA)发布报告称生物能源是增长最快的能源,从2018年到2023年,可再生能源消费领域中生物能源的增长率约为30%[1].尽管人类已积极开发利用太阳能、水力能、风能等能源形式,但由于对气候环境的依赖性,仍不能确保稳定的能源生产和供应[2].在这种情况下,生物质降解和转化为生物能源似乎是有益而有前途的选择.纤维素是生物质最为主要的成分之一,高效环保地分解纤维素获得葡萄糖的过程是有效利用生物质的关键[3].
纤维素酶是由3种不同的酶组成的系统,包含外切葡聚糖酶、内切葡聚糖酶和β-葡萄糖苷酶(BGL),它们在水解纤维素的过程中具有不同的功能,起着协同作用.内切葡聚糖酶随机作用于纤维素的内部并切割葡萄糖的线性链,产生两个新的短糖链[4];然后,外切葡聚糖酶作用于这两个短糖链暴露的末端,使纤维二糖和一些葡萄糖脱离;最后,β-葡萄糖苷酶将纤维二糖和纤维寡糖分解为葡萄糖分子.
β-葡萄糖苷酶(E.C.3.2.1.21)是一种水解糖苷键以从糖苷和寡糖中释放非还原性末端糖苷残基的酶.这些酶在古细菌、真细菌和真核生物中普遍存在并发挥多种功能.包括微生物的生物能转化、动物体内糖脂和外源糖苷的分解、纤维素低聚糖的木质化、分解代谢、防御、植物激素偶联活化和植物气味释放等[5].由于β-葡萄糖苷酶在自然界中具有多样化的功能,因此衍生出多种分类方式.常见的分类方法如下[6-9]: 1) 基于底物特异性;2) 基于蛋白质序列相似性和酶的空间结构;3) 基于催化机理;4) 基于产物耐受性.1999年建立的碳水化合物活性酶数据库(CAZy),主要基于蛋白质序列相似性和酶空间结构进行分类,至今仍被广泛使用.根据CAZy的统计,目前β-葡萄糖苷酶主要分布在糖苷水解酶家族1、2、3、5、9、16、30、39和116中.
由于β-葡萄糖苷酶的低效率和潜在的BGL生产者微生物的缺乏,纤维素向糖的总转化率通常较低,这就使得转化成本较高.因此,研究人员一方面一直在研究不同的真菌和细菌菌株,以获得有效的分解纤维素的β-葡萄糖苷酶[10];另一方面则重点关注该酶的水解速率、抑制剂、稳定性、产物抑制和热不稳定性等关键因素.其中水解和产物抑制作为限速步骤被广泛研究.据报道,已经存在描述嗜热和热稳定的β-葡萄糖苷酶的研究,如Fusco等[1]通过编码基因Dtur_0462合成来源于Dictyoglomusturgidum的β-葡萄糖苷酶,在大肠杆菌中表达了热稳定的β-葡萄糖苷酶DturβGlu,在80 ℃时该酶有最大活性,70 ℃下孵育2 h后有70%的活性.Sun等[12]在大肠杆菌中表达了来自于marinebacterium的GH1 β-葡萄糖苷酶,该酶对葡萄糖有高度耐受性,并在葡萄糖浓度为100 mmol/L时显示最大的刺激活性;在40 ℃,pH7.5时表现最佳活性.但同时具备良好的耐糖和耐热特性的β-葡萄糖苷酶种类却不多.另外,由于β-葡萄糖苷酶的底物纤维二糖是内切葡聚糖酶和外切葡聚糖酶的強抑制剂,而β-葡萄糖苷酶本身被高浓度的产物葡萄糖抑制,使得它成为整个水解过程中的限速酶.因此,寻找耐受葡萄糖的高反应活性β-葡萄糖苷酶,同时提高该酶的生产率,变得至关重要.
火山嗜热菌Thermoplasmavolcanium是从酸性热液喷口和硫质气孔(solfatara)中分离出来的嗜热古菌,它是兼性厌氧的化能异养菌[13],该古菌中的大多数酶具有嗜热特性.在本文中,研究报道了一种来源于Thermoplasmavolcanium的BGL,并详细描述了其酶学特性,为进一步的工业应用和改造提供了方向.
1 材料和方法
1.1 材料和主要试剂
菌株E.coliDH5α和E.coliBL21(DE3)PlysS均由本实验室保存.重组原核表达载体pET22-TvBGL由本实验室合成并保存.Ulp1酶由本实验室纯化并保存.蛋白超滤管Amicon-Ultra 30 kDa购自Millipore公司.镍亲和层析柱HisTrapTMHP和DEAE阴离子交换柱HiTrapTMDEAE FF购自GE Healthcare公司.96孔酶标板购自NEST公司,96孔结晶坐滴板CrystalQuickTMPlus和24孔结晶板VDXmTMPlate购自Hampton Research公司.葡萄糖含量检测试剂盒购自Solarbio公司.有机溶剂、去垢剂、金属离子测定试剂购自Hampton Research公司.柠檬酸、磷酸氢二钠、纤维二糖和对硝基苯基-β-D-吡喃葡萄糖苷均购自Sigma公司.
1.2 方法
1.2.1 Tv-BGL的克隆,蛋白表达和纯化
Tv-BGL氨基酸序列号WP_010916943.1,通过基因合成技术合成靶基因,得到构建的pET22-TvBGL重组表达载体.测序证实插入物正确后,将载体转化到大肠杆菌E.coliBL21(DE3)PlysS中,使细菌在37 ℃条件下,在含有34 μg/mL氯霉素和50 mg/mL氨苄青霉素的LB培养基中生长,直至OD600达到0.8,此时,向培养基中添加终浓度为0.5 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG),以诱导重组BGL的表达.在20 ℃诱导10 h后,4 ℃,5 000×g离心5 min收集细胞.使用裂解缓冲液(50 mmol/L Tris-HCl,200 mmol/L NaCl,10 mmol/L咪唑,pH 8.0)以10 mL/g的比例将收集的细胞重悬.然后,使用聚能高压细胞破碎仪在1 200 bar的压力下将其破碎两次,4 ℃,13 000×g离心40 min除去细胞碎片.将得到的上清液在65 ℃下热处理30 min,13 000×g离心10 min以除去沉淀物.使得到的上清液通过用裂解液平衡的HisTrapTMNi-NTA色谱柱(GE Healthcare)后,利用洗脱缓冲液(50 mmol/L Tris-HCl,200 mmol/L NaCl,500 mmol/L咪唑,pH 8.0)线性洗脱(50~500 mmol/L咪唑,10 mL)带有6×His标签和SUMO标签的Tv-BGL,加入Ulpl酶在4 ℃酶切过夜.第2次通过Ni-NTA柱后,获得脱掉标签的Tv-BGL,将用DEAE结合缓冲液(20 mmol/L Tris-HCl,pH8.0)稀释的目的蛋白溶液通过DEAE柱(GE Healthcare),并使用DEAE洗脱缓冲液(20 mmol/L Tris-HCl 500 mmol/L NaCl,pH 8.0)线性洗脱(0~500 mmol/L NaCl,50 mL).通过使用30 kDa的蛋白超滤管(Millipore)更换并浓缩液体,将浓缩的Tv-BGL储存在由20 mmol/L Tris-HCl(pH8.0)组成的缓冲液中,通过Bradford分析确定Tv-BGL的浓度,并通过12% SDS-PAGE分析蛋白质的纯度.最后将浓缩的Tv-BGL在液氮中冷冻并保存在-80 ℃的冰箱中.
1.2.2 Tv-BGL酶学性质的测定
下述以pNPGlu为底物的酶学测定均采用200 μL的反应体系,在柠檬酸-磷酸氢二钠缓冲液中,底物对硝基苯基-β-D-吡喃葡萄糖苷(pNPGlu)终浓度为1 mmol/L,加入适当浓度的酶,混合均匀后反应10 min,反应终止时用1 mol/L等体积的Na2CO3溶液终止反应.所有实验均进行3组平行实验,并使用多功能酶标仪(Biotek)在410 nm波长处测量吸光度值[14].
1) pH和温度对酶活力的影响: 在不同pH(3.0~8.0)柠檬酸-磷酸氢二钠缓冲溶液中进行酶促反应,以确定酶的最适反应pH;在不同温度(60~100 ℃)下进行水浴,确定最适反应温度.在最适温度下,将酶分别在pH(3.0~8.0)的柠檬酸-磷酸氢二钠缓冲液中孵育1 h,测定pH稳定性;在最适pH下,将酶分别在75 ℃、80 ℃、85 ℃下分别孵育30,60,90 min,测定热稳定性.
2) 酶动力学测定: (1) 以pNPGlu为底物的酶动力学测定,在最适反应pH和温度下,保持加入反应的酶量不变,改变底物pNPGlu浓度,分别在0.0,0.2,0.4,0.5,1.0,1.5,2.0,3.0,4.0,5.0,6.0,7.0 mmol/L的终浓度下反应3 min,在410 nm处测定吸光值,1U定义为在此条件下1 min内从pNPGlu释放1 μmol对硝基苯酚.(2) 以纤维二糖为底物的酶动力学测定,在最适反应pH和温度下,保持加入反应的酶量不变,改变底物纤维二糖的浓度,分别在0.0,1.0,2.0,3.0,4.0,6.0,8.0,10,15,20,25,30,40,60,80,100,150 mmol/L的终浓度下反应10 min,利用GOD-POD法,在505 nm波长处测量吸光度值,1U定义为在此条件下1 min内从纤维二糖释放1 μmol葡萄糖.使用GraphPad Prism软件(GraphPad Software,Inc. CA,USA)通过Michaelis-Menten方程非线性拟合计算出Km,Vmax,和Kcat动力学参数.
3) 金属离子,去垢剂和有机溶剂对酶活力的影响: 在反应体系中分别加入终浓度为1 mmol/L的Ba2+,Cd2+等13种金属离子,n-Dodecyl-β-D-maltoside(DDM)等8种去垢剂,甘油等25种有机溶剂进行金属离子,去垢剂和有机溶剂耐受性测定.
4) 酶的底物特异性: 以纤维二糖,蔗糖,乳糖,麦芽糖,羧甲基纤维素(CMC)为底物,将缓冲液稀释的酶与底物在最适反应pH和温度下,反应10 min,利用GOD-POD法,测505 nm波长处吸光度值,计算产物葡萄糖浓度.
5) 葡萄糖对酶活力的影响: 产物抑制分析测定在最佳pH和最佳温度下使用pNPGlu作为底物,分别向反应系统中添加不同浓度的葡萄糖溶液,从而系统中的最终浓度为0.1,0.25,0.5,1,1.5,2,2.5和2.625 mol/L,反应10 min,在终止反应后测量残留的酶活力,并使用对数法计算半抑制浓度IC50.
2 结果与分析
2.1 Tv-BGL同源家族酶类比对分析
利用氨基酸序列在NCBI数据库的UniProt/Swiss-Prot(Swissprot)数据库中运行BlASTp工具进行蛋白序列相似性检索,与数据库中氨基酸序列同源性比较高的有来源于SaccharolobussolfataricusP2、Saccharolobusshibatae、SulfolobusacidocaldariusDSM639的β-葡萄糖苷酶,同源性分别为58.20%、58.11%、55.42%(图1).为了揭示Tv-BGL潜在的催化活性位点,选取了不同来源的糖苷水解酶家族1(GH1)的β-葡萄糖苷酶进行比对.从PDB数据库中选取古细菌Saccharolobussolfataricus(ATCC 35092/DSM 1617/JCM 11322/P2)的1GOW,细菌Paenibacilluspolymyxa的6QWI,Lactobacillusplantarum(ATCC BAA-793/NCIMB 8826/WCFS1)的5NAQ,真菌Trichodermaharzianum的6EFU和5JBO,小麦Triticumaestivum的2DGA,草地贪夜蛾Spodopterafrugiperda的5CG0,结果如图2所示.比对基于Tv-BGL的晶体结构,利用SnapGene中的Clustal Omega进行对齐,后续使用ESPript 3.0(http:∥espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)网站对序列比对结果进行作图[15],结果显示了几段高度保守的区域,其中氨基酸Glu205,Glu380及前后氨基酸区域(图中☆标示)高度保守,表明Tv-BGL属于糖苷水解酶1家族且遵循保守催化机制,而这些保守的氨基酸残基则可能是参与酶催化的催化位点和辅助位点.
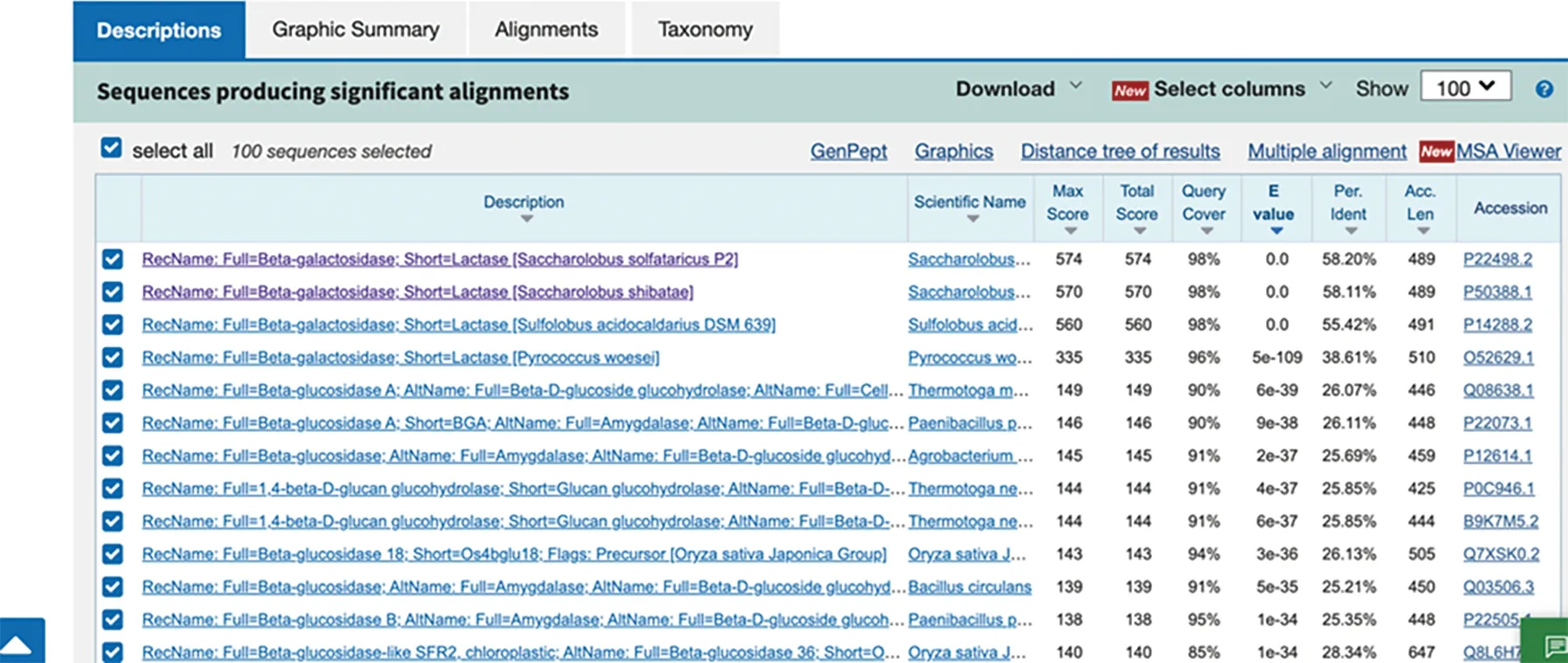
图1 BLASTp蛋白序列相似性检索结果Fig.1 BLASTp protein sequence similarity searching result
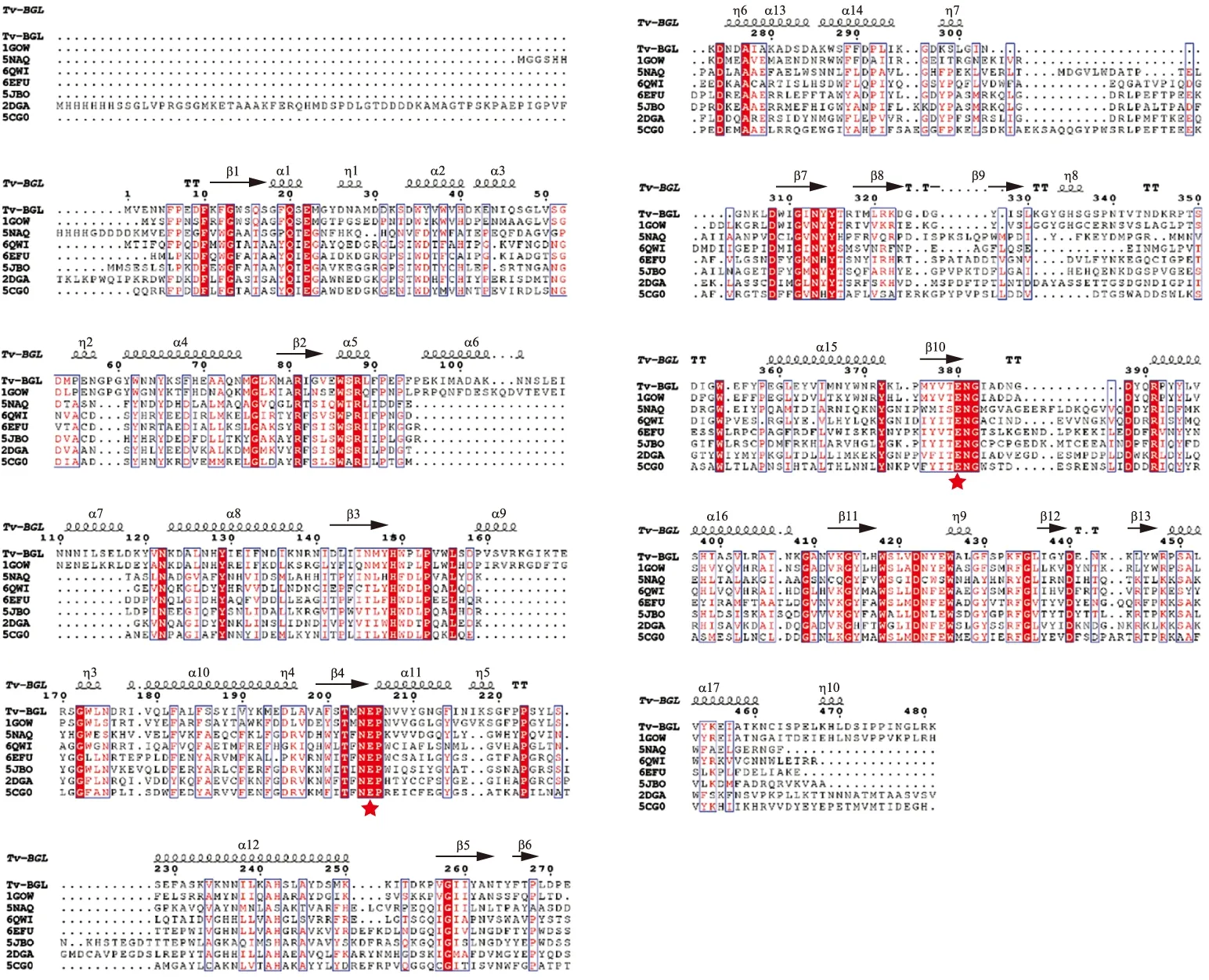
图2 Tv-BGL与多来源GH1家族β-葡萄糖苷酶多重序列比对图Fig.2 Multiple sequence alignment of Tv-BGL with multi-source GH1 family β-glucosidase红色五角星表示高度保守的区域.
2.2 Tv-BGL的表达和纯化
构建了Tv-BGL基因的表达质粒,在大肠杆菌中可溶性表达量大.通过第1步热处理,第2步Ni柱纯化,第3步酶切,第4步DEAE柱纯化,纯化结果如图3(见第640页)所示,与理论分子量55.2 kDa相符合,最后,通过蛋白超滤管(Millipore)将蛋白质浓缩至25 mg/mL.
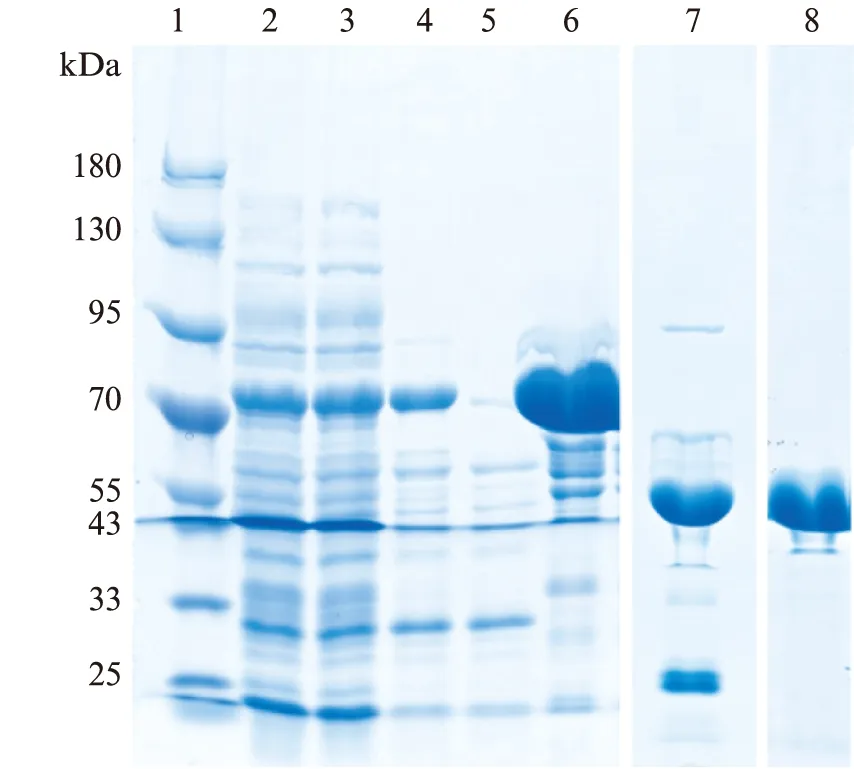
图3 纯化过程的SDS-PAGE结果Fig.3 SDS-PAGE results of purification process1: 蛋白质分子量标记;2: 全菌;3: 上清;4: 热处理后上清; 5: 镍亲和层析流穿;6: 镍亲和层析洗脱;7: 酶切后;8: DEAE离子亲和层析洗脱.
2.3 Tv-BGL的酶学性质
2.3.1 β-葡萄糖苷酶活力的最佳条件
如图4、图5所示,酶活力的最佳条件为pH6.0和80 ℃.pH稳定性测定结果(图6)表明,在80 ℃孵育1 h后,在缓冲液pH6.0的条件下残余活力最高为65%.热稳定性分析在pH6.0条件下,于75 ℃,80 ℃,85 ℃,分别温育30,60,90 min后测定残余酶活力.结果如图7所示,在85 ℃时孵育30 min完全丧失酶活力,在75 ℃孵育30 min残余68%的酶活力,孵育60 min残余85%的酶活力、孵育90 min残余66%的酶活力.在最适温度80 ℃孵育30 min残余54%的酶活力,孵育60 min残余67%的酶活力,孵育90 min残余33%的酶活力.可以看出孵育60 min时酶活力都有明显上升,说明Tv-BGL具有被热激活的特性.
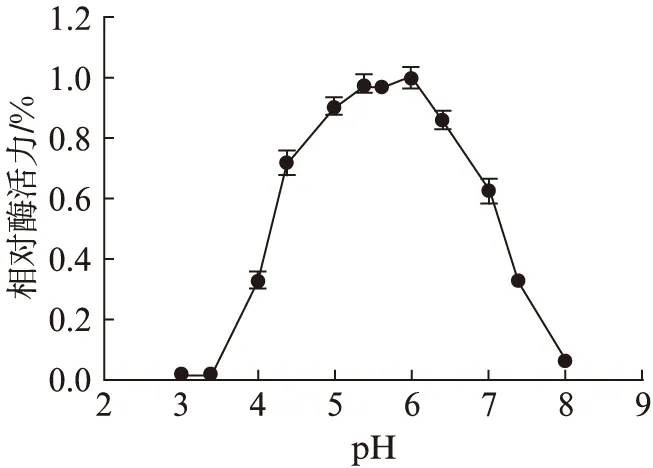
图4 pH对Tv-BGL酶活力的影响Fig.4 The effect of pH on Tv-BGL enzyme activity
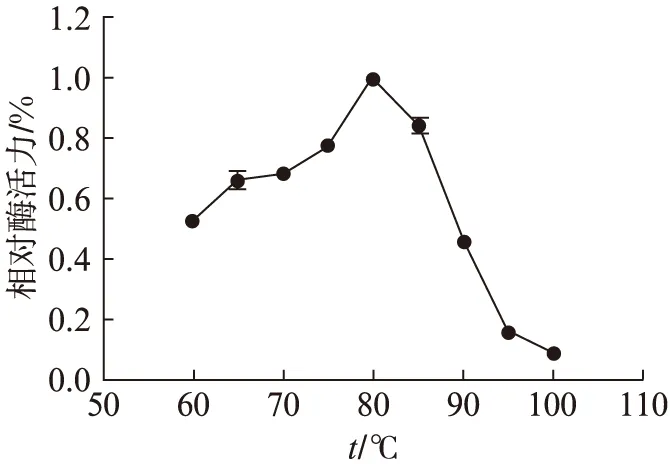
图5 温度对Tv-BGL酶活力的影响Fig.5 The effect of temperature on Tv-BGL enzyme activity
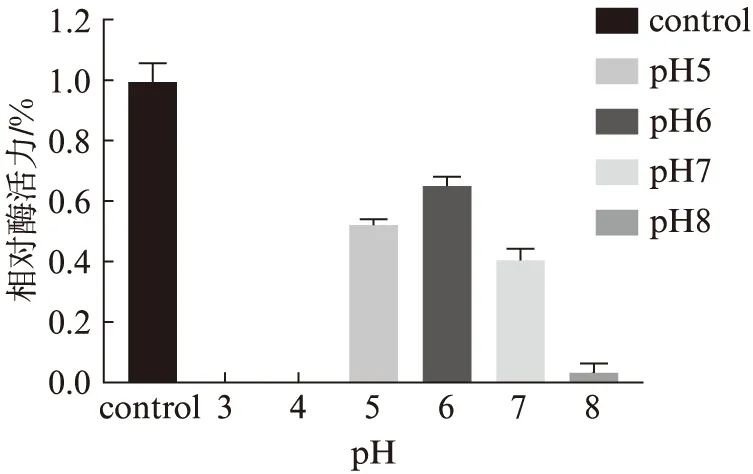
图6 最适温度下pH对酶稳定性的影响Fig.6 The influence of pH on enzyme stability at optimum temperature
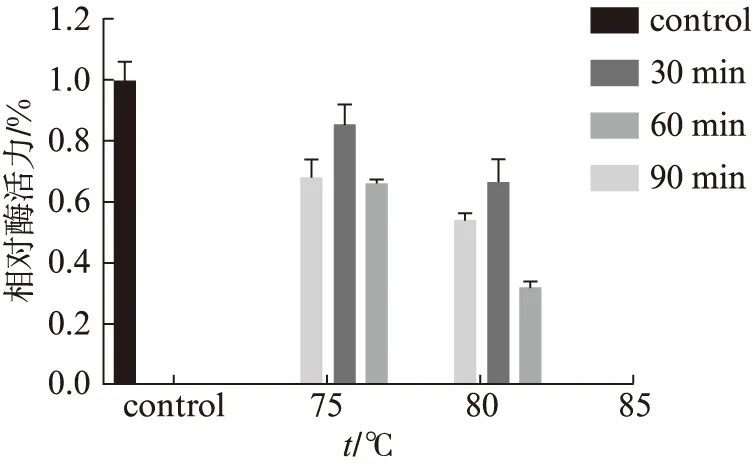
图7 最适pH下酶的热稳定性Fig.7 Thermal stability of enzyme at optimum pH
2.3.2 酶动力学参数
在pH6.0,80 ℃条件下,保持加入反应的酶量不变,改变底物浓度,测定反应速率,通过使用Michaelis-Menten方程非线性拟合,计算得到以对硝基苯基-β-D-吡喃葡萄糖苷(pNPGlu)为底物的Vmax=614.60 U/mg(1U定义为1 μmol/min),Km=0.725 4 mmol/L,Kcat=565.30 s-1(图8(a)).以纤维二糖(Cellobiose)为底物的Vmax=636.06 U/mg(1U定义为1 μmol/min),Km=55.63 mmol/L,Kcat=586.93 s-1(图8(b)),表明Tv-BGL酶的催化速率较高.
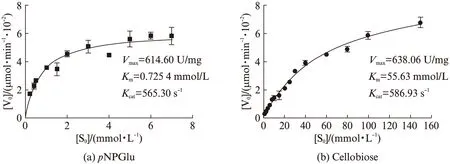
图8 Tv-BGL酶动力学Fig.8 Enzyme kinetics of Tv-BGL
2.3.3 金属离子对Tv-BGL酶活力的影响
据报道某些金属离子和试剂会影响β-葡萄糖苷酶的活力,大部分的β-葡萄糖苷酶被重金属抑制,例如Ag+,Cu2+,Hg2+,Zn2+,Mn2+[16].在反应体系中分别加入终浓度为1 mmol/L的金属离子盐溶液,于最适反应温度80 ℃反应10 min,测定不同金属离子对Tv-BGL酶活力的影响.结果如图9所示,除Na+抑制了12.43%的活力外,其他所有离子对Tv-BGL酶活力的抑制作用皆不超过10%,抑制作用小.此外,如图10所示,在反应缓冲液中添加EDTA对酶活力几乎无影响,推测Tv-BGL不存在这些金属离子的结合位点或者这些金属离子的结合并不明显影响Tv-BGL的三维结构而导致催化能力的剧烈变动.
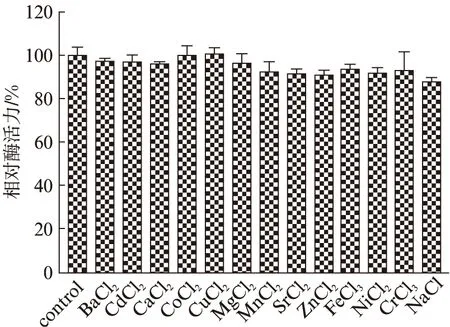
图9 金属离子对Tv-BGL酶活力的影响Fig.9 The effect of metal ions on Tv-BGL enzyme activity

图10 EDTA对Tv-BGL酶活力的影响Fig.10 The effect of EDTA on Tv-BGL enzyme activity
2.3.4 去污剂对Tv-BGL酶活力的影响
在反应体系中分别加入终浓度为1%(质量浓度)的7种去污剂和终浓度为10 mmol/L的Sarosine,测定反应酶活力.结果如图11所示,实验的几种去垢剂对Tv-BGL酶没有明显的激活作用,但抑制作用明显,其中Trimethylamine N-oxide dihydrate(TMANO)对Tv-BGL具有轻微抑制作用,抑制了17.6%的活力,而n-Dodecyl-N,N-dimethylamine-N-oxide(DDAO)抑制了酶54.1%的活力,n-Dodecyl-β-D-maltoside(DDM)抑制了酶72.2%的活力,SDS抑制了酶47%的活力,n-Octyl-β-D-glucoside(OG)抑制了酶97.5%活力.n-Octyl-β-D-glucoside具有很强的抑制能力,同时与底物纤维二糖有一定程度的相似性,可用于后续尝试n-Octyl-β-D-glucoside与Tv-BGL复合物晶体的筛选来探讨Tv-BGL的催化机制.
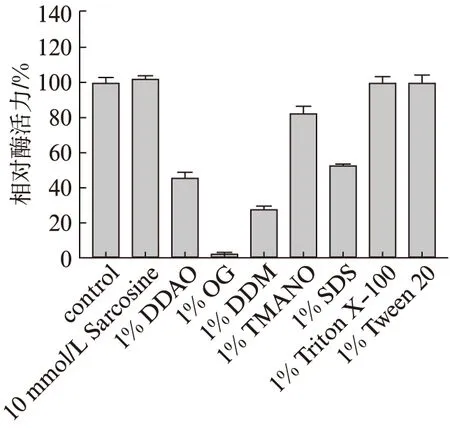
图11 去污剂对Tv-BGL酶活力的影响Fig.11 The effect of detergent on Tv-BGL enzyme activity
2.3.5 有机溶剂对Tv-BGL酶活力的影响
在反应体系中分别加入终浓度为2%(体积分数)或质量浓度为20 mg/mL的24种有机溶剂以及10 mmol/L Phenol共25种有机溶剂,在最适反应条件下同时反应10 min.实验结果如图12所示,不同的有机溶剂对Tv-BGL酶的活力影响较大,其中1,4-Butanediol(1,4-丁二醇)激活最明显,相对酶活力146.90%,1,1,1,3,3,3-Hexafluoro-2-propanol(1,1,1,3,3,3-六氟-2-丙醇)抑制最明显,相对酶活力为45.06%.挑选激活能力前6位的有机溶剂,在不同浓度下进行酶活力测定,结果如图13所示.Glycerol、1,4-Butanediol、1,3-Propanediol、1-Propanol在合适浓度下均可达到激活50%左右酶活力的效果,这些起激活作用的有机溶剂在后续Tv-BGL的工业应用中可根据情况选用.

图12 有机溶剂对Tv-BGL酶活力的影响Fig.12 The effect of organic solvent on Tv-BGL enzyme activity

图13 不同浓度有机溶剂对Tv-BGL 酶活力的影响Fig.13 Effects of different concentrations of organic solvents on Tv-BGL enzyme activity
2.3.6 底物特异性
β-葡萄糖苷酶底物特异性的测定结果见表1.β-葡萄糖苷酶对乳糖、蔗糖、麦芽糖、羧甲基纤维素(CMC)的酶解能力较弱,而对纤维二糖的酶解能力较强.这说明底物种类对Tv-BGL的酶活力影响较大,Tv-BGL具有明显底物特异性.
2.3.7 产物抑制分析
在反应体系中分别加入不同浓度的β-葡萄糖溶液,使体系中β-葡萄糖终浓度在0.100~2.625 mol/L范围,结果如图14所示,低浓度的葡萄糖溶液对Tv-BGL酶起明显激活的作用,葡萄糖终浓度0.100 mol/L 时相对酶活力达到149.84%,0.250 mol/L时相对酶活力达到150.86%.利用对数法计算对酶活力有50%抑制作用的浓度,得IC50为1.790 mol/L.抑制的程度随葡萄糖浓度的增加而缓慢增加,直至葡萄糖浓度为2.500 mol/L时,相对酶活力仍达到30%,证明β-葡萄糖对Tv-BGL来说不是一种好的抑制剂,但Tv-BGL的产物耐受性可能会有益于商业应用效率.
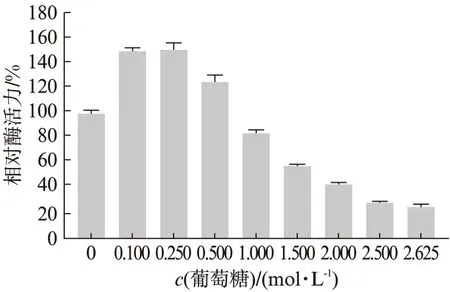
图14 葡萄糖对Tv-BGL酶活力的影响Fig.14 The effect of glucose on Tv-BGL enzyme activity
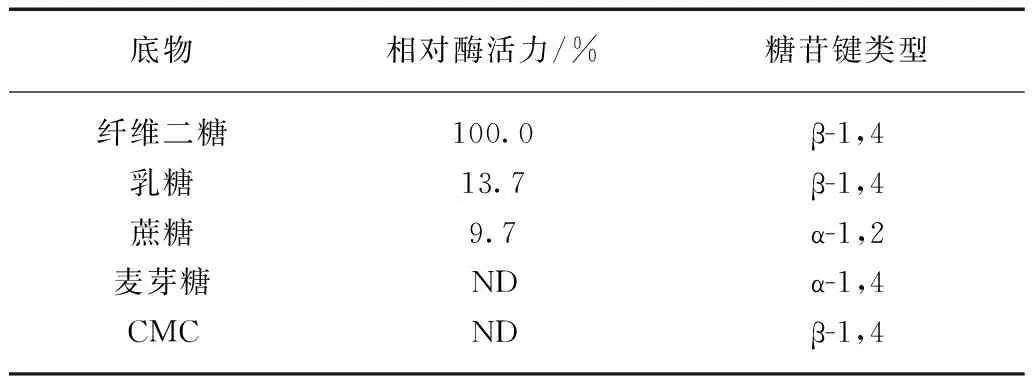
表1 β-葡萄糖苷酶对不同底物的选择性
3 讨 论
β-葡萄糖苷酶来源广泛,普遍存在于生物体、古菌、真细菌和真核生物.哺乳动物来源的GH1乳糖酶-phloridzin水解酶家族和细胞质β-葡萄糖苷酶、GH30人酸性β-葡萄糖苷酶(GBA1)[17]和胆汁酸β-葡萄糖苷酶(GBA2)被认为在糖脂和膳食糖苷的代谢中起重要作用[18].β-葡萄糖苷酶在植物中具有最广泛的生物学功能,包括防御、共生、细胞壁分解代谢和连接、信号传导以及植物次生代谢等.针对微生物中的β-葡萄糖苷酶的研究主要集中在那些参与生物转化以从植物生物质中产生葡萄糖的酶,或参与突破植物细胞壁以建立致病性或共生关系的酶[19].因此,β-葡萄糖苷酶因为分布广泛,且在不同领域大量应用,受到了广泛关注.
在本研究中,Tv-BGL来源于耐热古生菌,它在pH6.0和80 ℃下发挥出最佳的催化活力.以对硝基苯基-β-D-吡喃葡萄糖苷(pNPGlu)为底物的Km和Vmax分别为0.725 4 mmol/L和614.6 U/mg,Kcat/Km=7.6×105mol-1·L·s-1.该酶具有较高的热稳定性和葡萄糖耐受性,受金属离子影响较小,且耐受多种有机溶剂和去垢剂,同时会受多种有机溶剂激活,表明该酶可以积极参与到工业生产过程中纤维素生物质转化为糖的过程,在生物能源领域、食品饮料生产领域等具有潜在的应用前景[20].
有科学家利用生物信息学对用于生物燃料生产的耐葡萄糖β-葡萄糖苷酶进行分析.在大量的分析中,鉴定出极保守性残基,出现在大多数序列中但保守性不高的残基以及保守性很差的残基.保守性表明残基的重要性,这些残基的任何突变就不能用于工程改造更有效的β-葡萄糖苷酶.通过初步的结晶蛋白结构解析,发现Tv-BGL的活性口袋成员包括 Glu380、Glu205、Gln20、Glu425、Trp418、Asn423、Trp426、Trp150、His149、Asn204、Asn313 和 Tyr315,多个芳香基团的存在形成了狭窄的通道.据研究,负责调节葡萄糖耐受的氨基酸通常存在在通往活性位点的通道中,葡萄糖耐受的GH1 β-葡萄糖苷酶呈现出一条狭窄的深通道,限制了葡萄糖进入活性位点[21].通道形状将底物引导至活性位点,并且其负责减少葡萄糖的进入,从而影响GH1 β-葡萄糖苷酶的葡萄糖耐量[22].
近年来,发掘新的葡萄糖苷酶的重点在于其实际应用价值,但是,将蛋白酶用于商业用途通常需要它们在非生理条件下(例如高温和pH值,强钙螯合剂和去污剂)保持高活力.在蛋白酶的自然进化过程中,没有选择压力意味着大多数蛋白酶在这些非生理条件下是不稳定或无活力的.通过定点诱变或定向进化进行的蛋白酶工程改造可以产生具有改进功能的蛋白酶,以满足商业应用的需求[23].另外,科技的发展使得我们可以利用更有效的手段,如纳米技术应用于酶的生产和表征.诸如金属氧化物纳米颗粒、聚合物纳米颗粒、金属纳米颗粒和磁性纳米颗粒等具有优异性能的基本载体材料可用作酶的保护剂[24].由于纳米颗粒具有较高的表面积和较强的吸附力,因此可以作为固定酶的基质.固定化总体上改善了酶的稳定性,还保护了酶分子不被展开.使用固定化酶的另一个非常重要的标准是,酶分子表现为游离酶,并且在水环境中暴露出布朗运动,避免了酶生物分子的聚集,从而丰富了酶的活力.

