滁菊再生体系建立及褪黑素对不定根诱导和抗旱性的影响
苏鹏飞,王大成,阚文杰,丁双双,姚缘圆,侯金艳*,吴丽芳*
(1.安徽大学 物质科学与信息技术研究院,安徽 合肥 230039;2.中国科学院合肥物质科学研究院 智能机械研究所,安徽 合肥 230031)
滁菊(Chrysanthemum
morifolium
cv.Chuju)是菊科菊属一种多年生的草本植物,以花入药,属安徽省四大著名道地药材,名列全国四大药菊之首,具有极高的药用和保健价值.滁菊是中国国家地理标志产品,也是安徽省特色植物资源之一,在我国已有几百年的栽培历史.许多研究表明,滁菊具有良好的保健作用,对头痛、眩晕以及包括癌症在内的各种疾病的预防有良好的治疗和预防作用.滁菊因富含硒、多糖、黄酮和多酚等物质,被国家卫生健康委员会批准为药食同源性植物资源.滁菊的硒含量明显高于其他菊花品种,大量研究表明,硒具有抗氧化、延缓衰老以及抗癌等作用.滁菊多糖具有抗癌以及免疫调节活性,黄酮提取物具有明显的清除活性氧自由基的作用,其中的多酚类物质对高血压引起的心肌肥厚有显著疗效.随着气候变化和各类病害的威胁,优良品种的选育和保存成为包括滁菊在内的各种经济作物发展的重点.此外,成功的植物遗传改良计划依赖于大量遗传资源的保存以及高效的离体再生体系的建立.但目前在生产上,由于滁菊长期采用扦插和分株等传统的无性繁殖手段进行繁殖,繁殖过程均存在繁殖数量有限、繁殖系数低及管理不便等问题.同时,由于多年的田间栽培,导致滁菊出现品种退化、病虫害严重以及相关品种改良和更新速度慢等问题,限制了滁菊的大规模栽培以及产业化应用.由于组织培养技术可在短期内获得大量的无菌苗,可在实现滁菊的优良种质资源规模化生产的同时,使得加速滁菊的品种改良进程成为可能,为将来新品种的改良培育提供一个可选择的基因库.目前关于滁菊组培再生的研究较少,且存在繁殖系数低、繁殖过程繁琐等问题,因此,急需开发一种高效的滁菊再生体系,以满足对滁菊优良株系的快速繁殖以及品种改良需求.
褪黑素(N-acetyl-5-methoxytryptamine, 简称MLT)又名N-乙酰-5-甲氧基色胺,属吲哚胺类化合物,是一种高度进化保守分子,广泛存在于生物界.MLT作为一种多功能调节分子,在动物的生长、发育调控及信号转导中起着重要作用.在人体中参与昼夜节律、睡眠、情绪调节和免疫系统调节等.在动物中可用于清除有害的活性分子,如羟自由基、超氧阴离子等活性氧以及脂质过氧自由基等.近年来,大量研究表明MLT调控植物的整个生长发育阶段,从促进种子萌发到延缓叶片衰老.由于其化学结构(吲哚衍生物)和生物前体(色氨酸)与生长素IAA极为相似,在羽扇豆、水稻和拟南芥等植物的相关研究表明适宜浓度的MLT能够诱导根系的形成和生长,但目前有关MLT在滁菊根系形成中的功能尚未有研究.此外,除了作为生物刺激剂,MLT还可以作为一种ROS的直接清除剂,能够减轻植物应激引起的氧化损伤,增强细胞器的整体抗氧化能力,并调节胁迫反应基因的表达,在植物应对盐、干旱、重金属和病原体攻击等各种非生物和生物胁迫中发挥重要的作用.该研究中笔者以野外滁菊脱毒株系的当年生茎段为外植体,系统地研究植物生长调节剂对滁菊茎段不定芽诱导、不定芽伸长及不定根诱导的影响,并进一步探究外源MLT在滁菊根系发育及再生株系抗旱能力方面的影响.
1 材料与方法
1.1 供试材料
笔者于2019年5月中旬,以前期课题组在安徽省滁州市所选育的优质、高产滁菊脱毒苗优良株系为外植体来源.选取健壮的当年生带腋芽的滁菊茎段为外植体.
1.2 试验设计与方法
在无特别说明的情况下,试验中所选用的基本培养基为MS基本培养基,其中添加6.8 g·L琼脂和30 g·L蔗糖.在生根过程所用培养基为1/2 MS基本培养基,其中蔗糖含量为20 g·L.所用培养基皆用1 N NaOH或1 N HCl将pH调整为5.8,在121 ℃, 105 kPa条件下高压蒸汽灭菌20 min,培养室温度为(25±2)℃,光照时间为14 h,光照强度为150 μmol·m·s.
1.2.1 外植体消毒
将采集的滁菊茎段去除叶片后剪切成4~6 cm大小的切段于流水下冲洗半小时.经75%酒精擦拭后,装于300 mL广口消毒瓶中置于超净工作台(SW-CJ-2D,苏州净化设备有限公司)内用无菌水冲洗4~6遍,然后用75%的酒精消毒30 s;无菌水冲洗2~4遍,再用0.1% HgCl,20% NaClO,10% NaClO,10% HO,5% HO溶液分别对外植体消毒不同时间(1,3,5,7 min),无菌水冲洗4~6遍.滤纸吸干表面残留水分后,将茎段切成至少带有一个腋芽的长0.5~1.0 cm大小的切段,并接种于添加0.5 mg·L6-BA的MS固体培养基中.每个处理接种4皿,每皿接种20个外植体,每个处理重复3次,一周后统计污染率.
1.2.2 滁菊不定芽的诱导和增殖培养
为研究不同浓度6-BA对滁菊茎段不定芽形成的影响,将上述消毒后的无菌茎段切成适宜大小的切段(0.5~1.0 cm),转接于添加有0.2,0.5,1.0 mg·L6-BA的MS培养基中.每瓶接种5个外植体,每个处理接种4瓶,重复3次,培养20 d后统计不定芽诱导率和平均每个外植体产生的不定芽数.继续培养2周后,将诱导出的不定芽丛,转接于该培养基中进行进一步的增殖培养并于20 d后统计不定芽的增殖系数.
1.2.3 滁菊不定芽的伸长培养
为进一步探究不同浓度GA3对滁菊不定芽伸长的诱导效果,将增殖后的不定芽丛接种于添加有不同浓度(0.1,0.2,0.5,1.0 mg·L)GA3的培养基中进行不定芽的伸长培养.每个处理接种4瓶,每瓶接种5个外植体,重复3次,20 d后统计不定芽的高度并观察生长状况.
1.2.4 滁菊不定根的诱导培养
为了研究不同种类和浓度的外源植物生长调节剂对滁菊不定根诱导的影响,将长度为2~3 cm并伴有至少4片叶子且长势均一的不定芽从不定芽丛上分离下来,接种于添加有不同浓度(0.1,0.5,0.8 mg·L)的IAA或IBA的1/2 MS生根培养基中进行不定根诱导培养.每个处理接种4瓶,每瓶中接种5个外植体,重复3次,20 d后统计不定根诱导率、平均每个外植体产生的不定根数、平均不定根长,并观察植株的生长状况.
1.2.5 褪黑素对滁菊不定根的诱导培养
为进一步探究外源MLT对滁菊不定根诱导效果的影响.选用添加有10,50,100,150 μmol·LMLT的1/2 MS培养基分别进行滁菊茎段不定根诱导预试验.结果显示添加50 μmol·LMLT 时对滁菊株高以及不定根诱导的效果最好.在此基础上,将不定芽分别接种于添加有50 μmol·LMLT,0.1 mg·LIBA,50 μmol·LMLT + 0.1 mg·LIBA的1/2 MS培养基中,以不添加任何植物生长调节剂的1/2 MS培养基作为对照组,探究MLT对不定根形成以及幼苗生长状况的影响.每个处理接种4瓶,每瓶中接种5个外植体,重复3次,20 d后统计不定根诱导率、平均每个外植体产生的不定根数以及观察植株的生长状况.
1.2.6 滁菊再生植株的驯化移栽
将获得的完整再生植株进行移栽试验.移栽前,首先选取株高为4~5 cm,并伴有健壮根系的滁菊完整植株进行驯化炼苗.流水洗净附着于根系上的琼脂,然后移栽于装有栽培基质(v
(营养土)∶v
(珍珠岩)=3∶1)的育苗盆中进行培养,并以野生滁菊幼苗作为对照.移栽室的培养条件为:温度为(25±2)℃,光照时间16 h,光照强度150 μmol·m·s.所用育苗盆为10 cm×10 cm×8.8 cm,每个处理移栽4盆,每盆移栽3棵,重复3次,分别在第7,14,21,28 d时观察其生长状况.一个月后,将育苗盘中的再生植株转至大田进行移栽培养.1.2.7 再生植株的干旱处理
为进一步探究MLT及IBA对滁菊再生植株幼苗抗旱能力的影响,将50 μmol·LMLT、0.1 mg·LIBA、50 μmol·LMLT + 0.1 mg·LIBA处理组培养的完整再生滁菊植株按照1.2.6中所述方法进行移栽,移栽后充分浇水,然后进行10 d的干旱处理.以不添加植物生长调节剂的处理组作为对照.每个处理移栽4盆,每盆移栽3棵,重复3次,20 d后观察各个处理组滁菊植株的生长状况.
1.2.8 统计分析
实验采用完全随机区组设计,每个实验重复3次,试验所得数据采用Excel 2007及Origin 2019进行统计与分析,用单因素方差分析每个实验的平均值,结果用平均值(mean)和标准差(standard deviation,简称SD)表示.
2 结果与分析
2.1 消毒试剂的种类和浓度对滁菊外植体消毒效果的影响
研究结果表明接种1周后,外植体的感染率趋于稳定,此时,外植体成活情况如图1所示.

图1 消毒试剂的种类和浓度对外植体成活率的影响
由图1可知,在所测试的不同种类和浓度的消毒试剂中,0.1% HgCl溶液在消毒3 min时茎段的成活率最高,为93.3%,随着消毒时间的延长,茎段成活率逐渐下降.其次,将茎段置于10% NaClO溶液中消毒3 min时,茎段成活率为76.7%.当茎段置于20% NaClO溶液、10% HO溶液和5% HO溶液中消毒不同时间,得到的成活率均不理想,成活率较低.
2.2 不同浓度6-BA对滁菊不定芽诱导的影响
以无菌茎段作为外植体,研究了不同浓度(0.2,0.5,1.0 mg·L)6-BA对不定芽诱导效率的影响,培养20 d后的不定芽诱导情况如图2所示.

图2 不同浓度6-BA对滁菊茎段不定芽诱导率(a)和不定芽数(b)的影响
由图2可以发现,在添加有0.5,1.0 mg·L6-BA的培养基中,茎段的不定芽诱导率均达到100%.添加有0.5 mg·L6-BA的处理组平均每个外植体产生的不定芽数最多,经继代培养后增殖系数为7.76,且不定芽的长势最好.当添加浓度为0.2 mg·L6-BA时不定芽诱导率为90%,继代培养后增殖系数为5.21,不定芽的长势不均一;添加浓度为1.0 mg·L6-BA时长势较好,平均每个外植体产生的不定芽数最少,继代培养后增殖系数为4.32.
2.3 不同浓度GA3对滁菊不定芽伸长的影响
在不定芽诱导的基础上,进一步研究了不同浓度(0.1,0.2,0.5,1.0 mg·L)的GA3对滁菊不定芽伸长的影响,培养20 d后的不定芽生长情况如图3所示.

图3 不同浓度GA3对不定芽伸长效果的影响
如图3显示,当培养基中添加有0.2 mg·LGA3时,滁菊不定芽长势均一,不定芽高度为4.16 cm,显著优于其他浓度,且不定芽基部伴随新的不定芽点的形成;当GA3浓度为0.5 mg·L时,株高为3.83 cm,未发现不定芽点的出现;GA3浓度为1.0 mg·L时,出现明显的玻璃化现象以及死亡现象.
2.4 不同种类和浓度植物生长调节剂对滁菊不定根诱导效果的影响
以伸长的不定芽作为外植体,进一步研究了不同浓度的IBA以及IAA对不定根形成的影响.由图4可知,光照培养7 d时,各个处理组的不定根诱导率皆达到100%,但不定根的长度及平均每个外植体产生的不定根数存在很大的差异.其中0.1 mg·LIBA处理组中获得的不定根数最多,平均每个外植体产生8.52个不定根;0.1 mg·LIAA处理组在促进根长方面表现最好,平均根长为1.67 cm,具体如图4(a)~(b)所示.在培养至20 d时,0.1 mg·LIBA处理组在诱导不定根数以及根长方面的表现皆优于其他处理组,当培养基中添加0.5或0.8 mg·LIBA或IAA时,外植体基部皆有愈伤组织形成,不定根诱导状况如图4(c)~(d)所示.
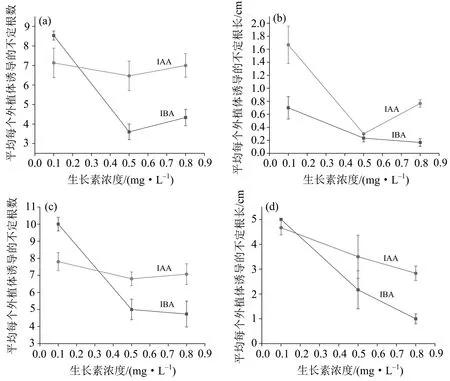
(a)培养7 d时平均每个外植体产生的不定根数;(b)培养7 d时平均不定根长;(c)培养20 d时每个外植体产生的不定根数;(d)培养20 d时平均不定根长.
2.5 褪黑素对滁菊不定根诱导效果的影响
由以上结果可知,添加有0.1 mg·LIBA的1/2 MS培养基最有利于滁菊的生根诱导,在此基础上,进一步研究了外源MLT与IBA对不定根的诱导效果的影响,结果如图5所示.滁菊离体再生过程如图6所示.

图5 褪黑素对滁菊诱导不定根数、不定根长(a)和株高(b)的影响

(a)无菌茎段;(b)不定芽的诱导;(c)不定芽的继代培养;(d)不定芽的增殖;(e)不定芽的伸长;(f)完整的再生植株.
由图5发现,在50 μmol·LMLT、0.1 mg·LIBA、50 μmol·LMLT + 0.1 mg·LIBA以及CK处理组中,除50 μmol·LMLT + 0.1 mg·LIBA的不定根诱导率为80%外,其余3个条件下的不定根诱导率在培养20 d时皆达到100%.在诱导不定根数方面,50 μmol·LMLT处理组的效果弱于0.1 mg·LIBA处理组,但在不定根长和株高方面,50 μmol·LMLT处理组促进作用最为显著.50 μmol·LMLT处理后,不定根长与株高分别为5.67 cm和4.3 cm,而IBA处理组的不定根长与株高分别为5.33 cm和3.83 cm.此外,在长势方面,研究发现MLT处理组的叶片更为宽大,整体长势优于IBA,且发黄枯萎的叶片明显较少.而MLT与IBA同时添加后,植株发育迟缓,长势不均一,根细弱且数量较少.
2.6 再生植株的驯化移栽
将0.1 mg·LIBA处理组中根系发达、长势健壮的组培苗完整植株进行驯化移栽,并以长势相同的野生滁菊幼苗作为对照.随着滁菊植株在育苗盆中的生长,在栽培20 d后进一步移栽,每1个育苗盆只保留1棵滁菊幼苗,其生长状况如图7所示.

(a)移栽7 d;(b)移栽14 d;(c)移栽21 d;(d)移栽28 d.(每图中处理组在左,对照组在右,比例尺=1 cm)
由图7可以看出,在生长速度方面,滁菊组培苗与野生幼苗的株高变化基本一致,但很明显的一点区别是野生幼苗在茎粗以及色泽方面都比组培苗表现更好,但在移栽一个月左右这一差距逐渐缩小,表明再生苗经移栽后能正常发育且性状未发生改变.
2.7 再生植株的抗旱性分析
将50 μmol·LMLT、0.1 mg·LIBA、50 μmol·LMLT + 0.1 mg·LIBA以及CK处理组获得的伴有健壮根系的离体再生幼苗进行田间移栽.幼苗移栽后首先充分浇水,随后进行为期10 d的干旱处理,从幼苗的发育状况来看,50 μmol·LMLT处理组无论是在株高、根长,还是长势方面,都表现出较好的形态.而添加0.1 mg·LIBA的处理组,除了在根长方面与对照组相比具有一定优势外,在幼苗的地上部分干旱抗性不明显,幼苗的生长状况如图8所示.单独添加MLT对滁菊长势以及根系发育的促进作用表明MLT在一定程度上能够提高滁菊的抗旱性.

① CK;② 经50 μmol·L-1 MLT处理的幼苗;③ 0.1 mg·L-1 IBA处理过的幼苗;④ 50 μmol·L-1 MLT+0.1 mg·L-1 IBA处理的幼苗.
3 讨 论
外植体消毒是植物再生体系建立需要解决的首要问题,消毒效果将影响后续各个实验环节,对滁菊来说,在所测试的不同种类和浓度的消毒剂中,0.1%的HgCl溶液消毒3 min时可达到93.3%的成活率,能有效地为后续再生体系的建立提供大量无菌材料.这与李洪丽等的研究结果相似,用0.1% HgCl对甜菜种球进行消毒,效果优于NaClO.
不定芽的诱导与伸长是再生体系建立是否取得成功的关键点,6-BA作为一种人工合成的细胞分裂素,大量的试验结果表明它具有促进发芽、花芽分化、果实生长发育,提高植物对胁迫环境的抗性等作用.与前人在乌桕中的研究结果相似,6-BA对滁菊不定芽的诱导具有显著影响,且浓度为0.5 mg·L的6-BA在滁菊不定芽的诱导过程中发挥显著效果.滁菊茎段所产生的不定芽数最多,增殖系数为4.67,继代培养后不定芽的增殖系数为7.76,且不定芽的长势最好.大量研究表明:适宜浓度的细胞分裂素在细胞的有丝分裂过程中,通过诱导D-细胞周期蛋白刺激G1/S进程,同时通过激活细胞周期蛋白依赖性激酶(CDK)活性推进G2/M期,从而加速细胞的有丝分裂进程,而高浓度的细胞分裂素将抑制侧器官的形成.进一步的研究表明,在分子水平上,外源添加细胞分裂素可以激活WUSCHEL
(WUS
)基因的表达,该基因对茎尖分生组织的发生和维持具有重要作用.GA3是一种植物生长调节剂,在促进生芽、抽薹、分蘖以及提高果实结果率等方面具有显著效果,在对其他植物离体再生的相关研究结果表明,GA3生物合成和信号转导影响细胞的伸长和分裂.在笔者的实验中,也得到了相似的结果,添加有0.2 mg·L的GA3将显著增加不定芽高,在培养20 d时的株高为4.17 cm.在赤霉素信号转导途径中存在一个重要的负调控蛋白——DELLA蛋白,该蛋白在赤霉素不存在或浓度较低的情况下抑制植物的生长,而当赤霉素存在时它可以使DELLA蛋白泛素化并使其降解,激活下游基因的表达,从而促进细胞或组织的伸长.
不定根诱导是再生苗进行田间移栽能否成功的关键所在,IBA和IAA被广泛用于促进植物生根,IBA与IAA同属于生长素,两者都能促进生根.IBA通常被用来进行不定根的诱导,在许多情况下比IAA更有效,这可能与IBA在溶液以及植物组织中的稳定性更强有关.在笔者的实验中,也得到了相似的结果,0.1 mg·L的IBA对滁菊的不定根诱导效果显著,在培养20 d时不定根诱导率为100%,平均每个外植体产生的不定根数为10,平均根长为5.0 cm.相关研究表明,IBA能够通过调节过氧化物酶体的活性诱导NO的合成,从而促进侧根的形成以及不定根的诱导.并且最近的研究表明,抑制根表层、皮层、内皮层、中柱鞘以及中柱中的生长素时,相关细胞周期蛋白以及CDK的表达量也会被抑制,这将破坏正常的细胞周期,影响植物根系的发育.
将完整的组培苗植株进行田间移栽,并以野生滁菊幼苗作为对照,能够观察到野生滁菊幼苗的长势明显优于组培苗,其原因可能是组培苗在继代过程中遭受的机械损伤不断累积,使长势变弱,并且组培苗长期生长于含水量较高的组培瓶中,即便进行了有效的驯化炼苗,移栽后依然需要一定时间适应土壤环境.野生幼苗在自然光照环境下生长,自身积累了大量的有机物,具有更强的生长活性.
MLT在提高植物耐盐性、抗寒性以及保持果实营养物质含量等方面表现突出.同时,伴随着植物中MLT受体的发现,MLT作为一种新型的植物激素在植物生长调节过程中的各种作用不断被发现,其中包括在水稻体内参与MLT合成的基因SANT
过表达时,不但内源性MLT的合成增强,同时主根和不定根的发育也得到了促进;在拟南芥中异源表达MsSNAT
基因可以促进侧根的形成,这些研究结果表明MLT及其合成基因参与植物根部的发育.笔者的试验结果也表明,MLT在促进滁菊不定根的形成方面比外源施加生长素IBA具有更好的效果,添加50 μmol·LMLT在培养20 d时获得的滁菊平均根长为5.26 cm,而添加0.1 mg·LIBA在培养20 d时获得的根长为5.0 cm,并且在生根后期能够明显减少叶片的发黄枯萎现象.除此之外,在干旱条件下,MLT处理过的滁菊幼苗在田间表现出更长的根系和更佳的长势,能够明显提高滁菊幼苗的抗旱性.
