CdSe/ZnS量子点对四膜虫的毒性研究
王志正, 林志康, 沈 阳, 赵宇侠
(1.上海理工大学 医疗器械与食品学院,上海200093; 2.上海健康医学院 医学技术学院,上海201318;3.上海中医药大学 中药学院,上海201203)
量子点(quantum dots,QDs)是一种新型荧光纳米材料,粒径范围一般在1~10 nm之间,由Ⅲ~Ⅴ族或Ⅱ~Ⅵ族元素合成,通常以某种半导体材料为内核,外面包裹其他半导体材料,量子点也因此具有良好的光电性质.目前应用比较多的是CdX(X=S、Se、Te)量子点,其中以CdSe/ZnS量子点荧光强烈、发光稳定、易于合成等特点备受研究者的关注.随着材料的制备及表面生物修饰技术的进步,镉系量子点被广泛应用于药物检测和生物成像等领域.Cui等[1]用寡核苷酸杂化的CdSe量子点检测了最低限度0.2 pmol/L的DNA;庞代文等[2]用BSA修饰的CdSe/ZnS量子点测定了中药片中微量的铜,检测限达到了1.0×10-4μg/mL.另一方面,量子点对环境以及人体健康的潜在影响和风险也同时引起广泛关注[3-7].国内外学者对量子点毒性机制、体内迁移路径和环境暴露风险等方面安全隐患进行了大量的报道[3-7],其中对哺乳动物细胞和动物模型的毒性是目前报道最多、研究最透彻的,其细胞毒性机理可以归纳为以下3点:1)量子点内核与介质相互作用,降解释放Cd2+等重金属离子[8-9];2)通过产生活性氧物质(reactive oxygen species,ROS)增加胞内氧化压力,诱导细胞凋亡[10];3)非特异性吸附到细胞表面,与蛋白结合,破坏结构,影响细胞的正常功能[11-12].
以水生生物包括藻类、菌类、鱼类以及无脊椎动物为模型的纳米材料生态毒性也有报道.文献[13-14]报道了不同浓度的C60暴露于自然水环境后黑鲈大脑及中枢神经中起保护作用的细胞遭到了破坏;朱小山等[15]报道了3种碳纳米材料对斜生栅藻和大型蚤的生长抑制具有个体差异性;罗勋等[16]报道了纳米银对线虫的生殖抑制和氧化应激损伤.这些报道说明了量子点对水生生物的毒性效应可能类似于哺乳动物细胞,而目前关于量子点对水生生物的毒性效应,尤其是毒性机制的报道还不是很多,水生生物作为水生生态系统的重要组分,遭遇的毒性效应过程以及产生的生物学变化关联着生态系统的安全,明确量子点纳米对水生生物的毒性机制,丰富毒性效应及机制的相关数据资料将有助于掌握量子点并推断其他纳米材料的水生生态系统安全的风险.
四膜虫是一种分布于全球各地淡水环境中的纤毛虫原生动物,在水生生态系统食物链中处于重要的位置.四膜虫对许多毒物的响应比其他高等生物更为敏感、直接,是较理想的生物毒性试验对象,四膜虫具有高等真核生物所共有的保守基因和基础代谢通路[17-18],在毒理学研究中作为水生生态系统模式生物使用.关于纳米材料诱导的四膜虫毒性的报道目前也仅限几篇,姚莹等[19]发现纳米ZnO对四膜虫的生长及抗氧化系统的抑制作用.罗慧[20]发现硒化镉和硒化银量子点能够通过内吞作用进入四膜虫细胞内分布在细胞器,抑制细胞生长,破坏细胞膜,对DNA和线粒体造成损伤,诱导线粒体介导的细胞凋亡.
这些毒性效应都可能与氧化损伤相关联,氧化损伤作为量子点的毒性机制之一,在细胞和动物范围被广泛研究报道,但是未见对四膜虫的报道,四模虫作为水生模式生物,一方面可以代表单细胞真核生物的毒性反应,同时也可以阐释量子点对水生生物的生态毒性风险,本研究拟就量子点对四膜虫的氧化损伤进行初步调查,分别研究四膜虫ROS的产生情况,四膜虫细胞膜损伤情况以及抗氧化系统的调控等方面来考察该机制的影响,同时结合量子点对四膜虫种群密度的抑制确定其毒性效果,通过研究量子点对四膜虫的影响,一方面可以阐释量子点纳米作用于生物体后可能产生的毒性及其作用机制,另一方面也有助于更好的理解其对于整个水生生态系统潜在的风险.
1 材料与方法
1.1 四膜虫的培养嗜热四膜虫SB210株系,由中国科学院水生生物研究所缪伟实验组馈赠.四膜虫是一种单细胞真核原生生物,呈椭圆长梨形,全身布满纤毛,体长约40~60μm,广泛分布于全球各地的淡水环境中,其生长周期短,易于培养.四膜虫的培养基组分为:2%蛋白胨,0.1%酵母提取物,0.2%葡萄糖溶于超纯水,121℃灭菌20 min,冷却后接种四膜虫,在28℃、150 r/min条件下于恒温摇床无菌培养至对数期进行后续实验.
1.2 试剂与仪器实验所用的试剂:CdSe/ZnS量子点购自上海星紫科技有限公司,粒径为4.5 nm左右,所用PCR引物由生工公司合成,RNA提取试剂Trizol购自Takara公司,荧光定量PCR试剂购自罗氏公司,碘化丙啶(propidium iodide PI)荧光染色剂、Bradford蛋白定量试剂盒均购自上海碧云天生物技术有限公司;预染蛋白Marker购自Thermo公司;SOD蛋白抗体购自安诺伦生物科技有限公司;ECL超敏发光液购自美国Bio-Rad公司;无水乙醇购于国药集团化学试剂有限公司,其他试剂均为分析纯.
实验所用的仪器:激光共聚焦显微镜(Leica TCS-SP8,德国);RT-PCR仪(罗氏Light Cycler 96,瑞士);水合粒径仪(马尔文Zetasizer Nano ZS,英国);冷冻离心机(Eppendorf H1650-W,德国);混匀仪(Vorter Mixer QL-866);流式细胞仪(BD LSRFortessa,美国);荧光光谱仪(Horiba QM-8075);透射电镜(Hitachi HT7700,日本);蛋白凝胶成像系统(Molecular Imager ChemiDocTM XRS+Imaging System,BIO-RAD公司).
1.3 CdSe/ZnS量子点的表征量子点样品的TEM图在透射电镜工作电位为200 kV测定;量子点的荧光光谱在荧光光谱仪上测定,激发光源为75 W氙灯,检测器为PMT F900.QDs的水合粒径通过马尔文的粒径分析仪测定.
1.4 激光共聚焦观察量子点与四膜虫的结合在培养基中加入适量量子点母液,使得终质量浓度为2.4μg/mL,接种0.5 mL对数生长期的嗜热四膜虫,于恒温摇床150 r/min培养1 h,收集培养基于EP管中,4 000 r/min离心5 min,PBS洗涤两次,去除培养基及四膜虫细胞上附着的量子点,用4%多聚甲醛固定四膜虫后,在激发波长为630 nm的激光共聚焦显微镜下观察四膜虫与量子点的结合.
1.5 流式细胞仪检测ROS及细胞膜损伤取对数期的四膜虫9 mL分装到25 mL锥形瓶中,共设四组实验组,每组3个平行样,加入1 mL不同浓度量子点母液,使量子点的终质量浓度分别为0、0.1、2、8μg/mL,在28℃恒温培养箱中培养48 h后离心(2 000 r/min 10 min)并去除上清,加入预先配置好的PI、DCFH-DA荧光探针分别用于检测细胞膜损伤、ROS的量,室温避光孵育20 min后,用磷酸缓冲液(PBS)洗涤两次去除未装载的荧光探针,流式细胞仪检测,PI的激发波长和发射波长分别为530和620 nm,ROS的激发波长和发射波长分别为488和525 nm.
1.6 量子点对四膜虫存活率影响首先配置质量浓度为250 mg/L的CdSe/ZnS量子点母液,在装有无菌培养液的锥形瓶中加入不同量的母液使量子点终质量浓度为0、0.1、0.4、2.4、9.6μg/mL,接种0.5 mL对数生长期的嗜热四膜虫,于28℃恒温摇床培养,在150 r/min下培养48 h后,在体式显微镜下观察记数细胞密度,每组3个平行,计算平均值,另设空白对照,与对照相比计算四膜虫存活率,

并利用t检验确定是否具有显著性.
1.7 荧光定量PCR实验依据嗜热四膜虫GAPDH(序 列 号:AF319450.1)、GST(序 列 号:FJ175686.1)、SOD(序列号:XM_001007667.2)基因在GenBank和NCBI Reference Sequence中的序列,用软件Primer 6设计基因的引物(见表1),由生工公司合成引物;按照试剂盒操作用Trizol提取总RNA,逆转录试剂盒反转录cDNA,根据RT-PCR试剂盒说明书取cDNA1.6μL、2×SYBR 5μL、引物0.4μL、ddH2O 3μL配制10μL的RT-PCR反应体系,设置三组重复,95℃预变性30 s后,经过95℃10 s,60℃30 s,共40个循环,最后95℃15 s,60℃1 min,测定溶峰曲线.

表1 实时荧光定量PCR引物Tab.1 Primers for real time fluorescence quantitative PCR(RT-qPCR)
1.8 蛋白免疫印迹法检测蛋白的表达用100μL含有蛋白酶抑制剂的RIPA缓冲液从量子点处理后的四膜虫中提取总蛋白,细胞裂解液以12 000 r/min离心20 min,收集上清液即为提取的总蛋白,采用Bradford法测定总蛋白浓度.将等量的总蛋白经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)后转移到硝基纤维素膜上,用5%脱脂牛奶于室温封闭膜1 h,分别与anti-GAPDH和anti-SOD抗体(1∶1 000)4℃孵育过夜,用TBST洗涤膜3次后用HRP标记的二抗(1∶5 000)室温孵育2 h,再漂洗3次,每次10 min,辣根过氧化物酶显色.
1.9 统计学处理方法采用SPSS 21.0软件进行统计学分析.数据均采用均数±标准差(x±s)表示,单因素方差分析(one-way ANOVA)比较组间差异性,以P<0.05为差异有统计学意义.
2 结果与讨论
2.1 量子点表征通过TEM、DLS及荧光光谱对CdSe/ZnS量子点进行了表征,透射电镜(图1(a))显示CdSe/ZnS量子点平均直径在4.5 nm左右,荧光光谱仪(图1(b))检测结果显示量子点的最大激发波长在573 nm,最大发射波长在603 nm.水合粒径(图1(c))结果显示量子点平均直径在116.5 nm,Pdi系数0.245,说明量子点在液体中存在聚团现象,但分散情况良好.
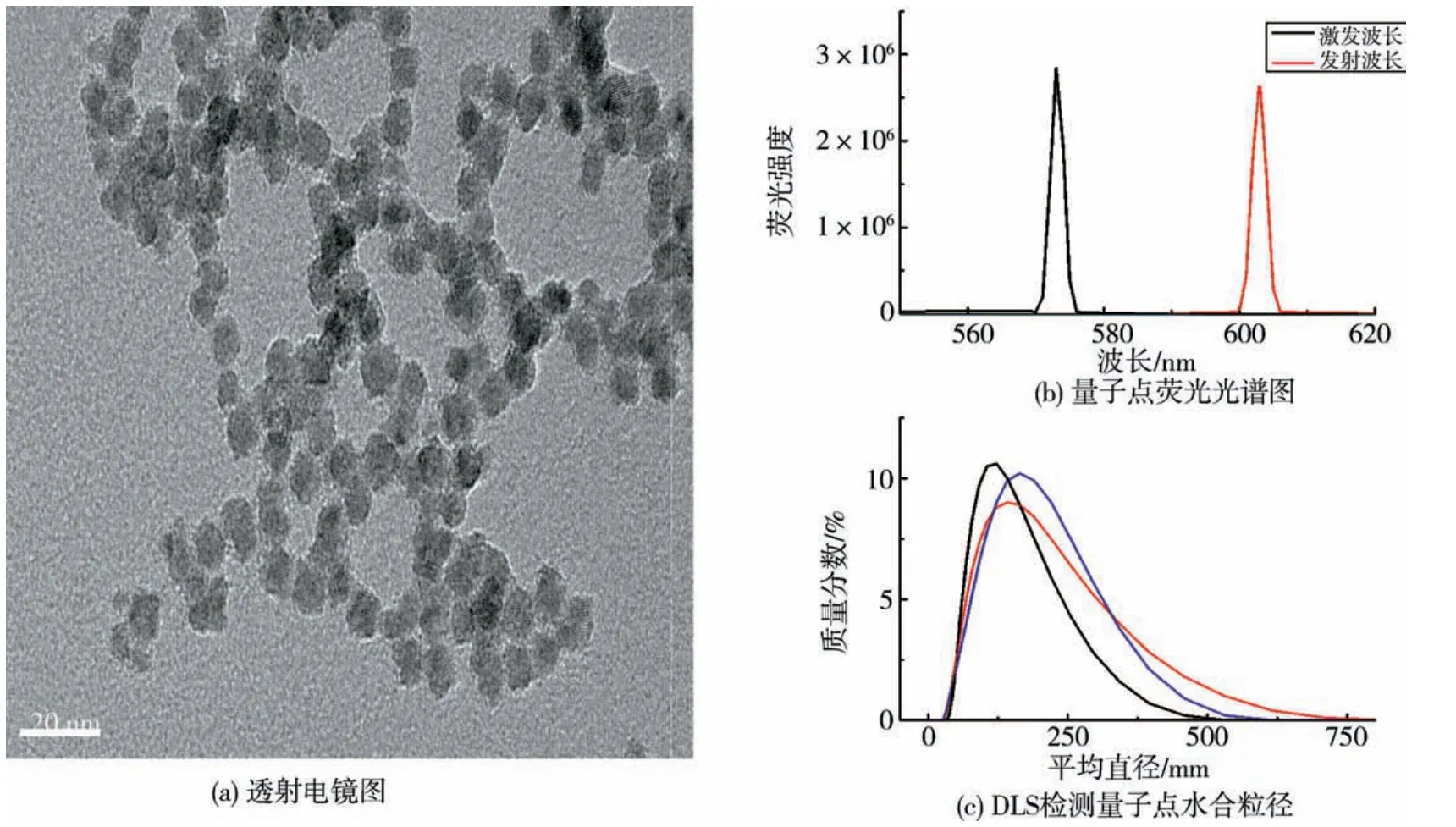
图1 量子点表征Fig.1 Characterization of quantum dots
2.2 量子点与四膜虫的结合及对四膜虫存活率的影响如图2所示,(a)为荧光图,(b)为明场图,(c)为merge图,激光共聚焦显微镜可以观察到,量子点可以聚集在四膜虫表面并发射荧光,说明量子点可以与四膜虫细胞结合,具备诱导毒性效应、抑制细胞生长的基础,图2(d)存活率的结果显示,在实验的浓度范围内(0、0.1、0.4、2.4、9.6μg/mL),量子点对四膜虫的生长抑制呈剂量依赖效应,9.6μg/mL的CdSe/ZnS量子点对四膜虫的生长抑制有39.6%左右,说明量子点对四膜虫细胞具有毒性,但是在实验的过程中增加量子点剂量后四膜虫的种群密度并没有明显下降(数据未附加),这可能是由于量子点在液体中存在聚团现象,水合粒径结果表明聚团的量子点颗粒粒径远大于正常量子点,文献[21]研究表明量子点粒径越大,对细胞的毒性越小,在本实验中更高的浓度没有观察到明显的存活率抑制的增加,可能是由于高浓度条件下量子点的聚合现象带来的影响,聚合后大粒径的量子点具有小的比表面积,暴露在表面的镉相对于小粒径的少,与介质作用产生的游离Cd2+下降,毒性效应受到影响.图2(d)也说明增加浓度并不会造成更大的毒性效果.图2中,与CK组相比有显著差异,*表示P<0.05,**表示P<0.01.

图2 量子点与四膜虫结合及对存活率影响Fig.2 Quantum dots bind to Tetrahymena cell and inhibitory effects of QDs on Tetrahymena cellular viability
生长抑制作用是毒理学最基本的指标之一,在本研究中对量子点纳米材料对四膜虫的生长抑制作用也进行了验证,结果显示在研究的浓度范围内呈现了剂量毒性效应,罗慧[20]也发现CdSe量子点对四膜虫生长存在抑制作用,且毒性强度与浓度成正比,这与本研究的结果一致.
2.3 量子点对四膜虫的氧化损伤被广泛接受的镉系量子点的毒性机制的探讨主要集中在重金属元素Cd2+的释放、氧化过程中活性氧的产生以及活性氧自由基ROS介导的氧化应激等方面[22],而氧化损伤也是重金属离子Cd2+的毒性机制之一.活性氧可启动一个链式反应,易与细胞膜上的各种不饱和脂肪酸及胆固醇反应,这种直接作用于细胞的氧化损伤能导致细胞脂质过氧化水平升高,引起DNA氧化损伤,细胞凋亡[23].
图3(b)的结果显示,随着量子点的质量浓度增加(0.1、2、8μg/mL),ROS的产生量基本上呈现了平行增加的趋势,相对于对照组,2μg/mL处理组四膜虫的ROS增加了109.4%,增加最多;8μg/mL处理组比对照组增加了73.2%,比2μg/mL处理组略有下降,这可能是在高浓度的溶液中,受到量子点的聚合影响.ROS的作用之一就是攻击细胞膜,PI用于检测细胞膜的通透性变化,检测结果代表细胞膜损伤程度,图3(a)结果显示随着量子点浓度增加,细胞膜的损伤也对应严重,除了8μg/mL量子点处理组没有与ROS的产生呈现一致的趋势外,其他处理组也大体与ROS的产生相呼应.说明了ROS的产生是膜损伤的主要原因.
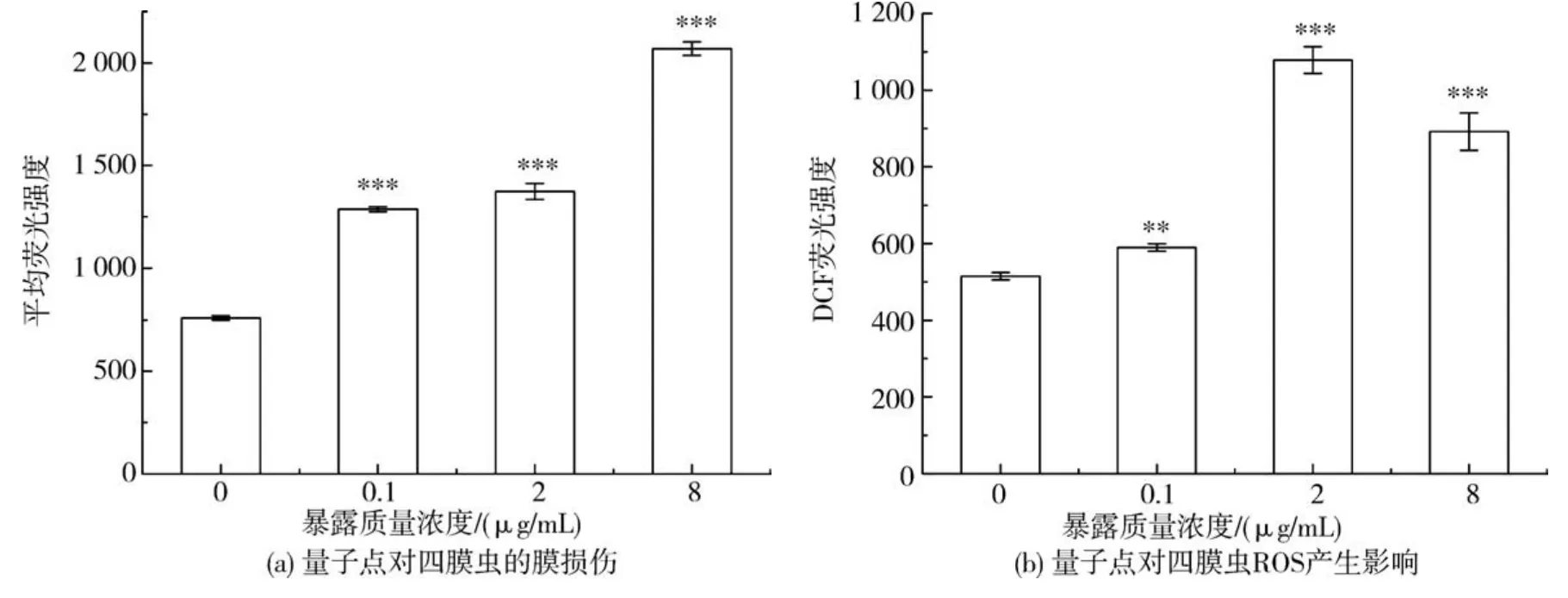
图3 量子点对四膜虫的氧化损伤.Fig.3 Oxidative damage on Tetrahymena caused by QDs
Wang等[24]研究也发现,TiO2NPs的细胞毒性主要与活性氧自由基的产生有关,与本研究结果类似,印证了ROS介导的氧化损伤;Mortimer等[25]观察到羧酸化CdSe/ZnS量子点在亚致死浓度下作用24 h内没有出现细胞坏死、严重氧化损伤、脂质氧化和DNA损伤等明显的细胞毒性,这与本研究的结果不一致,本研究的最高浓度在亚致死浓度下,但是细胞膜破坏和ROS的量都显著增加,可能因为本研究作用的时间48 h比文献[25]研究的24 h作用时间长.
量子点具有高的比表面活性,能够转移电子给溶液中的氧,产生单线氧等活性氧自由基,考虑到活性氧自由基的生命周期只有10-5~10-6s,所以产生的ROS要对四膜虫实施毒性的必要条件是ROS产生位置要与细胞膜足够近[26],在本研究中共聚焦的观察结果能够看到量子点结合在细胞表面,有足够近的距离给产生的ROS在生命周期内完成与细胞膜的反应过程,破坏细胞膜.
2.4 量子点对四膜虫抗氧化系统的影响一般生物体都处在正常的氧化平衡状态,自由基产生系统及抗氧化系统可以有一定的调节能力,细胞在遭到ROS攻击,体内的抗氧化系统会通过启动抗氧化基因编码抗氧化蛋白的表达来调节机体的氧化还原平衡,图4(a)和(b)结果表明,随着量子点浓度的增加,四膜虫细胞内的抗氧化基因SOD和GST的表达都有不同程度的增加,但是相对对照组来说都处在低表达状态,Western blot结果显示如图4(c)和(d),SOD蛋白的表达与SOD基因也大体一致:随量子点剂量的增加而增加,相对对照组呈现低表达.

图4 量子点对四膜虫抗氧化系统的影响Fig.4 Effects of quantum dots on antioxidant system of Tetrahymnias
在机体受到ROS攻击时,对应的抗氧化酶GST和SOD等表达一般会上升,以平衡ROS带来的氧化应激损伤,在本研究中随着量子点浓度的增加,四膜虫细胞内的抗氧化基因GST和SOD及SOD蛋白的表达都有不同程度的增加呼应了ROS产生的效果,Zou等[27]研究了光照条件下TiO2NPs对梨形四膜虫代谢水平的影响,数据显示四膜虫体内的活性氧自由基水平在光照下比在同浓度黑暗条件下增加了1.9倍,超氧化物歧化酶(SOD)水平增加了3.9倍,与本研究的结果一致.
但是对本研究来说,各处理组无论蛋白还是基因的表达,相对对照组来说都处在低表达状态,可能源于量子点与蛋白结合、干扰蛋白表达的能力,本研究量子点具有纳米级的小粒径,能与大分子蛋白接近,并且量子点具有高反应活性,其毒性机制中有一个重要的机制是量子点可能与大分子蛋白结合阻碍其实施对应的生物学功能[8,12].在本研究中出现的现象可能是由于低浓度时,纳米聚合情况比较少(聚合的水合粒径约为116 nm),非聚合状态的游离纳米粒子(4.5 nm)较多,所以和大分子蛋白结合率可能比较高,抑制了对应的抗氧化系统的蛋白和基因的表达,而在高浓度组时游离的小纳米相对较少,对抗氧化蛋白的抑制作用减弱,所以能够观察到蛋白和基因的表达均高于低浓度组.
3 结论
1)氧化损伤是量子点的毒性机制,本实验ROS的量与细胞膜损伤程度基本呈一致变化,说明ROS所诱导的氧化损伤是四膜虫细胞膜损伤的主要原因.
2)细胞膜作为机体的第一屏障,与细胞的生长存活直接相关,所以本研究观察到的量子点对细胞存活的抑制可能来源与量子点的氧化损伤所导致的细胞膜的破坏.详细的机制还有待于后续研究.
3)本研究结果中,无论对四膜虫生长的抑制、细胞膜的破坏、氧化应激等效应都可能带来食物链和生态系统的扰动,水生生态系统的安全需要更多的研究关注.
致谢上海健康医学院种子基金(E1-0200-19-201132)和上海健康医学院百人库项目(B1-0200-19-311133)对本文给予了资助,谨致谢意.

