基于量子点的电化学发光核酸分析传感器研究进展
张 甜, 龚金博, 杨锡东, Pier-Luc Tremblay
(1.武汉理工大学化学化工与生命科学学院,湖北武汉 430070;2.绍兴市上虞区理工高等研究院,浙江绍兴 312000;3.武汉理工大学三亚科教创新园,海南三亚 572024)
1 前言
人类维持正常的生命健康需要在特定的时空精准地调节约十万个基因的活性[1],这些基因以特定核苷酸序列的形式贮存于核酸(Nucleic Acid)内,现代生命科学研究表明很多重大疾病都与基因突变密切相关。检测与疾病相关的特定序列核酸对于疾病的早期诊断和治疗具有十分重要的意义,核酸分析已然成为现代生物分析中最具潜力的领域之一。
电化学发光(Electrochemiluminescence,ECL)是将电化学与化学发光相结合的分析方法,既具有电化学分析可控性强、分析速度快等特性,又具有化学发光线性范围宽、灵敏度高等优势[2]。随着纳米科学技术的不断发展,各种形貌尺寸的纳米材料相继出现,其中量子点(Quantum Dots,QDs)以其良好的光稳定性、高量子产率以及尺寸可控的优良特性从众多纳米材料中脱颖而出[3]。自2002年发现Si QDs的ECL性质以来[4],基于QDs的ECL体系不断被发掘,如石墨烯量子点(G QDs)、Si QDs、CdS QDs以及类石墨相氮化碳量子点(g-C3N4QDs)等在ECL分析领域中表现优良的分析性能。QDs独特的光电特性可与ECL分析的高灵敏度特性相结合,将QDs作为发光体材料并用作核酸分析探针的载体,构建ECL生物传感器用于核酸分析的研究正受到人们极大关注。
近年来,基于纳米材料的ECL核酸分析传感器层出不穷,Bertoncello[5]总结了2003年至2008年纳米材料(碳纳米管、金属纳米颗粒、量子点、金属聚合物以及无机金属络合物)在ECL生物传感器中的应用。随后,Rizwan等[6]展示了2014年至2017年新型纳米材料(包括QDs)在ECL生物传感器分析领域的巨大潜力。本文介绍了QDs及其性质并对QDs进行分类,着重论述基于QDs的ECL生物传感器在核酸分析领域的应用。
2 电化学发光
2.1 电化学发光机理
ECL分析是通过电化学的方法在电极表面产生一些特殊的物质,这些物质之间或与其他组分物质之间通过电子传递形成激发态,当激发态物质回到稳定的基态时,伴随着产生化学发光[7]。ECL以线性范围宽、选择性好、检出限低等优势[8],在药物分析[9]、环境卫生[10]、临床医学[11]以及食品安全[12]等领域得到非常广泛的应用。
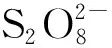
2.2 电化学发光核酸分析传感器概述
众所周知,核酸分为脱氧核糖核酸(DNA)和核糖核酸(RNA)。现代医学认为,基因是DNA分子上具有遗传效应的特定核酸序列的总称,人类疾病都直接或间接与基因有关[15]。其中癌症便是严重危害人体健康的重大疾病之一,几乎所有的癌症都是原癌基因的激活或抑癌基因的缺失所导致。据报道,大量癌组织中存在特定DNA碱基序列的突变,或者microRNA基因的缺失、迁移和扩增[16]。例如p53基因[17]可以抑制肿瘤细胞的生长,它是目前发现最重要的抑癌基因之一。2002年,Pekarsky等[18]首次发现了与癌症相关的miRNA,即miR-15/16-1,并且观察到慢性淋巴细胞白血病患者体内存在miR-15/16-1的缺失。ECL核酸分析传感器通常是以探针DNA分子作为识别元件,将探针DNA特异性识别目标核酸过程中产生的电信号转化为光信号,通过对光信号的分析实现对目标核酸检测的传感方法。ECL核酸分析传感器利用高特异性的探针DNA作为识别元件,具有结构简单、特异性强等优点。近年来,ECL分析技术发展迅猛,不断涌现出各种基于QDs的超高灵敏度的ECL传感器,并在核酸分析领域中得到了广泛应用。通常,与疾病相关的核酸(ctDNA和microRNA等)在人体内含量极低,很难对其进行检测。因此,构建高灵敏的ECL核酸分析传感器,对于人类重大疾病的早期诊断与预后有着重要意义。
3 量子点
3.1 量子点分类
QDs又称为半导体纳米晶,是一种具有优良性能的新型纳米材料,主要由Ⅱ-Ⅵ族和Ⅲ-Ⅴ族元素构成,其直径一般为2~20 nm[19]。QDs以其特殊的尺寸效应以及独特的光电性能,广泛应用于光电器件和生物分析等领域[20]。量子限域效应赋予了QDs独特的光电特性[21]。
QDs按照其组成可分为四种类型:单质QDs、二元QDs、掺杂型复合QDs和核壳型QDs。单质QDs,主要由Ⅳ族元素组成,如碳、硅元素等组成。G QDs和Si QDs作为新型的纳米材料,不仅具有优良的发光性能和小尺寸效应,而且相比于传统QDs具有低毒性、良好的生物相容性、表面易于修饰性的优点,广泛应用于传感器领域。二元QDs主要Ⅱ-Ⅵ族、Ⅲ-Ⅴ族和Ⅳ-Ⅵ族元素组成,主要分为含Cd型QDs和氮基型QDs,如CdS QDs、CdSe QDs、ZnS QDs、BN QDs、CN QDs等。其中,含Cd型QDs研究最为广泛,不仅具有高荧光产率,而且稳定性也比较好。然而传统的含Cd型QDs因其自身的毒性限制了它进一步生物分析应用,于是类似氮化碳这类生物兼容性好、无毒性或低毒性的非金属QDs应运而生。不仅如此,CN QDs和BN QDs等非常易于进行表面修饰,可以有效地改善其光电性能[24]。掺杂型复合QDs通过在QDs晶格内部引入微量的过渡金属离子或非金属元素,形成具有新的优异性能的掺杂型复合QDs。在掺杂元素的选择上,通常采用掺杂N元素、C元素、S元素、Mn元素和Zn元素等方式来改善QDs的结构,从而获得某些独特的光电性质。如ZnS QDs掺杂Mn[25]和G QDs掺杂B[26]等。掺杂型复合QDs可获得特定发光波长[27]。核壳型QDs最初研究的是只有核结构的含Cd型QDs,这类QDs的表面通常会存在大量缺陷,这些表面缺陷会成为非辐射复合中心,严重影响它的量子产率。通常可以通过在QDs核层外覆盖一层晶格结构相似、带隙更大的半导体材料进而大大降低其表面缺陷[28 - 30]。相比于仅有核结构的QDs,壳层半导体材料可以有效减少核层QDs的表面缺陷,从而提高它的稳定性和荧光效率。
3.2 量子点合成及表面修饰
QDs的合成方法主要有电化学沉积法[31]、液相沉积法[32]、气相沉积法[33]、溶剂热法[34]和胶体化学法[35]。在众多方法中,胶体化学法是制备QDs最常用的方法,其合成QDs表面易于进行化学修饰[36]。通常可以将多种有机、无机或生物材料,通过一系列反应修饰到QDs表面。通常用于生物分析的QDs需要具备良好的水溶性和生物相容性,常采用巯基偶联修饰法和两亲性分子修饰法[37],使其表面偶联大量巯基,进而有效的改善它的水溶性。两亲性分子修饰法是将两亲性分子的亲脂端与QDs表面的的三辛基氧化膦(TOPO)连接,聚乙二醇(PEG)是最常用的两亲性分子。
4 量子点在电化学发光核酸传感器的应用
4.1 单质量子点
4.1.1 G QDs近年来,G QDs因具有良好的生物相容性,稳定的发光特性和优良的溶解度在生物传感领域内备受关注。Lu等[38]合成了15.5%的光致发光(PL)量子产率的G QDs,并用于监测DNA损伤。工作中以Au纳米颗粒(Au NPs)与单链DNA探针(cp53-ssDNA)连接形成Au NPs-ssDNA。由于G QDs 和Au NPs之间可以产生电化学发光共振能量转移(ECL-RET),即Au NPs-ssDNA与G QDs的结合以猝灭G QDs的ECL信号。当Au NPs-ssDNA与目标cp53-DNA杂交形成Au NPs-dsDNA时,G QDs 和dsDNA之间的相互作用减弱,G QDs的ECL信号会恢复。从而成功构建了基于G QDs的ECL-RET生物传感器用于检测DNA损伤,方法线性范围为25~400 nmol/L,检出限为13 nmol/L。
DNA多循环扩增技术正受到广泛关注,并且逐渐应用于电化学生物传感器。Jie等[39]将G QDs优良的电化学发光性能与多循环扩增技术相结合,提出了一种用于DNA扩增电化学发光检测的新策略,以Au NPs为猝灭剂并结合核酸内切酶辅助的循环扩增策略,成功构建了一种基于DNA多循环扩增ECL生物传感器。另外,Lou等[40]以G QDs为ECL发光体材料,基于BamHI核酸内切酶的特异性位点,制备了一种双齿螯合新型二硫代氨基甲酸酯DNA探针(DTC-DNA),形成的DTC-DNA通过S-Au-S键直接附着在Au表面。所制备的ECL生物传感器在5 pmol/L至100 pmol/L线性范围内实现了对丙型肝炎病毒1b基因(HCV-1b cDNA)灵敏地检测,检出限低至0.45 fmol/L。
4.1.2 Si QDs2002年,Bard等[4]合成了Si QDs并首次研究了其在有机相中的ECL,但由于合成方面的限制,Si纳米材料并不如碳材料应用广泛。随着量子点合成技术的发展,涌现了各种水相Si QDs[41],使其在生物医学研究方面具有广泛的应用前景。Dong等[42]首次研究了基于Si QDs的ECL生物传感器,制备了具有良好水分散性Si QDs,利用Si QDs为ECL能量供体,Au NPs为能量受体,建立了ECL-RET体系,并以K2S2O8为共反应剂,在磷酸盐缓冲液中获得稳定且强烈的阴极ECL信号。Au NPs连接在发夹DNA的末端以形成信号探针,起初Au NPs与Si QDs之间的距离较近会产生ECL-RET现象,从而导致ECL信号明显降低。当目标DNA与发夹DNA特异性结合时,使得Au NPs与Si QDs之间的距离大幅增加,此时阻止了ECL-RET过程,Si QDs得以恢复ECL信号。实验结果表明,目标DNA浓度在0.1 fmol/L至1.0 pmol/L范围内,ECL信号呈现线性变化,检测限达到0.016 fmol/L。
4.2 含镉型量子点
4.2.1 CdS QDsCdS是一种典型的Ⅱ-Ⅳ族半导体化合物,具有优异的光电转换特性和发光性能,因而广泛应用于电化学分析领域。Zhang等[43]提出了一种新颖的双电位ECL比率型量度传感方法,该方法以CdS QDs和鲁米诺作为两种不同ECL发光体材料,Pt NPs作为猝灭剂,通过将mp53癌基因互补的包含20个碱基的分子信标(MB)固定在CdS QDs/GCE上。然后利用Pt NPs上标记的MB和mp53致癌基因之间的DNA杂交过程将Pt NPs固定在CdS QDs表面上。在电势扫描中CdS QDs的ECL信号会降低,同时鲁米诺的ECL信号会增强,从而构建了一种新的双电势ECL比率型传感器用于检测mp53癌基因。该生物传感器可以在5.0 fmol/L至1 000.0 fmol/L范围内灵敏地检测mp53-DNA,检出限为1.7 fmol/L。
microRNA[44]是近年发现的一类内源性非编码单链RNA,参与调控细胞生长、发育、凋亡等重要生物过程,研究发现microRNA-21在肿瘤的发展过程中均出现明显上升趋势。Li等[45]基于局部表面等离振子共振(LSPR)增强的电化学发光机制,以CdS QDs作为ECL发光体材料,并利用直径为15 nm的Au纳米二聚体(GNP)诱导CdS QDs发生猝灭,同时在等离子体耦合诱导和大电磁场影响下,CdS QDs的ECL强度增强约6.3倍。在最佳实验条件下,制备了一种LSPR-ECL传感器用于microRNA-21的检测,方法线性范围从10 fmol/L到20 fmol/L,检出限为3.6 fmol/L。
4.2.2 CdTe QDsCdTe QDs具有良好的化学稳定性和表面易修饰性,已被广泛用作电化学发光分析。Chen等[46]基于CdTe QDs和Au NPs之间ECL-RET效应,制备了一种ECL生物传感器用于检测乳腺癌生物标志物20-mer microRNA。该传感器在microRNA浓度为0.1 fmol/L至0.2 pmol/L具有线性响应,检出限低至33 amol/L。另外,Liu等[47]基于多色CdTe QDs和Au NPs构建新型多重ECL的DNA传感器,用于检测乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)。分别将HBV固定到CdTe QDs(551),HCV固定到CdTe QDs(607)。然后引入不同浓度的目标DNA-HBV和DNA-HCV与互补的CdTe QDs-capture DNA杂交。再将Au NPs-probe DNA-HBV和Au NPs-probe DNA-HCV修饰到玻碳电极上。通过观察Au NPs-probe DNA/target DNA/CdTe QDs-capture DNA/GNs/GCE复合膜的ECL信号强度,可以实现目标DNA-HBV和DNA-HCV的测定。在最佳条件下,CdTe QDs(551)和CdTe QDs(607)的ECL强度与目标DNA(HBV)和DNA(HCV)的浓度在0.0005 nmol/L至0.5000 nmol/L,以及0.001 nmol/L至1.000 nmol/L范围内具有良好的线性关系,检出限分别为0.082 pmol/L和0.340 pmol/L。该ECL的DNA传感器用于测定人血清样品中的目标DNA(HBV)和DNA(HCV),其结果表现较为满意。
4.2.3 CdSe QDsCdSe QDs的可调节发射波长和宽吸收光谱使其成为ECL-RET的优异活性供体或受体材料。最近,Jie等[48]首次报道了以CdSe QDs为ECL发光体材料,叶酸为猝灭剂,并结合循环扩增技术,制备了ECL-RET生物传感器用于目标DNA检测。实验显示,该传感器ECL信号变化与目标DNA浓度在0.05 nmol/L至1 000.00 nmol/L范围呈线性关系,检出限为0.05 nmol/L。另外,超歧化的三维聚酰胺基(PAMAM)树状聚合物由于末端基团众多,并且具有高度化的对称结构以及三维纳米尺寸使其具备特殊的物理化学性质。因此,PAMAM被广泛应用于化学和生物领域。Tan等[49]设计了一种独特的酶辅助多重扩增式ECL生物传感器,利用CdSe QDs作为ECL信号探针,合成了具有良好生物相容性和导电性的新型聚合物Au NPs-PAMAM材料用于负载大量CdSe QDs。当目标DNA存在时,可以激活酶辅助的聚合链置换循环反应,同时打开大量的发夹(HP)DNA模板。随后,被打开的HP-DNA茎部进一步与电极上的capture-HP-DNA进行杂交反应,并且Au NPs-PAMAM-CdSe QDs与HP-DNA的茎部杂交,以触发第二个聚合反应。因此,大量的CdSe QDs可以组装到电极上,产生扩增ECL信号,用于检测目标DNA。ECL信号随着目标DNA浓度增加而逐渐增加,线性范围为10.0 pmol/L至1 000.0 nmol/L,检出限为3.5 pmol/L。
4.3 氮基型量子点
4.3.1 类石墨相氮化碳量子点类石墨相氮化碳量子点(g-C3N4QDs)是一种新型半导体材料,由C和N组成,它与石墨烯具有类似的结构,但性质却大不相同。最近,基于C基的的QDs已经广泛应用于生物医学分析领域[50],但是由于C和G QDs的量子产率较低,限制了其进一步的应用。g-C3N4QDs由于其特殊的晶体结构,具有良好的水分散性、高的荧光量子产率和强的电化学发光活性[51]。不仅如此,相比于传统的含Cd型量子点,g-C3N4QDs的生物毒性低并且更加绿色环保。Wang等[52]以g-C3N4为发光体材料,K2S2O8为共反应剂,制备了一种高灵敏度的ECL生物传感器用于目标DNA(T-DNA)的检测。该传感器的ECL强度与目标DNA浓度的对数在0.04 fmol/L至50 pmol/L范围内呈线性关系,检出限低至0.018 fmol/L。随后,Liu等[53]使用K2S2O8为共反应剂,在磷酸盐缓冲溶液中观察到g-C3N4QDs发射强烈的ECL信号。以g-C3N4QDs为供体,Au NPs为受体建立了ECL-RET体系。Au NPs 与发夹DNA(Hai-DNA)形成信号探针,再将信号探针固定在g-C3N4QDs上,此时,Au NPs 会猝灭g-C3N4QDs的ECL信号。当引入T-DNA时,T-DNA可以破坏Hai-DNA的环状结构,并从g-C3N4QDs中分离出Au NPs。因此,阻碍了ECL-RET效应,g-C3N4QDs能够再次恢复ECL信号。实验显示。ECL信号强度与T-DNA浓度的对数在0.02 fmol/L至0.10 pmol/L范围内呈线性相关,检出限达到0.01 fmol/L。该ECL生物传感器显示出良好的选择性和高灵敏度。
4.3.2 BN QDsBN QDs与g-C3N4QDs结构似,具有独特的物理性质,如高导热性。良好光电特性和优异的化学稳定性[54]。目前,基于BN QDs的传感研究报道较少,其很多ECL性质还未得到充分利用。最近,Liu等[55]报告了一种基于BN QDs为ECL发光体材料构建较高ECL性能的传感器新策略。分别以H3BO3和三聚氰胺为B源和N源,同时利用硫脲和L-半胱氨酸调节BN QDs的性能,合成了两种稳定性良好的S-BN QDs。此外,设计了一种双波长SPC-ECL比率型生物传感器用于肿瘤组织中BRAF基因进行检测。其中,S-BN QDs535nm作为参考项,S-BN QDs620nm作为分析项,另外引入两个发夹DNA(H1-DNA和H2-DNA)。首先,用H1-DNA捕获BRAF基因,H1-DNA变为直链结构后,暴露的序列部分进一步与H2-DNA杂交。因为直链结构化的H1-H2-DNA双链体比H1-DNA-BRAF更稳定,所以BRAF基因从H1-H2-DNA双链体中被替代。在下一个循环中,释放的目标DNA再次被H1-DNA捕获。结果部分BRAF基因会导致大量H1-H2-DNA双链体被固定在电极上。当H2-DNA与Au NPs相连接时,在Au NPs 附近的S-BN QDs620nm发生ECL-RET效应。产生表面等离激元耦合ECL效应从而实现了ECL信号的连续放大。该SPC-ECL生物传感器的ECL信号与BRAF浓度在1.0 pmol/L至1.5 nmol/L范围呈线性相关,检出限为0.3 pmol/L。
4.4 掺杂型复合量子点
由于QDs具有突出的量子限域效应,通过掺杂过渡金属离子或非金属元素可以有效地改善QDs的一些表面特性,从而产生新的现象和独特的性质[56]。近年来,研究者们进行掺杂时采用最普遍的是N元素,另外S元素、B元素、Zn元素也是关注的热点。
Liu等[57]以BN QDs为ECL发光体材料,并引入S元素,所制备的S-BN QDs具有良好的ECL活性,同时采用非金属等离子体MoS2纳米片用于增强S-BN QDs的ECL信号强度。所制备的ECL生物传感器用于检测丙型肝炎病毒(HCV),线性范围为0.5 pmol/L至1.0 nmol/L。检出限为0.17 pmol/L。此外,Zhang等[26]通过在G QDs内部掺杂B元素,形成了具有中心六角孔的准平面结构的硼簇石墨烯量子点(BG QDs)。通过透射电子显微镜(TEM)、光致发光(PL)光谱和紫外(UV)光谱表征表明,BG QDs与G QDs的平面晶格间距一致,并具有良好的发光性能。成功制备了以BG QDs作为发光材料的ECL生物传感器用于检测肿瘤标志物microRNA-20a,ECL信号与microRNA-20a在0.1 pmol/L至10 000.0 pmol/L浓度范围内呈线性相关,检出限为0.1 pmol/L。该ECL生物传感器为肿瘤标志物的检测提供了一个高灵敏度且简易的平台。
ECL生物传感器的高灵敏度和低检出限一直是研究者关注的热点。Wang等[58]将制备好的CdS/ZnS QDs掺入聚乙烯亚胺(PEI),并利用水热法合成了Au NPs修饰的MoS2用来猝灭CdS/ZnS QDs的ECL信号。该ECL-DNA传感器在目标DNA浓度为0.05 fmol/L至1 000.00 fmol/L范围内实现超灵敏测定,检出限低至0.023 fmol/L。另外,Liu等[59]以掺杂大量N元素的N-C QDs作为ECL发光体材料,并结合酶Nb.BbvCl介导的信号放大技术(NESA),开发了一种用于检测microRNA的超灵敏ECL生物传感器。首先,发夹探针1-N-C QDs与辅助探针和microRNA形成Y型连接结构。随后,释放的microRNA和辅助探针可以启动下一个回收过程。大量的N-C QDs-DNA的产生可以进一步与固定在GO/Au表面的发夹探针2杂交,增强了ECL信号强度。ECL强度将随着目标microRNA浓度的增加而增加。该ECL生物传感器设计新颖,microRNA浓度在10 amol/L至10 000 fmol/L范围内呈线性相关,检出限达到10 amol/L。该ECL生物传感器在临床诊断中具有潜在的应用前景。
4.5 核壳型量子点
通常实验室所制备核型QDs的表面有大量的缺陷,可能发生电荷的无辐射重组现象,进而严重影响量子产率。然而这是可以通过化学方式来改善QDs表面缺陷,特别是在其表面覆盖另一层晶体结构相似,带隙更大的半导体材料,从而获得性能更为优异的核@壳结构型QDs[60,61]。Zhang等[62]制备了一种具有高效ECL性能的核壳型QDs。首先,将Au NPs封装到固体SiO2核中,形成Au NPs@SiO2型核壳结构。其次,将g-C3N4QDs嵌入SiO2壳(mSiO(2))孔中以形成Au NPs@C3N4QDs@mSiO(2)型纳米球,并以K2S2O8为共反应剂进行ECL反应,对比仅使用g-C3N4QDs的ECL反应,ECL信号强度增强了3.8倍。最后,将Au NPs@C3N4QDs@mSiO(2)连接到探针DNA上,此时Au NPs@C3N4QD@mSiO(2)@-Probe DNA的ECL信号最强,当引入目标DNA时,目标DNA与探针DNA发生碱基互补配对,Au NPs-@C3N4QDs@mSiO(2)会远离电极表面,ECL信号会大幅减弱,所制备的ECL生物传感器用于检测大肠杆菌(STEC)基因,实验显示ECL信号与STEC在0.1 pmol/L到1.0 nmol/L浓度范围内呈线性相关,检出限为9 fmol/L。并成功应用于人血清中STEC基因的超灵敏测定。肝细胞癌(HULC)是世界上最常见的癌症之一,每年导致大量人死亡[63],对于肝癌的早期诊断具有重要意义。Li等[64]合成了核壳型纳米结构Au@Ag,并与G QDs结合作为ECL发光体材料。所制备的Au@Ag-G QDs有效增强了G QDs发光强度,成功构建了高灵敏度ECL生物传感器用于检测肝癌(HULC)。该ECL生物传感器的ECL信号与lncRNA浓度在1 fmol/L到5 nmol/L范围内呈线性相关,检出限为0.3 fmol/L。
本文所论述的ECL核酸分析传感器的相关信息全部总结如表1所示。

表1 基于量子点的电化学核酸传感器Table 1 Quantum dots based elcctrochemiluminescent nucleic acid sensor
5 总结与展望
恶性肿瘤是引起全球死亡率上升的主要原因之一,已经严重威胁人类健康和社会发展。当前,癌症的诊断主要依靠观察病人的症状、病史以及结合影像学技术进行,但是由于癌症起病隐匿并且相关症状并不明显,很容易造成误诊和漏诊,当前技术对于癌症的早期快速准确诊断仍存在很大的不足。研究表明,核酸与癌症的发生密切相关,大量癌组织中存在特定DNA碱基序列的突变或者microRNA基因的异常表达。通常,与之相关的ctDNA或microRNA在人体内浓度极低,因此,有必要开发超灵敏的分析方法用于检测人体内微量核酸。量子点因其特殊的尺寸效应和独特的光电性质,使其在电化学发光领域内有了深入的发展与应用。但同时也面临一些诸如量子点表面缺陷、生物毒性、工作电位较高等很多实际问题。
电化学发光核酸分析技术的发展离不开新发光体系的设计与制备,发掘高发光效率、高稳定性能以及低毒性量子点显得尤为重要。基于量子点的电化学发光分析技术,因具有灵敏度高和特异性强等优势,为核酸分析的发展提供了一个新平台。目前,市面上家用血糖仪基本上都是采用电化学法进行检测,通过记录试纸片上的酶与血液中葡萄糖反应产生的电子数量,再转化为葡萄糖浓度读数。因此,研发类似便携式的家用血糖仪以及兼备灵敏度高、检出限低的电化学发光核酸分析传感器,这对于人类重大疾病的早期诊断与预后有着无与伦比的意义。

