人肝癌Bel-7402细胞及Bel-7402/5-FU细胞的N-连接聚糖的差异分析
熊思元, 张智慧, 高文杰*, 刘 欣*
(1.华中科技大学生命科学与技术学院,湖北武汉 430074;2.武汉洪山区疾病预防控制中心,湖北武汉 430064)
2019年发布的最新全国癌症报告数据显示,肝癌已经成为我国第四大常见癌症,而其死亡率位于所有恶性癌症的第二位[1]。尽管肝癌的诊断和治疗技术有了长足的发展,肝癌病人的5年存活率依然不尽人意。对于肝癌的治疗,不管是手术还是化疗都容易复发。而在化疗过程中,肝癌细胞产生耐药性是影响化疗结果的重要因素,这会因肝癌细胞抵抗化疗药物而导致化疗的失败。因此,如何解决肿瘤细胞的耐药性已经成为其治疗过程中的关键问题。肿瘤细胞耐药的产生包括多种复杂的机制,主要集中在:膜转运蛋白高表达而增加抗癌药物的外排;增强损伤DNA自我修复能力;细胞内某些受体数量及其功能的改变等[2]。虽然国内外的研究者进行了很多的探索,但仍未完全了解其中的机理。
糖基化是最常见且复杂的蛋白质翻译后修饰之一。在真核生物细胞中,有超过50%的蛋白质发生了糖基化修饰[3]。蛋白质的糖基化修饰在生物体的生命活动中发挥着多种功能,例如细胞信号转导,免疫识别,病原体感染等[4 - 8]。近年来细胞N-连接聚糖与肿瘤耐药的相关性研究日益引起人们的关注。Kudo等[9]首次报道了肝癌耐药细胞与其亲本细胞中N-连接聚糖的差异分析,研究结果显示:与母本细胞相比,耐药细胞中GnT-V表达下降,三支天线的N-连接聚糖增加,预示N-聚糖与肝癌细胞耐药具有一定相关性。
由于糖蛋白N-连接聚糖具有多样性及微观不均一性的特点,加之糖蛋白在总蛋白中的丰度很低,这些因素都增加了聚糖分析和表征的难度。质谱因其高灵敏度和高准确性的特点被广泛应用于糖蛋白聚糖的分析。然而,聚糖的多羟基带来的亲水特性使其在质谱分析时的离子化效率较低,并且在分析带唾液酸的聚糖时会因为源内解离或源后解离,而给聚糖的完整分析带来一定困难。因此,对聚糖进行化学衍生是常用的提高聚糖检测灵敏度的手段。
本文通过以Bel-7402细胞和其耐药株Bel-7402/5-FU细胞为研究对象,使用本课题组开发的快速PNGase F酶切,结合TMPP-Ac-OSu和甲胺化共衍生方法,比较了两者的总蛋白和分泌蛋白的N-连接聚糖的差异性,为进一步探索肝癌细胞耐药的诊断提供糖链标志物起到一定的参考作用。
1 实验部分
1.1 仪器与试剂
TOF/TOF5800基质辅助激光解吸电离质谱仪(美国,Sciex公司);Triple TOF 5600液相色谱-电喷雾质谱联用仪(美国,Sciex公司)。
Bel-7402肝癌细胞和耐5-FU的Bel-7402/5-FU肝癌细胞由本实验室培养。(N-琥珀酰亚胺基氧代羰基甲基)三(2,4,6-三甲氧苯基)溴化膦(TMPP-Ac-OSu)、α-氰基-4-羟基肉桂酸(CHCA)、5-氟尿嘧啶(5-FU)购买自美国Sigma公司;乙腈、甲醇购买自美国TEDIA公司;十二烷基-β-D-麦芽糖苷(DDM)购买自上海阿拉丁生化科技有限公司;RIPA裂解液购买自上海碧云天生物技术有限公司;N-糖酰胺酶F(PNGase F)购买自江苏愚公生命科技有限公司;其他分析纯试剂购买自上海国药集团化学试剂有限公司。
1.2 细胞培养
Bel-7402和Bel-7402/5-FU均在含10%(V/V)胎牛血清,以及100 U/mL双抗的RPMI-1640培养基中,于37 ℃、5%CO2的细胞培养箱培养,不同的是Bel-7402/5-FU在培养基中要加入终浓度为10 μg/mL的5-FU以维持其耐药性。
1.3 细胞蛋白抽提
1.3.1 细胞总蛋白抽提向收集的细胞中加入200 μL冰的RIPA裂解液,轻微混悬之后在4 ℃下孵育15 min,然后用超声破碎仪在冰上进一步破碎。用转速为15 000 r/min的高速离心机对细胞裂解液离心5 min,取上清液溶用于细胞总蛋白的抽提。使用有机溶剂沉淀法对细胞总蛋白进行抽提[10]。
1.3.2 分泌蛋白细胞培养到约70%覆盖度时,换掉带血清的培养基,并用1 mL无血清培养基洗5次,接着加入5 mL的无血清培养基培养24 h。将含有分泌蛋白的无血清培养基移入到10 mL离心管中,用低温高速离心机,于4 ℃下6 000 r/min离心10 min去掉细胞碎片。最后小心将上清液转移到50 mL离心管中,同样用有机溶剂沉淀法对分泌蛋白进行抽提。
1.4 快速酶切及TMPP-Ac-OSu和甲胺化共衍生
N-聚糖的酶切和衍生使用本课题组之前提出的方法[11,12]。向抽提得到的细胞蛋白中加入50 μL含1%DDM,50 mmol/L DTT和0.1%SDS的50 mmol/L HEPES缓冲溶液(pH=8.0)。混匀后在100 ℃下煮沸2 min使蛋白质变性,之后冷却到50 ℃。然后向上述混合溶液中加入1.0 μL的PNGase F,并且在50 ℃下反应5 min。向上述溶液中加入50 μL用乙腈溶解的现用现配的TMPP-Ac-OSu,在40 ℃下反应20 min。纤维素柱纯化,洗脱液旋蒸后进行甲胺化衍生,继续过纤维素柱纯化除盐。
1.5 质谱检测
1.5.1 基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)分析制备好的样品溶于10 μL 50%甲醇溶液,取0.5 μL样品与0.5 μL 10 mg/mL的CHCA溶液(溶于70%乙腈中)混合后点到靶板上,待样品干燥后进行检测。仪器相关参数设置如下:检测模式:正离子反射模式(Reflector Positive);加速电压:20 kV;激光强度:5 000;扫描范围:m/z1 000~5 000。数据由软件Data Explore 4.5解析。
1.5.2 纳升液相色谱-电喷雾电离质谱(NanoLC-ESI-MS/MS)分析纳升液相色谱-电喷雾电离质谱仪由Analyst进行系统控制,质谱的电离模式为正离子模式;电喷雾的电压设定为2 300 V;去簇电压为100 eV;接口温度为150 ℃。一级质谱的扫描范围:m/z400~2 000,电荷数范围:2~5,母离子的积累时间:0.25 s。母离子中丰度最高的5个离子用于后续的二级质谱检测。二级质谱的扫描范围:m/z100~2 000;检测模式为IDA(Information Dependent Acquisition),四极杆碰撞池能量为40 eV,积累时间为0.1 s。数据由软件Peakview1.2解析。
2 结果与讨论
2.1 细胞形态学差异
使用光学显微镜对两种细胞在形态学上的差异进行了分析。Bel-7402细胞呈不规则多边形,明显的上皮样细胞形态。而Bel-7402/5-FU细胞的形态与之有明显不同,呈分片样,棱角减少且往梭形样发展,细胞质清亮,折光性增强,有些细胞有细长的伪足状结构。
2.2 NanoLC-ESI-MS/MS糖型鉴定
使用NanoLC-ESI-MS/MS对本文中检测到的N-连接聚糖进行结构鉴定,并推测可能的糖型结构。图1所示为糖型质荷比为m/z937.34[M+3H]3+和m/z1 042.40[M+3H]3+的二级质谱图,分别对可以确定糖型结构的二级诊断离子用绿色数字进行了标注。如图1(a)二级质谱图所示,305为唾液酸甲胺化衍生后的碎片离子,可以推测出该糖型中含有唾液酸;m/z512、674、1 977和1 252(+2)碎片离子,推测出该糖型中含有非核心岩藻糖存在;m/z1 466和1 628碎片离子推测出该糖型中还含有1个核心岩藻糖,进而推测出可能的糖型结构为[Hex]5[HexNAc]4[NeuAc]1[Fuc]2。
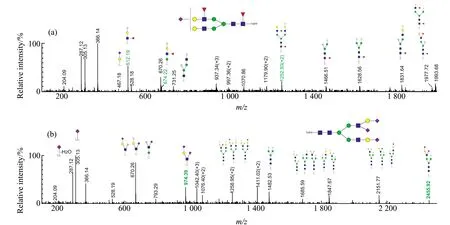
图1 细胞中典型的N-连接聚糖二级质谱图。(a)为m/z937.34[M+3H]3+,推测糖型为[Hex]5[HexNAc]4[NeuAc]1-[Fuc]2的二级质谱图;(b)为m/z1042.40[M+3H]3+,推测糖型为[Hex]5[HexNAc]4[NeuAc]3的二级质谱图。Fig.1 Typical MS/MS spectra of the derivatized N-glycans from cells.(a)NanoLC-ESI-MS/MS spectrum of m/z937.34[M+3H]3+ with the composition of [Hex]5[HexNAc]4[NeuAc]1[Fuc]2;(b)NanoLC-ESI-MS/MS spectrum of m/z 1042.40[M+3H]3+with the composition of [Hex]5[HexNAc]4[NeuAc]3.
表1所列为本文中鉴定到的可能的所有糖型及其对应的分子量。

表1 本文中使用MALDI-MS鉴定到的N-连接聚糖Table 1 N-glycans detected in this article by MALDI-MS
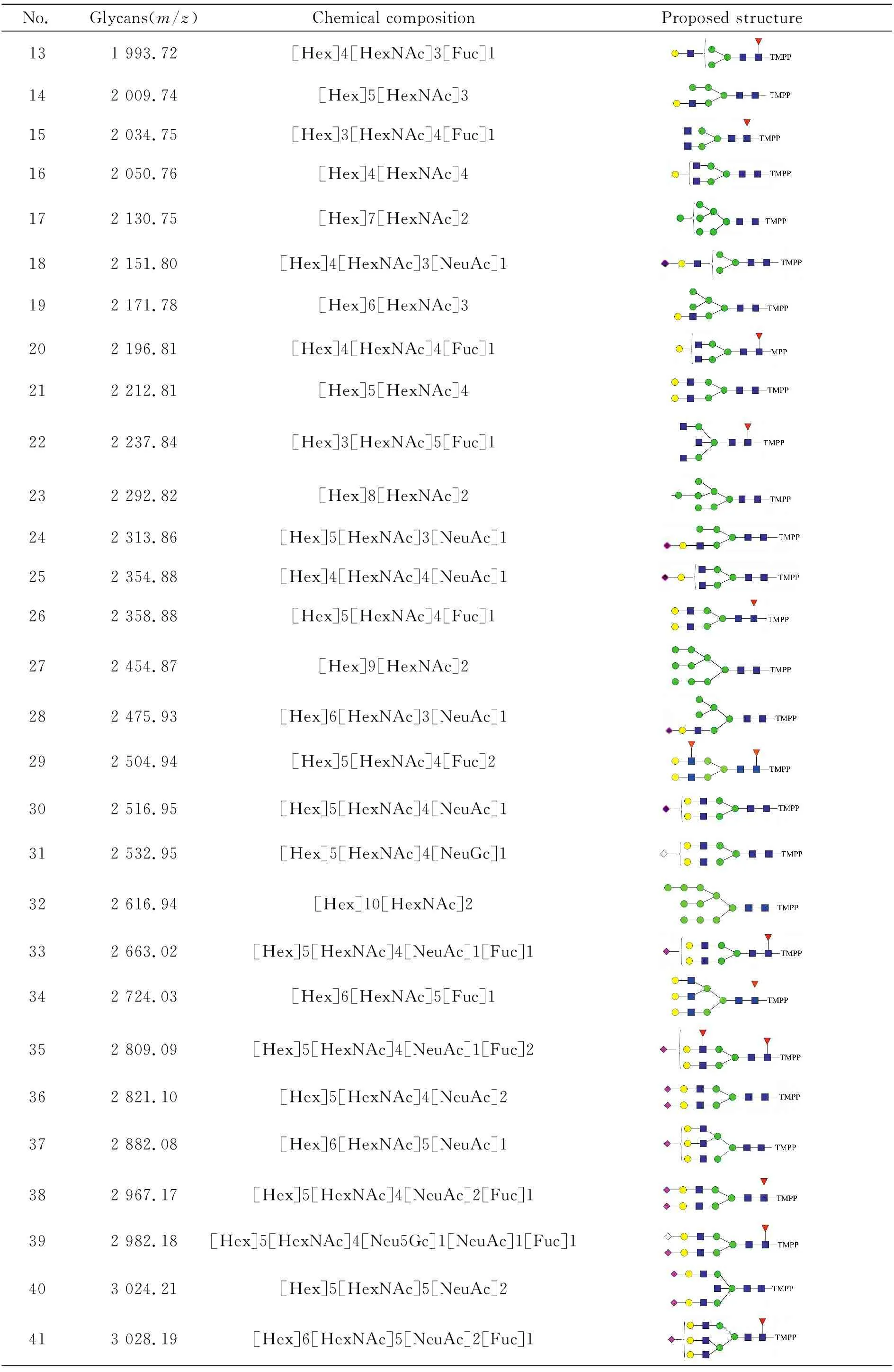
(续表1)

(续表1)
2.3 Bel-7402和Bel-7402/5-FU细胞总蛋白N-连接聚糖分析
为了提高细胞聚糖检测的灵敏度,采用本课题组开发的PNGase F快速酶切,结合TMPP-Ac-OSu和甲胺化共衍生的方法[10,11]。图2为Bel-7402和Bel-7402/5-FU两种细胞总蛋白N-连接聚糖典型的MALDI质谱图。使用约105个细胞,即可从两种细胞总蛋白中共检测到56种N-连接聚糖。
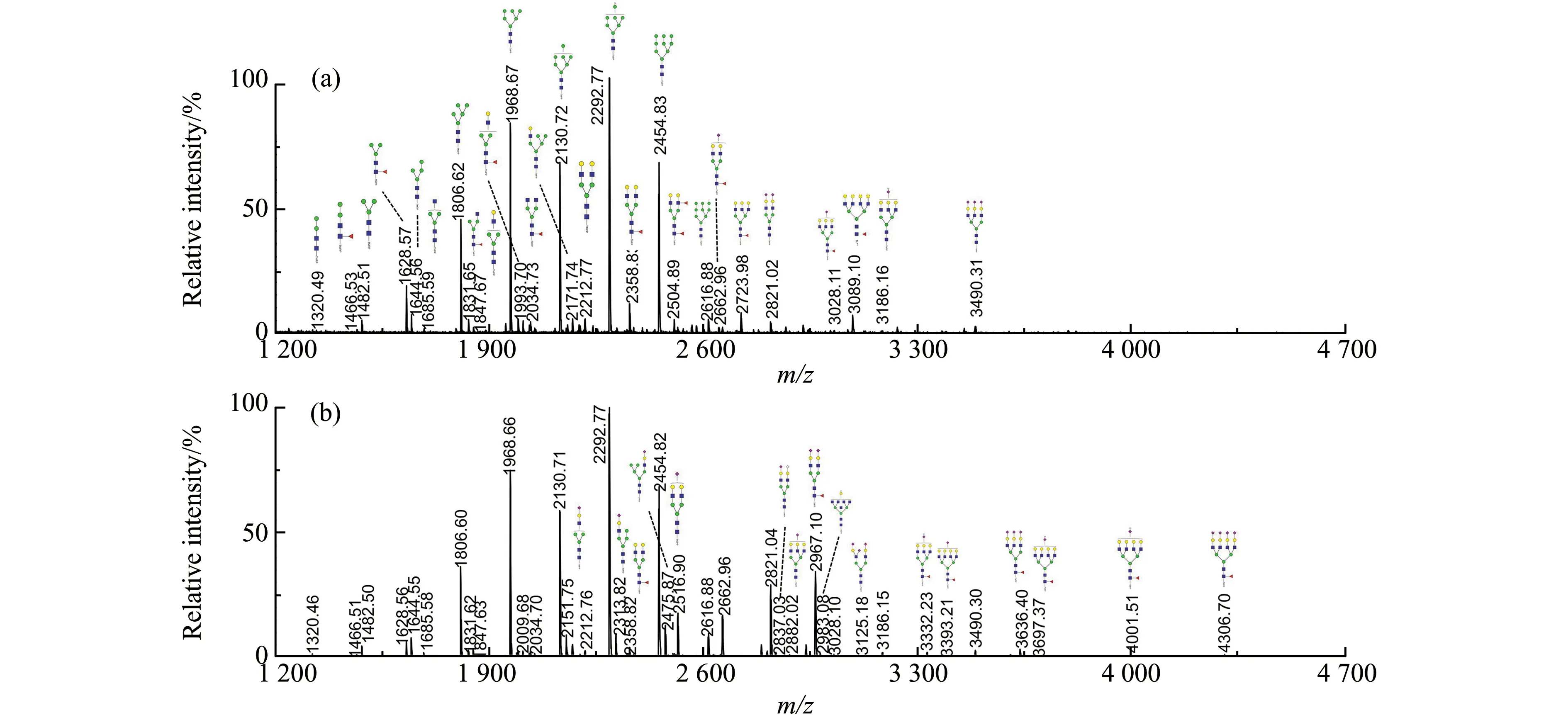
图2 Bel-7402(a)和Bel-7402/5-FU(b)细胞总蛋白N-连接聚糖的MALDI质谱图Fig.2 MALDI mass spectra of cell total protein N-glycan profiling from Bel-7402(a) and Bel-7402/5-FU(b)
在比较两种细胞总蛋白N-连接聚糖的差异之前,将所有糖型的信噪比进行归一化处理,得到每个糖型在两种细胞中的相对比例,结果如图3(a)所示。为了比较三种细胞糖型在大的分类上的差异,将检测到的糖型归类为高甘露糖型、杂合型、复杂型和寡甘露糖型。Bel-7402细胞和其5-FU耐药细胞总蛋白N-连接聚糖在这四类糖型中的比例分别是73.38%±1.13% vs 63.32%±1.24%;14.84%±0.94% vs 24.31±1.05%;4.65%±0.28% vs 7.13%±0.21%和7.13%±0.58% vs 5.24%±0.31%。从图3(b)中可以看出,高甘露糖型N-聚糖在两种细胞的总糖谱中都占了很大的比例。此外,还对含有较大差异的高甘露糖和岩藻糖化复杂糖中的单个糖型进行了逐一比较,结果如图3(c)和3(d)所示。在Bel-7402细胞中,Man5-10GlcNAc2五种糖型的相对比例都比耐5-FU的Bel-7402细胞要高,这是之前文献中没有报道过的。而在核心岩藻糖化的复杂糖中,文献报道多分支核心岩藻糖在耐药细胞中的比例明显增加,这与本文的结果相一致[12,13]。除此之外,还发现两分支的岩藻糖化糖型在Bel-7402细胞中的相对比例比在5-FU耐药的Bel-7402细胞高。
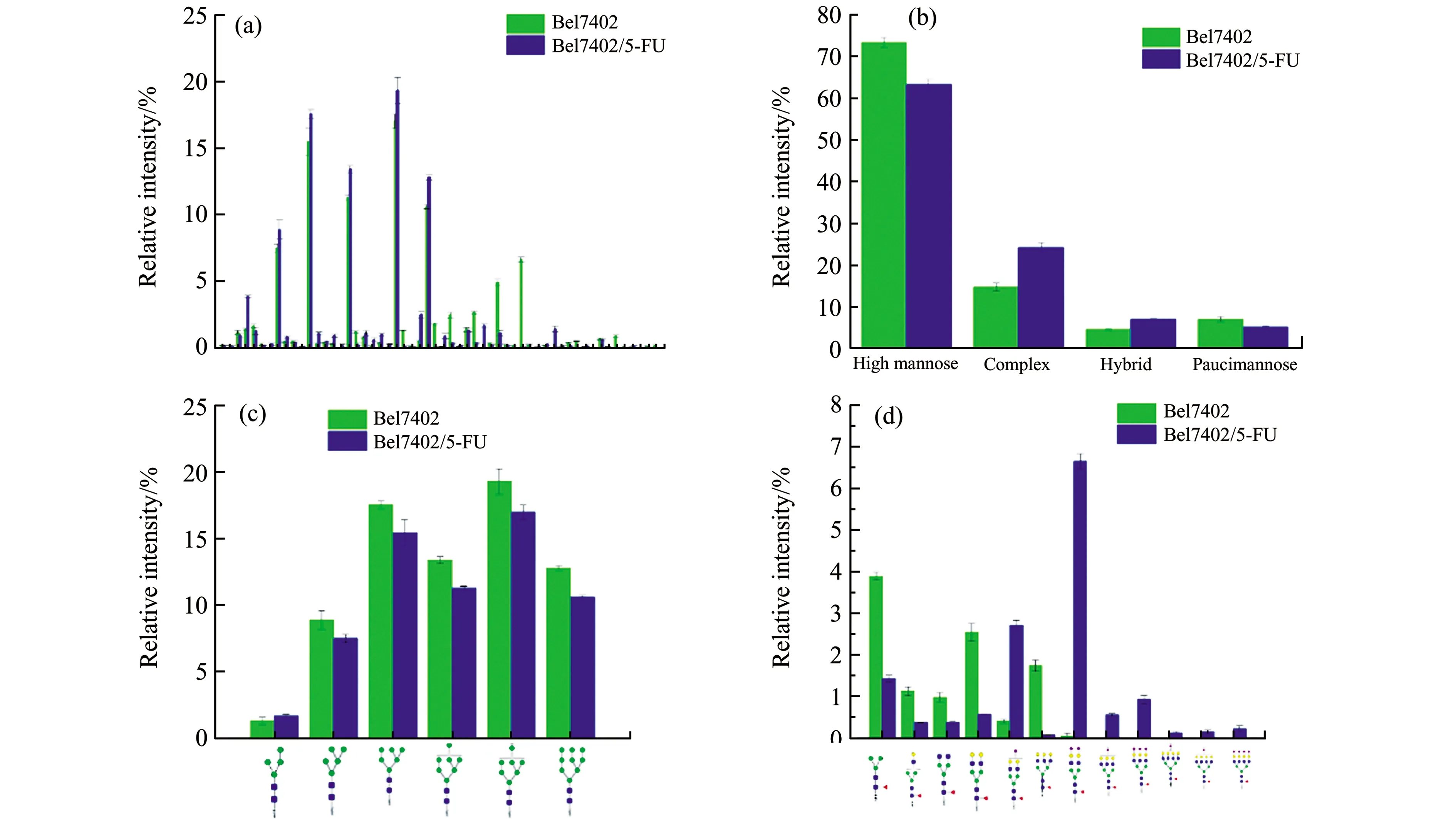
图3 Bel-7402和Bel-7402/5-FU细胞总蛋白中N-连接聚糖的差异分析。(a)为所有糖型;(b)为不同大类糖型;(c)单个高甘露糖型比较;(d)为核心岩藻糖化糖型在两种细胞总蛋白N-连接聚糖中的差异分析。Fig.3 Differential analysis of N-glycans from total proteins between Bel-7402 and Bel-7402/5-FU cells.The difference in total N-glycans(a),four types(b),single high mannose(c)and core-fucosylation N-glycans(d) of two cell lines.
2.4 Bel-7402和Bel-7402/5-FU细胞分泌蛋白N-连接聚糖分析
细胞分泌蛋白是生物活性糖蛋白的一个重要来源,分析细胞分泌蛋白的糖谱为科研工作者研究蛋白质糖基化与肿瘤耐药之间的关系提供了机会。通过对5 mL无血清培养细胞24 h后得到的分泌蛋白进行蛋白浓度测定,得到分泌蛋白约为30 μg。这一数值比之前文献报道的分泌蛋白浓度偏高[14]。可能的原因是肝脏是代谢旺盛的器官,因而肝细胞分泌蛋白的量更多一些。图4所示为两种细胞分泌蛋白N-聚糖的MALDI质谱图,共检测到38种N-连接聚糖。
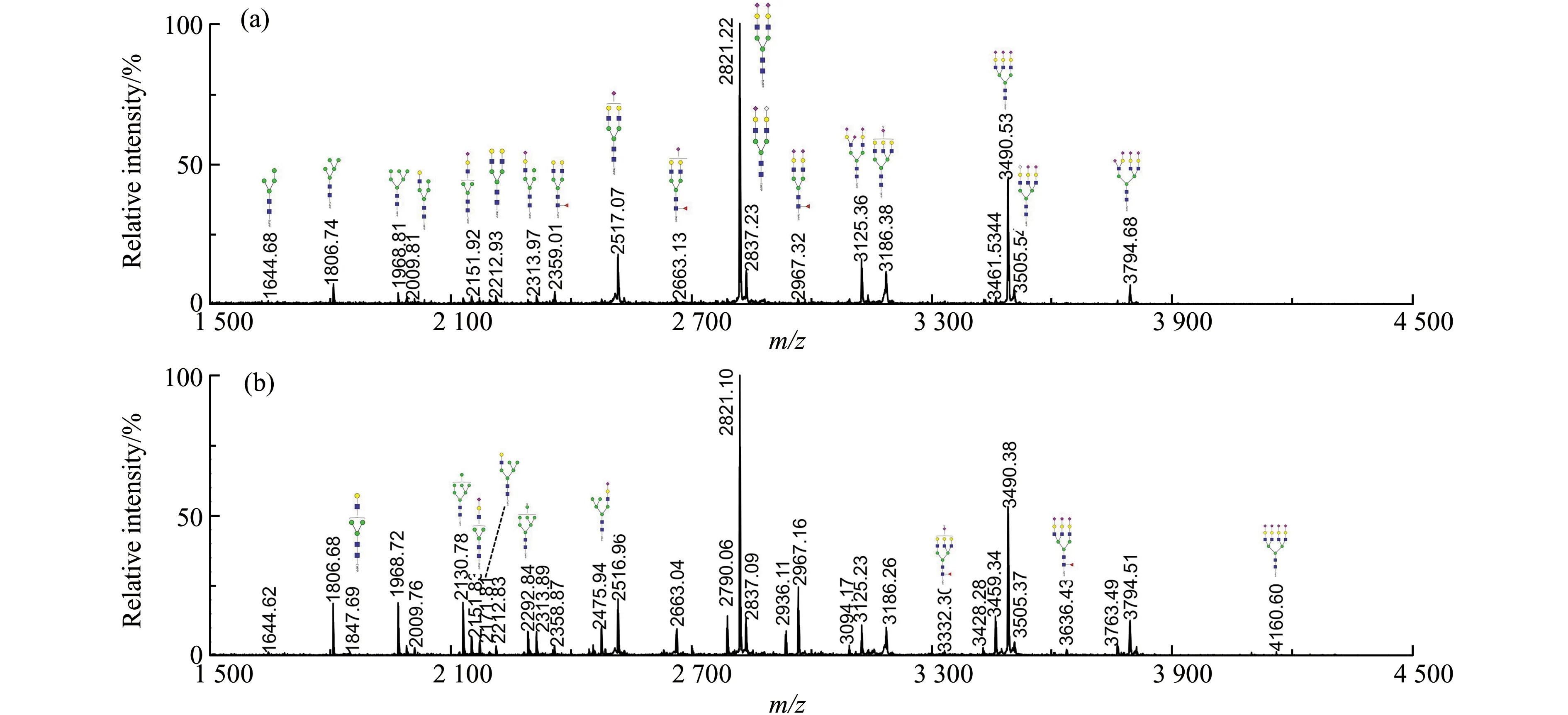
图4 Bel-7402(a)和Bel-7402/5-FU(b)细胞分泌蛋白N-连接聚糖的MALDI质谱图Fig.4 MALDI mass spectra of cellsecreted protein N-glycan profiling from Bel-7402(a) and Bel-7402/5-FU(b)
与细胞总蛋白N-连接聚糖分析相同,将分泌蛋白中所有糖型的信噪比进行归一化处理,得到每个糖型在两种细胞中的相对比例,结果如图5(a)所示。同样,将Bel-7402细胞和其5-FU分泌蛋白中检测到的糖型归类为高甘露糖型、杂合型、复杂型和寡甘露糖型。这四类糖型中在Bel-7402细胞和Bel-7402/5-FU中的比例分别是23.87%±1.57% vs 6.76%±0.54%;64.75%±1.41% vs 88.07±0.63%;10.75%±0.08% vs 4.92%±0.65%和0.62%±0.23% vs 0.23%±0.17%。从图5(b)可以看出,与细胞总蛋白N-连接聚糖糖谱不同,细胞分泌蛋白的糖谱以带唾液酸的复杂型聚糖为主,这与人血清中的N-连接聚糖糖谱类似,从侧面说明了血清中蛋白多由细胞分泌到血液中。而细胞分泌蛋白中的高甘露糖型聚糖变化情况与细胞总蛋白相反,在5-FU耐药细胞中显著增加(图5(c))。此前有文献报道,耐药细胞分泌蛋白中的核心岩藻糖化N-连接聚糖相比与母本细胞的比例显著增加[9,13],本文亦得到了相同的结论(图5(d))。
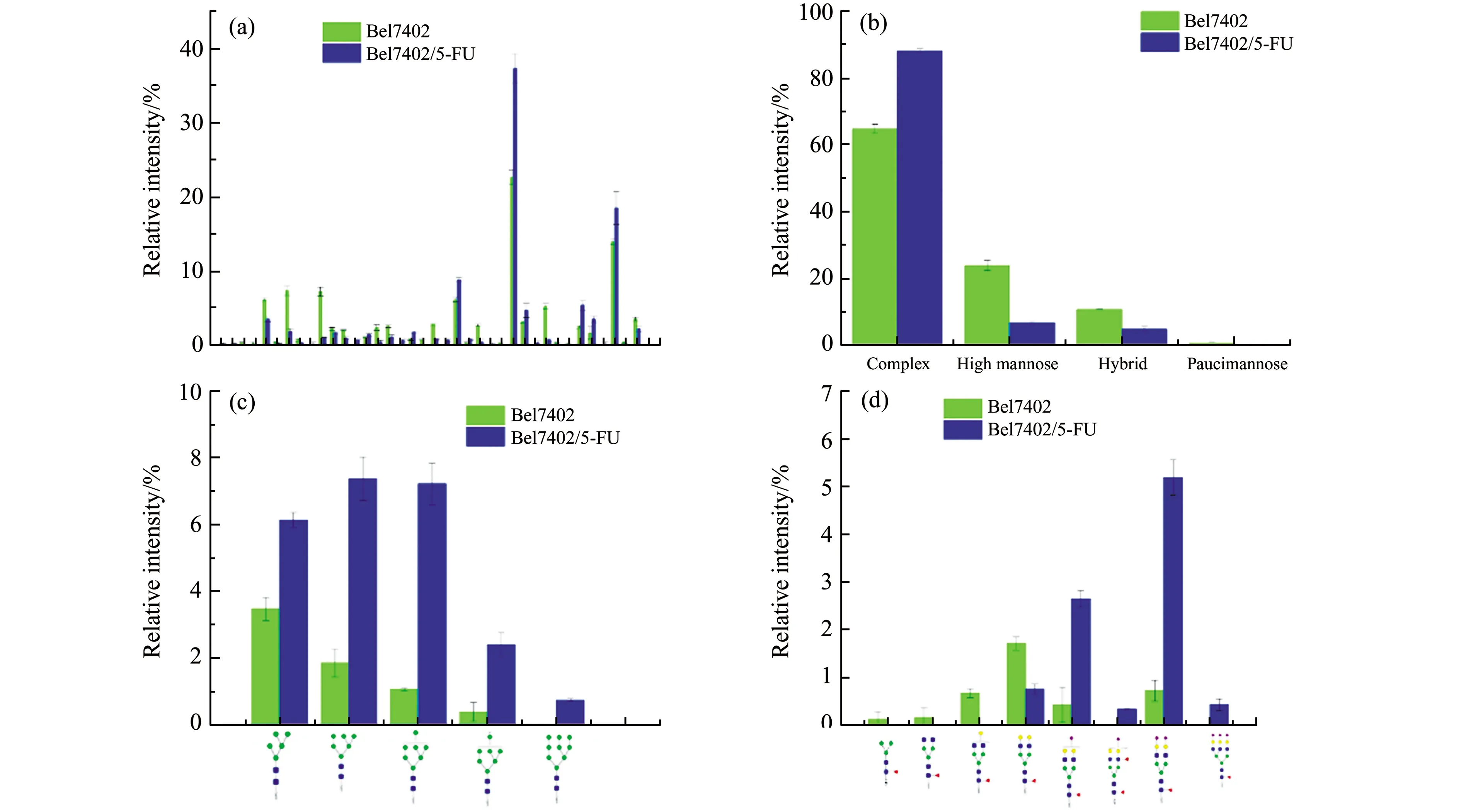
图5 Bel-7402和Bel-7402/5-FU细胞分泌蛋白中N-连接聚糖的差异分析。(a)为所有糖型;(b)为不同大类糖型;(c)单个高甘露糖型比较分析;(d)为核心岩藻糖化糖型在两种细胞总蛋白N-连接聚糖中的差异分析。Fig.5 Differential analysis of N-glycans from secreted proteins between Bel-7402 and Bel-7402/5-FU cells.The difference in total N-glycans(a),four types(b),single high mannose(c)and core-fucosylation N-glycans(d) of two cell lines.
3 结论
使用快速PNGase F酶切,结合TMPP-Ac-OSu和甲胺化共衍生方法,对Bel-7402和Bel-7402/5-FU两者的总蛋白和分泌蛋白的N-连接聚糖进行了MALDI质谱的差异分析。5-FU与Bel-7402相比,耐药细胞在总蛋白和分泌蛋白中的岩藻糖化唾液酸糖型显著升高;高甘露糖型N-聚糖在总蛋白中下降,而在分泌蛋白中显著增加。本研究为进一步探索肝癌耐药提前诊断提供糖链标志物起到一定的参考作用,并为后续解决肝癌的治疗的耐药提供理论依据。

