茯苓-山药复配米稀和猴头菇饼干对功能性消化不良大鼠的改善作用
钟亚东,潘 猛,徐德昌,孙永敢,胡婕伦,聂少平,钟虹光,尧梅香,谢明勇,
(1.南昌大学食品科学与技术国家重点实验室,中加食品科学技术联合实验室(南昌),江西南昌 330047;2.江中食疗科技有限公司,江西九江 330000)
功能性消化不良(functional dyspepsia, FD)是一种常见的功能性胃肠道疾病,在全球的发病率为11%~29.2%[1]。FD由胃和十二指肠功能紊乱而引起,无器质性病变,主要症状为餐后饱胀、早饱感、上腹疼痛等[2]。据报道,饮食不规律、喜甜食和碳酸饮料等异常饮食行为可诱发FD[3]。虽然该病症鲜少出现严重病情或危及生命,但极大地降低患者生活质量[4]。目前FD常见治疗方法包括饮食调整、药物治疗以及心理干预,但疗效有限且可能具有副作用[5]。因此,寻找包括传统草药和天然活性物质在内的药物补充剂和替代品具有积极的现实意义[6-7]。
猴头菇是是一种大型真菌,被认为具有保肝、健脾、养胃和助消化等功效。研究发现猴头菇制品可显著改善早饱、嗳气、腹胀等症状,促进胃排空,改善动力障碍型FD[8-9]。茯苓和山药具有补脾养胃、健脾和胃的功效,常用于缓解胃肠道症状[10]。其中,多糖等活性物质被认为是其主要功效成分[11-14]。
目前,针对猴头菇、山药和茯苓对功能性消化不良症状的研究鲜见报道,且食物基质可与活性物质相互作用并影响其功效[15-17]。因此,本研究采用肝郁脾虚性功能性消化不良大鼠模型,结合剂量水平和食物基质效应,探讨基于茯苓-山药复配提取物和猴头菇提取物开发的冲泡型米稀和酥性饼干对功能性消化不良症状的改善作用,以期为食药两用资源的开发及应用提供理论依据。
1 材料与方法
1.1 材料与仪器
茯苓-山药复配提取物、茯苓-山药复配米稀、猴头菇提取物和猴头菇饼干 本实验室自制;番泻叶
华柯生态农业开发有限公司;SPF级Spargue-Dawley雄性大鼠 (112只,体质量180±20 g)、动物饲料垫料 购自湖南斯莱克景达实验动物有限责任公司(许可证号:SCXK(湘)2016-0002);鼠血清胃动素(motilin, MTL)、胃泌素(gastrin, GAS)、胆囊收缩素(cholecystokinin, CCK)检测试剂盒 南京建成生物工程研究所;其余试剂 均为国产分析纯。
超纯水仪 美国Millipore公司;AL104型电子分析天平 上海梅特勒-托利多仪器公司;YP10002马头牌电子天平 上海光正医疗器械有限公司;TGL-5-A高速离心机 上海安亭分析仪器有限责任公司;Varioskan Flash全波长多功能酶标仪 美国Thermo公司;正置光学显微镜 日本Nikon公司;6890N型气相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 样品制备方法 饼干制备:将6.25%(w/w)的水提猴头菇提取液与低筋小麦粉、玉米淀粉、起酥油、全脂乳粉等混合搅拌,制作面团,随之进行成型、脱模操作。采用变温烘烤方式处理饼干生坯6~8 min。烘烤温度依次为200~240、220~260、180~200、140~180 ℃。
米稀制备:将8.6%(w/w)的水提茯苓-山药复配提取物与粳米粉、燕麦粉、白砂糖、水混合,搅拌均匀,过胶体磨,滚筒干燥后过筛。
番泻叶水煎剂制备[18]:将番泻叶浸泡于沸水中,比例为5:100 g/mL。
营养性半固体糊制备[19]:5 g羧甲基纤维素钠溶于100 mL蒸馏水,并依次加入淀粉4 g、奶粉8 g、白砂糖4 g、活性炭4 g,搅拌均匀,配成约150 mL的黑色半固体糊。
1.2.2 模型的建立 动物适应性饲养7 d,随机抽取8只大鼠作为正常组,其余进行造模。采用适度夹尾刺激、不规则喂养、苦寒泻下的复合因素联合造模法建立肝郁脾虚型FD大鼠模型[20]。方法如下:
大鼠夹尾刺激2次/d,每次30 min,即用长拆线剪钳夹大鼠尾巴末端约1/3处(若有破损,碘伏消毒伤口),使其怒叫挣脱,并与其他大鼠打斗厮咬;采用单日喂食、双日禁食的不规则喂养方式,且禁食日按2 mL/100 g体重灌胃大鼠番泻叶水煎剂(苦寒泻下),2次/d;饮水正常。14 d后,造模结束,大鼠进食恢复正常。依《中医实验动物模型方法学》[20],肝郁脾虚型FD模型有以下症状:情绪激动,易怒;眯眼(眼球仅暴露一半以上);食欲不振,食量减少;体重增加缓慢,甚至下降;毛色暗黄,毛发粗乱;粪便时干时稀,拉尾排便反应阳性;精神萎靡,乏力倦怠;胃黏膜未发生器质性病变。
取造模成功大鼠分为模型组(M;生理盐水1 mL/100 g)、阳性组(P;多潘立酮混悬液,2.7 mg/kg)、茯苓-山药复配提取物组低、中、高剂量组(FL、FM、FH;116.1、232.2和464.4 mg/kg)、茯苓-山药复配米稀低、中、高剂量组(FPL、FPM、FPH;675、1350和2700 mg/kg)、猴头菇提取物低、中、高剂量组(HL、HM、HH;135、270和540 mg/kg)、猴头菇饼干低、中、高剂量组(HPL、HPM、HPH;2160、4320和8640 mg/kg),共14组,每组8只,正常组灌胃生理盐水(N;1 mL/100 g),持续灌胃14 d。各组大鼠末次给药后,禁食不禁水24 h,次日上午各组大鼠均注入5%半固体糊,按10 mL/kg灌胃。30 min后处死,取相关脏器和血清,并于-80℃保存。
灌胃中剂量依照根据药典所确定的人的推荐量(茯苓-山药复配提取物2.58 g/70 kg/d,猴头菇提取物3 g/70 kg/d,米稀30 g/70 kg/d,猴头菇饼干48 g/70 kg/d),与大鼠进行等效剂量换算,换算系数为0.018。
1.2.3 大鼠行为观察 每天观测大鼠行为表现,记录懒动、倦怠、眯眼、扎堆,体形逐渐消瘦,排便次数增多等现象,判定是否造模成功。
1.2.4 大鼠体重与食量变化 适应期开始至实验结束期间,每天记录大鼠体重和采食量。
1.2.5 胃组织病理观察 剪取胃部约10 mm×2 mm的组织块,置于4%多聚甲醛溶液中固定,HE染色病理观察。
1.2.6 胃排空率和小肠推进率的测定 胃排空率测定:取胃结扎幽门贲门,并称量胃总质量(即胃内容物+胃组织重量),沿胃大弯剪开,洗去胃内容物后吸干称量胃净质量(即胃组织重量),胃排空率计算如公式(1)所示:

小肠推进率测定:取上端自幽门、下端至回盲部的整段小肠,轻轻剥离后不加牵引直铺于白纸上,测量幽门至黑色半固体糊前沿的距离和小肠的总长度。按照公式(2)计算小肠推进率:

1.2.7 血清胃肠激素的测定 眼球取血后静置1 h,3500 r/min离心20 min(4 ℃),取上清并依照试剂盒说明书测定中MTL、GAS和CCK含量。
1.2.8 结肠短链脂肪酸的测定 参照文献[21]的方法,精确称取结肠内容物并加入磷酸盐缓冲液匀浆,在4 ℃下以14000 r/min离心20 min后取上清,过0.22 μm水系滤膜。取400 μL上清,乙醚提取后进行气相分离测定。色谱柱起始温度100 ℃,7.5 ℃/min升温至140 ℃,再以15 ℃/min升温至200 ℃,保持3 min。进样口和火焰离子化检测器的温度分别240和300 ℃。氮气流量12.5 mL/min,分流比为1:10。氢气和空气的流速分别为30和400 mL/min,进样量1 μL。
1.3 统计学分析
数据采用平均值±标准差(mean±SD)表示。组间差异采用单因素ANOVA进行分析;主效应分析采用双因素ANOVA方法,若无交互作用,即可分别对剂量和受试物种类进行主效应分析。使用Dunnetts和Tukey方法分别对单因素和双因素ANOVA进行事后比较(Graphpad Prism 8)。交互作用,P<0.1表示差异显著;其他情况,P<0.05表示差异显著。
2 结果与分析
2.1 采食量
如图1所示,适应期间,所有组采食量无区别;造模后,与正常组相比,模型组采食量显著下降(P<0.05);受试物或药物干预后,大鼠采食量相比于模型组显著(P<0.05)升高,但仍显著低于正常组(P<0.05)。
受试物种类效应和剂量效应如表1和表2所示。干预期间,受试物种类对采食量无影响,即食物基质的存在与否以及功能活性物质的种类均不影响大鼠在干预期的采食量。与之相反,灌胃剂量水平显著影响采食量,且高剂量组显著(P<0.05)高于低剂量组。
2.2 体重
如图1所示,造模前,所有动物体重无差别;造模后大鼠体重与正常组相比显著下降(P<0.05);饮食或药物干预后,大鼠体重显著回升(P<0.05)。其中阳性组、FM组、FH组体重恢复至正常水平(P>0.05)。

图1 四种受试物对大鼠采食量和体重的影响(n=8)Fig.1 Effect of four test materials on feed intake and body weight in rats(n=8)
干预期间,不同受试物种类对采食量差异不大(表1茯苓-山药复配提取物组体重显著高于猴头菇饼干组(P<0.05),灌胃剂量对体重无显著影响(P>0.05)(表2)。

表1 受试物种类对功能性消化不良大鼠测试指标的影响的双因素方差分析(n=24)Table 1 Two-way ANOVA analysis for effect of the type of test materials on test parameters in rats with functional dyspepsia (n=24)
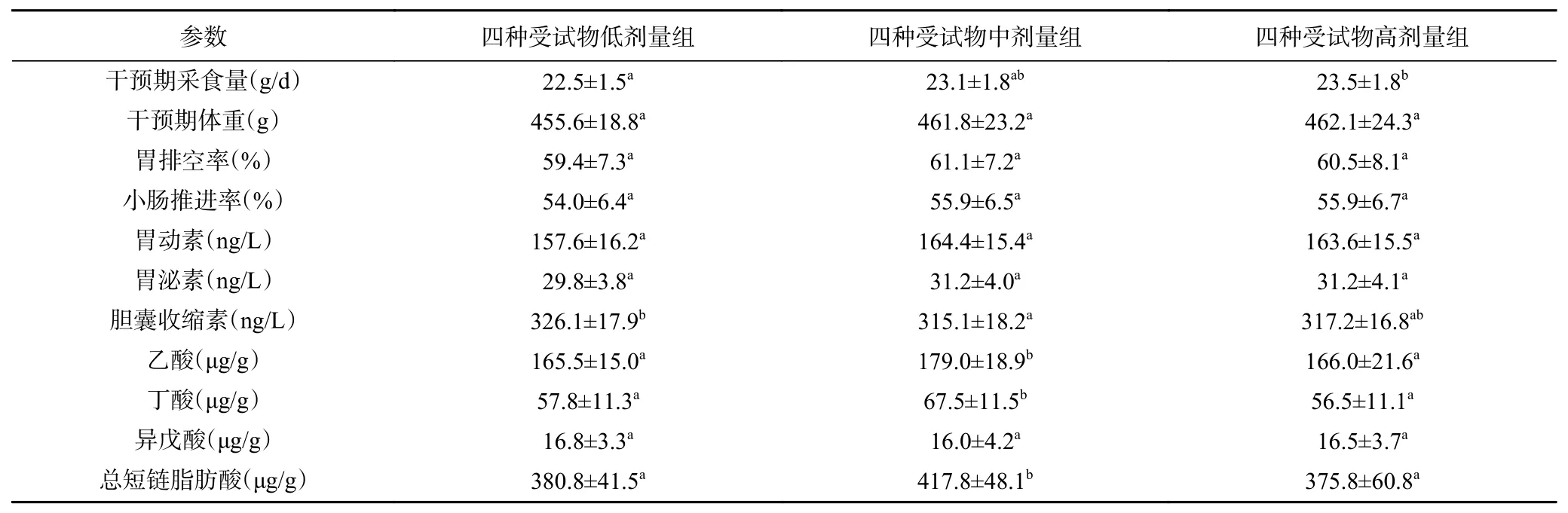
表2 灌胃剂量对功能性消化不良大鼠测试指标影响的双因素方差分析(n=32)Table 2 Two-way ANOVA analysis for effect of dosage on test parameters in rats with functional dyspepsia (n=32)
2.3 胃排空率与小肠推进率
如图2所示,与正常组大鼠(70.3%±5.8%)相比,模型组大鼠胃排空率显著降低(41.9%±6.4%;P<0.05)。与模型组相比,各干预组(56.4%±8.0%~66.1%±6.8%)的胃排空速率显著升高(P<0.05),且茯苓-山药复配各组、HPH组以及阳性组均恢复至正常组水平(P>0.05)。小肠推进率的变化与胃排空率情况相似。结果表明四种受试物作用与阳性药物多潘立酮效果一致,可有效改善胃肠动力。

图2 四种受试物对功能性消化不良大鼠胃排空率(A)和小肠推进率(B)的影响(n=8)Fig.2 Effect of four test materials on gastric emptying rate (A)and small intestine propulsion rate (B) of rats with functional dyspepsia (n=8)
如表1和表2所示,受试物种类及灌胃剂量对胃排空率无显著性影响(P>0.05),但前者明显影响小肠推进率:茯苓-山药复配提取物组(58.1%±6.8%)显著(P<0.05)高于各猴头菇组(52.4%±5.5%~53.2%±6.2%),而茯苓-山药复配米稀组(57.5%±5.8%)显著(P<0.05)高于猴头菇提取物组(52.4%±6.2%)。表明食物基质无作用,而不同活性物质之间差异显著。
2.4 胃组织病理学
如图3所示,所有组大鼠胃组织结构完整,腺体排列整齐,未见胃黏膜上皮细胞脱落、水肿及充血现象,未见胃器官实质性损伤。
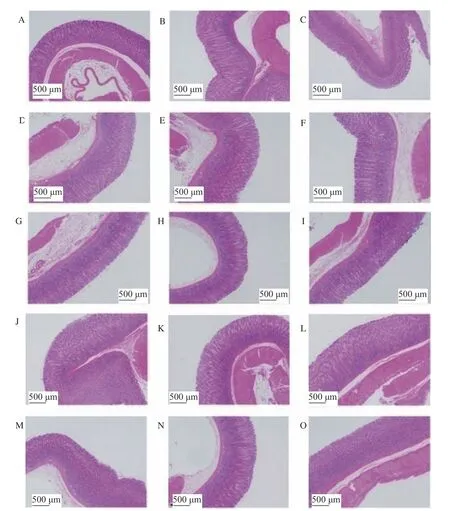
图3 四种受试物对功能性消化不良大鼠胃组织病理学观察(40×)Fig.3 Effect of four test materials on morphological changes in gastric tissue of rats with functional dyspepsia(40×)
2.5 血清胃肠激素
如图4所示,与正常组大鼠相比(MTL:193.6 ng/L;GAS:38.2±5.6 ng/L),模型组大鼠血清MTL(126.6±13.6 ng/L)和GAS水平(21.4±4.0 ng/L)显著(P<0.05)降低。与模型组相比,各干预组血清MTL(153.4±13.6~182.5±14.9 ng/L)和GAS(28.5±3.6~35.0±3.9 ng/L)水平均显著增加(P<0.05),其中两者在阳性组和FM组,以及GAS在FPM组的水平均恢复至正常(P>0.05)。

图4 四种受试物对功能性消化不良大鼠血清胃动素(A)、胃泌素(B)和胆囊收缩素(C)水平的影响(n=8)Fig.4 Effects of four test materials on the serum levels of motilin (A), gastrin (B) and cholecystokinin (C) in rats with functional dyspepsia (n=8)
相比于正常组(267.6±14.4 ng/L),模型组血清CCK水平(357.6±20.7 ng/L)显著(P<0.05)增加。相比于模型组,除HL组(338.2±19.1 ng/L)外,其他组血清CCK水平(288.2±16.2~327.9±15.1 ng/L)均显著(P<0.05)降低。
如表1和表2所示,受试物种类显著(P<0.05)影响血清MTL水平,其中茯苓-山药复配提取物组(167.6±17.0 ng/L)显著高于猴头菇饼干组(156.0±15.5 ng/L),而剂量无影响。受试物种类与剂量对血清GAS水平无影响,但均显著(P<0.05)影响血清CCK水平:茯苓-山药复配提取物组血清CCK水平(310.6±17.3 ng/L)显著低于各猴头菇组(324.1±15.0~329.1±17.7 ng/L),而米稀组(314.0±17.0 ng/L)显著低于猴头菇提取物组(329.1±17.7 ng/L);低剂量组(326.1±17.9 ng/L)显著高于中剂量组(315.1±18.2 ng/L)。结果表明通过选择受试物的种类和灌胃剂量,可优化受试物对血清胃肠激素水平的调节作用,且食物基质不干扰提取物质的相关调节作用。
2.6 结肠短链脂肪酸水平
如表3所示,模型组结肠总短链脂肪酸(shortchain fatty acids,SCFAs)水平显著(P<0.05)低于正常组,这与其6种组成SCFA的情况一致。与模型组相比,除戊酸与异戊酸外,阳性组各SCFAs及总SCFAs水平均显著(P<0.05)提高;茯苓-山药复配各组结肠乙酸、丙酸、丁酸、异丁酸和总SCFAs水平显著(P<0.05)升高;猴头菇提取物及饼干组的结果较复杂,中剂量组的结果与茯苓-山药复配各组相似,而低剂量组乙酸和丙酸含量显著(P<0.05)提高,高剂量仅增加乙酸和丁酸(限饼干组)水平(P<0.05)。此外,结肠异戊酸和戊酸水平仅分别在FM组和阳性组检测到显著升高(P<0.05)。干预后,茯苓-山药复配各组的丙酸(除提取物低剂量组)、丁酸水平,FM组的异丁酸与总SCFAs水平,以及HM组的丙酸、丁酸恢复到正常水平。
如表1和表2所示,受试物种类及灌胃剂量作为主效应均显著影响乙酸、丁酸和总SCFA水平(P<0.05),而异戊酸只受受试物种类因素影响(P<0.05):茯苓-山药复配组的丁酸、异戊酸和总SCFAs水平,以及其提取物组的乙酸水平均显著高于猴头菇组(P<0.05);中剂量组的乙酸、丁酸和总SCFAs水平均显著高于低、高剂量组(P<0.05)。丙酸、异丁酸、戊酸存在主效应交互作用(P<0.1),未进行分析。结果表明通过选择活性物质种类和剂量和优受试物对结肠乙酸、丁酸、异戊酸或总短链脂肪酸水平的调节作用,而食物基质对此无影响。
3 讨论与结论
胃肠消化动力不足是FD的重要发病机理,针对FD患者的治疗目标之一即为改善胃肠动力。本研究给与FD大鼠茯苓-山药或猴头菇相关提取物和产品均能改善胃排空率和小肠推进率,同时血清胃肠道激素(MTL、GAS和CCK)水平相应发送变化。MTL和GAS可通过刺激胃收缩,加速胃排空和/或改善小肠蠕动,而CCK作用相反。多糖是茯苓、山药和猴头菇的主要功能活性物质[21-23],通常由水提法获取。研究发现某些多糖如黄芪多糖和香菇多糖可显著促进胃肠蠕动,并改变胃肠激素[24,25],推测多糖是本研究中FD大鼠症状改善的主要功能性物质。
本研究灌胃FD大鼠各受试物后,各剂量均能不同程度地增加结肠SCFAs的水平。多糖是肠道菌群生成SCFAs的主要底物,而后者可调节宿主各项生理代谢活动,包括能量代、肠道蠕动、肠道屏障功能、肠道免疫等方面,因而多糖被视为潜在的益生元[26]。一项系统回顾与荟萃分析发现益生元在治疗FD中具有一定作用[27],这进一步表明益生元型多糖可用于治疗FD。此外,Reilly等[28]报道大鼠结肠中灌输SCFAs促进了肠道GAS的分泌,结合本研究关于血清胃肠激素的结果,推测多糖是通过促进SCFAs的生成进而改变胃肠激素的分泌,进而改善FD症状。同时,本研究还发现,受试物组大鼠的体重均能恢复到正常水平,但采食量仍低于正常组,这表明其他因素可能参与其中,如肠道SCFAs水平升高,影响大鼠能量代谢,进而调节体重[29]。
本研究通过比较提取物与相应产品对FD的改善作用,未发现米稀和饼干的基质影响茯苓-山药复配提取物和猴头菇提取物发挥功能活性。某些常用食物成分,如NaCl等盐类可降低多糖的黏度[30],从而影响其构象及相应的功能活性相关,如免疫活性,但可能对改善FD无作用。
综上所述,茯苓-山药复配米稀及猴头菇饼干可有效缓解FD引起的食量下降和体重减轻等症状,改善胃肠动力。推测其作用与SCFAs的生成及胃肠动力相关血清胃肠激素的变化相关。此外米稀及饼干的作用与原功能性提取物无差异。

