磁共振成像-弥散加权成像诊断良恶性卵巢肿瘤的临床价值分析
李宝林
女性因承受来自家庭、工作的双重压力,再加上自身抵抗力弱、生理结构特殊,所以容易发生妇科疾病,如卵巢癌。调查显示2020 年全球女性新发癌症病例、死亡病例分别为923 万、443 万,其中卵巢癌的新发病例、死亡病例分别为31 万、21 万[1]。可以看出,卵巢癌的发病率、死亡率较高,直接损害女性身心健康安全。为了提高卵巢癌患者的治疗效果,延长生存期,尽早予以诊治尤为重要。血清学标志物检测、超声等方法是卵巢肿瘤的常规诊断方法,虽然能够取得一定效果,但是仍存在漏诊现象[2,3]。随着当前影像学技术的进一步发展、完善,MRI 因分辨率高、多方位成像、安全可靠等优势而广泛用于诊断软组织肿瘤。值得注意的是,MRI 在诊断软组织肿瘤的部分特性时往往需要结合其他特征,以保证诊断正确性。DWI 作为新的MRI 功能成像技术,已被广泛用于诊断中枢神经系统疾病。部分研究指出,结合DWI 的表观扩散系数(apparent diffusion coefficient,ADC)及其图像,可明确判断肿瘤的良、恶性质,为后续治疗提供重要、可靠的理论依据[4,5]。本文就卵巢肿瘤患者开展研究,明确MRI-DWI 在其良、恶性质鉴别方面的诊断价值,报告如下。
1 资料与方法
1.1 一般资料 选取2019 年1 月~2020 年12 月辽宁省沈阳市红十字会医院放射线科的收治的81 例卵巢肿瘤患者,年龄21~61 岁,平均年龄(45.39±13.11)岁。纳入标准:①神志清楚,具备一定的理解、书写、沟通等能力;②经手术病理检查确诊为卵巢肿瘤;③对研究的目的、内容已知晓、自愿参与。排除标准:①认知障碍;②妊娠/哺乳女性;③检查前接受外科手术/放、化疗治疗;④存在MRI 检查禁忌证(恐惧幽闭症、对比剂过敏等);⑤研究途中因自身原因而主动退出。
1.2 方法
1.2.1 检查前 安排2 名工作经验丰富的医生进行全部操作;与患者主动交谈,介绍MRI-DWI 检查的临床意义、目的、操作流程、配合事项等,以取得患者的理解、配合。
1.2.2 检查中 ①仪器准备,Signa1.5T 超导型MRI全身扫描仪(GE 公司)及腹部联合相控阵线圈。②步骤:a.嘱咐患者排尽膀胱,进行胸式呼吸,以维持规律、平静呼吸,取仰卧位,放松全身;b.借助腹部联合相控阵线圈,MRI 扫描盆腔,常规T1WI、T2WI、脂肪抑制T2 成像;c.设置参数范围(T1 重复时间400 ms、T1 回波时间8.2 ms;T2 重复时间3000 ms、T2 回波时间85 ms;DWI 扩散敏感系数(b)600 s/mm,重复时间4000 ms、回波时间78 ms、层厚及层间距分别为6、2 mm;视野30~36 mm);d.当DWIb 为600 s/mm 时,在囊壁、囊实性等感兴趣区域测量ADC 值,反复测量3 次,取平均值。
1.2.3 检查后 2 名医生进行阅片,给出最终结论,必要情况(结论不一致)下安排另一名医生阅片,给出意见。
1.3 观察指标 ①以手术病理检查为依据,统计良、恶性肿瘤。②比较良恶性肿瘤相关影像学信息,包括ADC 值、病变部位、边界、囊实性、T1 及T2 信号均匀性等。③MRI-DWI 诊断良恶性卵巢肿瘤患者的ROC 曲线分析(囊实性、T2 信号、ADC 值)。
1.4 统计学方法 采用SPSS25.0 统计学软件进行统计分析。计量资料以均数±标准差()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义
2 结果
2.1 手术病理检查结果分析 以手术病理检查为依据,81 例卵巢患者中,65 例(80.25%)为良性肿瘤、16 例(19.75%)为恶性肿瘤。
2.2 良、恶性卵巢肿瘤患者影像学信息比较 良、恶性卵巢肿瘤患者的囊实性、T2 信号均匀性、ADC 值比较差异具有统计学意义(P<0.05)。良、恶性卵巢肿瘤患者的病变部位、边界清晰度、T1 信号均匀性比较差异无统计学意义(P>0.05)。见表1。
表1 良、恶性卵巢肿瘤患者影像学信息比较[n(%),]
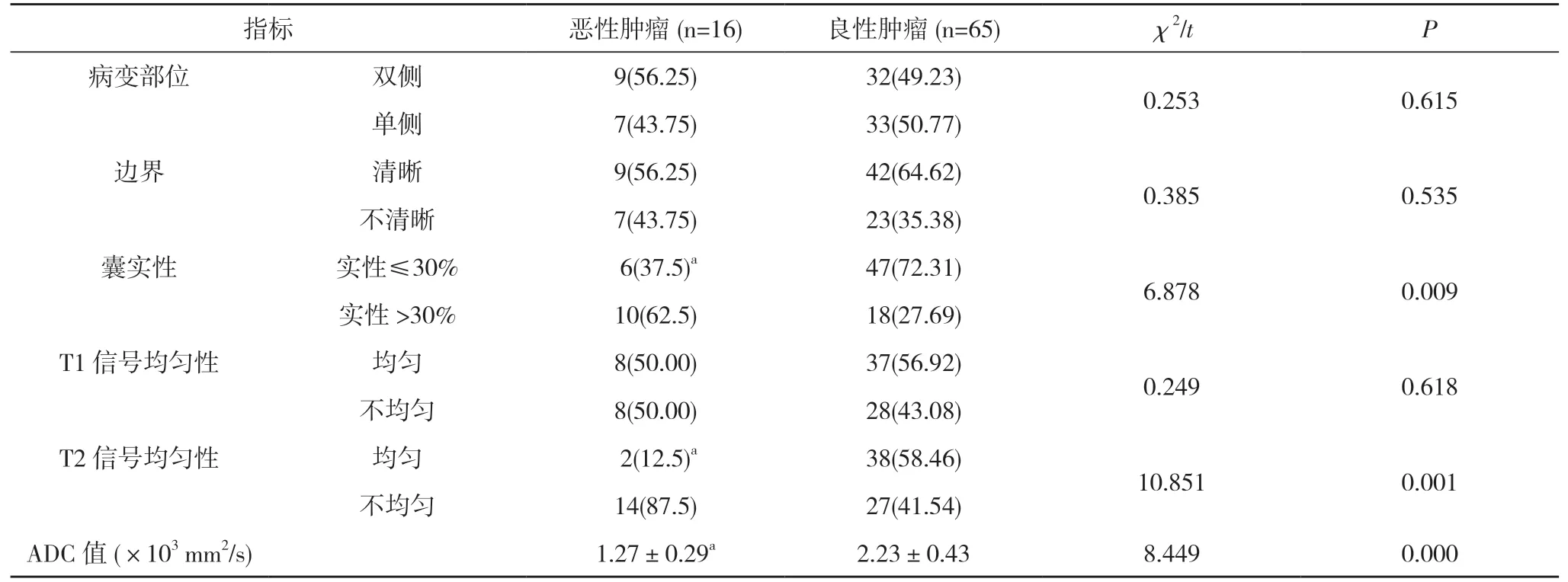
表1 良、恶性卵巢肿瘤患者影像学信息比较[n(%),]
注:与良性肿瘤比较,aP<0.05
2.3 MRI-DWI 诊断良恶性卵巢肿瘤患者的ROC 曲线分析 囊实性、T2 信号、ADC 值的AUC 分别为0.561、0.641、0.839,其中ADC 值诊断良恶性卵巢肿瘤的特异度为85.35%、敏感度为92.00%。
3 讨论
作为妇科临床上的常见病,卵巢肿瘤与多种因素(遗传、内分泌、环境、生活习惯等)有关,并且具有种类多、发现晚、预后差等特点,是影响女性健康安全的常见肿瘤之一[6]。根据生物学行为,可将卵巢肿瘤分为两种类型,即良性、恶性,由于该病早期症状缺乏特异性,所以大部分患者在确诊时已处于中晚期阶段,从而影响救治效果,降低5 年存活率。
关于卵巢肿瘤的诊断,临床医生通常采用MRI 进行检查,然而常规扫描诊断缺少一定的量化指标,难以从形态方面作出准确的判断。
DWI 作为一项图像技术,可借助生物组织内的热运动来反映组织形态结构变化,同时血流灌注、呼吸等因素不会对其影像表现产生干扰。ADC 值作为反映水分子扩散幅度的参数,可真实反映弥散情况。结合近些年实践研究观察,发现恶性病变细胞密度高,水分子运动受限明显,所以认为ADC 值低、高b 值且DWI呈现高信号时,较大可能发生恶性肿瘤[7]。有学者指出,ADC 值与良、恶性病变呈负相关,而T2 信号均匀性、囊实性则是恶性卵巢发生的高危因素[8]。马德晶等[9]收集、整理非肿块样强化的乳腺病变影像资料,分析、探究体素内不相关运动扩散加权成像(IVIM-DWI)的辅助诊断效能,发现该技术可进一步强化非肿块样强化的乳腺病变患者鉴别诊断效果,以指导后续治疗。梁艳山等[10]就卵巢肿瘤患者开展研究,分析MRI 结合ADC 值的鉴别诊断价值,发现MRI、ADC 值的有效结合既有效又可行,能确保卵巢肿瘤患者尽早得到针对性干预治疗,从而改善临床结局,延长生存期限,降低死亡率。
本研究结果得出,本院81 例卵巢肿瘤患者当中恶性病变占比较良性病变高,同时结果显示,良、恶性卵巢肿瘤患者的病变部位、边界清晰度、T1 信号均匀性比较差异无统计学意义(P>0.05)。但良性卵巢肿瘤患者的囊实性(实性≤30%)、T2 信号均匀性(均匀)较恶性卵巢肿瘤患者低,ADC 值高于恶性卵巢肿瘤患者,差异有统计学意义(P<0.05)。说明恶性肿瘤细胞的ADC 值低,囊实性部分DWI 呈高信号,且均匀分布,考虑和以下原因有关:良性肿瘤细胞多数情况下处于休止期,因而生长较慢,不会干扰细胞质外水分子运动,可见DWI 呈等信号,且ADC 值高。恶性肿瘤成熟度低、且分化差,且处于增殖分裂期,生长速度快,核分裂异常,进而减少细胞质、增加细胞核质、增强蛋白质及多糖等生物分子能力,提高缩小细胞外容积,限制水分子运动幅度,造成ADC 值低、DWI 高信号。另外,本研究结果显示,分析囊实性、T2 信号均匀性、ADC 值 的AUC 分别为0.561、0.641、0.839,即囊实性<T2 信号均匀性<ADC 值,说明在卵巢肿瘤良、恶质的鉴别诊断方面,ADC 值的效果高于常规MRI 扫描(T2 信号均匀性、囊实性)。再加上ADC 值诊断良恶性卵巢肿瘤的特异度为85.35%、敏感度为92.00%,所以认为MRI-DWI 在软组织肿瘤的鉴别诊断方面具有较高的敏感度、特异度,能为医生在临床决策制定过程中提供重要的指导性。
综上所述,MRI-DWI 具有较高的诊断效果,明显优于MRI 常规检查。就卵巢肿瘤患者而言,MRI-DWI可明确判断该病的良、恶性,促使医生根据可靠影像学信息为患者制定科学、合理的治疗方案,以强化治疗效果,提高存活率。介于相关报道较少,再加上此次研究样本量不足、结局指标不完善等方面的局限性,今后仍需深入探究卵巢肿瘤患者诊断情况,以期丰富研究成果,进一步证实MRI-DWI 的应用价值,从而提升我国卵巢肿瘤患者诊治发展水平,在一定程度上降低恶性卵巢肿瘤发生率,减少其对女性机体健康产生的危害。

