DRR1 与TMOD2 在人宫颈癌细胞HeLa 中相互作用的研究
蔡云龙 刘宇希 陈晓 孙晓雨 卢方晋
肾细胞癌下调蛋白 1(Down-regulated in renal cell carcinoma 1,DRR1)是一种新的肌动蛋白的结合蛋白,可以促进丝状肌动蛋白(F-actin)的形成[1,2]。同时,DRR1 在肿瘤以及在神经系统中的生物学作用已被广泛报道[3-7],然而关于DRR1 的相关作用机制仍尚不明确。DRR1 的氨基酸序列中存在卷曲螺旋结构域 (coiled-coil domain),表明其可以与其他蛋白质相互结合[8]。前期研究结果发现DRR1 可以与F-actin 结合并促进F-actin 的形成[6],F-actin 是一种高度保守的蛋白,参与机体多种生物学活动[9,10]。最近,通过GST pull down 实验筛选与DRR1 相互作用的蛋白质,质谱分析结果确定TMOD2 是与DRR1 相互结合的蛋白之一[11]。结果显示,TMOD2 与DRR1 在原代培养海马神经元细胞中相结合,并且共同参与调节神经细胞轴突的形成[11]。TMOD 是一个肌动蛋白结合蛋白家族,包括四个成员(TMOD1,TMOD2,TMOD3 和TMOD4)[12],其中TMOD1 和TMOD3 在各种组织中高表达,而TMOD2 和TMOD4 分别在神经系统和骨骼肌中表达,TMOD2 现已被证明能调节神经元的神经突延伸和突触密度[13]。另外,有研究证明,TMOD 蛋白家族可以通过与F-actin 结合从而调节肌动蛋白动力学[14]。本研究中,利用免疫共沉降技术深入分析不同长度的DRR1片段与TMOD2 之间在细胞内的相互作用。结果发现,不同长度的DRR1 片段与TMOD2 的结合能力存在差异。本研究成果为揭示DRR1 与TMOD2 之间的相互作用,以及两者结合后的生物学功能提供了新的线索。
1 材料与方法
1.1 材料 兔抗Venus 抗体(日本MBL 公司)和小鼠抗血凝素抗体(抗HA、美国sigma-aldrich 公司),蛋白G 琼脂糖凝胶(protein G sepharose,美国GE Healthcare公司),胎牛血清(美国Gibco 公司)。不同长度的DRR1 表达载体与TMOD2-HA 表达载体的构建方法按照前期研究进行[6,10]。
1.2 细胞培养 HeLa 细胞购自碧云天公司,用含有10% 胎牛血清的DMEM 培养基于37℃培养。细胞转染实验使用Lipofectamine 3000(美国Invitrogen 公司)按照说明书要求进行。
1.3 免疫共沉降 用RIPA 裂解缓冲液(50 mM Tris-Hcl,pH 7.4,150 mM NaCl,1% NP-40,1% sodium dexycholate,0.1% SDS)制备细胞裂解液。将细胞裂解液与相应的抗体在4℃ 孵育4 h 后,与蛋白质 G 琼脂糖凝胶混合,然后在4℃下再孵育2 h。混合物在4℃下以15000 rpm 转速离心10 min,用冷磷酸盐缓冲液洗涤沉淀3 次。在最后一次清洗后,将样品缓冲液加入到沉淀中,并将样品煮沸5 min,再次在4℃下以15000 r/min 转速离心10 min,收集上清液进行免疫印迹分析。
2 结果
2.1 制备不同长度的DRR1 蛋白片段 DRR1 蛋白质由144 个氨基酸组成,通过蛋白质一级结构分析软件分析,确认了DRR1 蛋白质中有一个卷曲螺旋结构域 (coiled-coil domain)和一个核定位信号(nuclear localization signal,NLS)。根据这两个结构域存在的位置,设计了4 个不同长度的DRR1 片段,并构建了相应的表达载体。见图1。
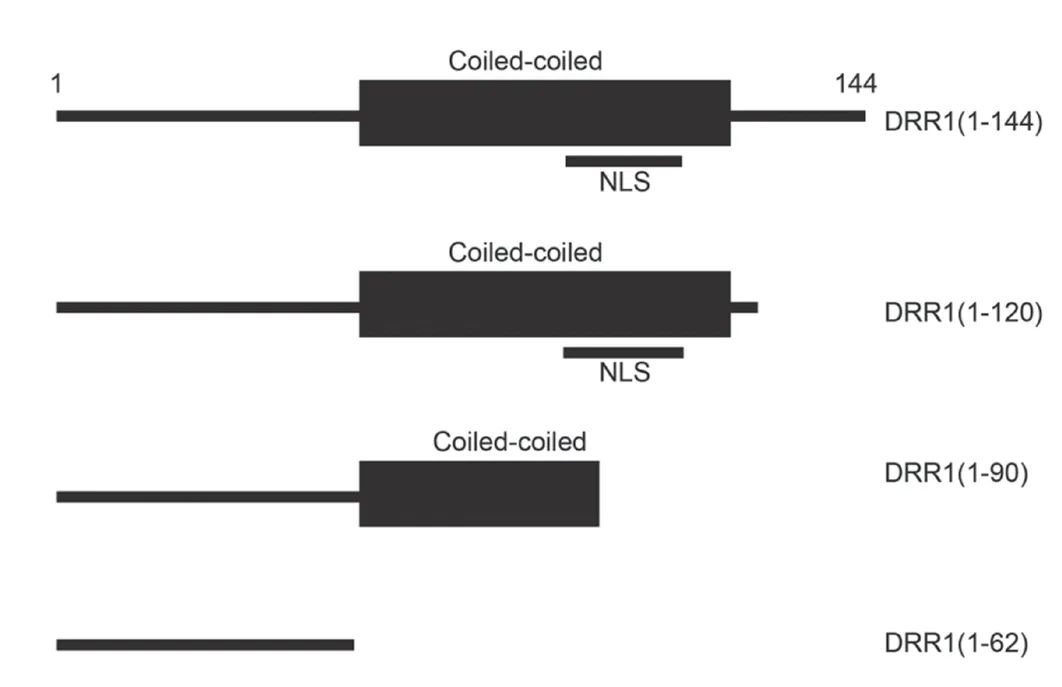
图1 不同长度的DRR1 蛋白质片段示意图
为了检测不同DRR1 区域与TMOD2 在细胞中相互结合的情况,首先构建了4 种表达不同长度DRR1蛋白的表达载体:DRR1(1-62)-Venus,DRR1(1-90)-Venus,DRR1(1-120)-Venus 和DRR1(1-144)-Venus。将不同的表达载体分别转染到HeLa 细胞,3 d 后裂解细胞获得裂解液并进行免疫印迹试验。结果显示,各个不同长度DRR1 蛋白片段在免疫印迹中的条带位置与理论预测分子量一致。见图2。

图2 在HeLa 细胞中表达的不同长度的DRR1 蛋白片段
2.2 DRR1 与TMOD2 相互结合 前期通过GST pull down 实验发现TMOD2 是DRR1 的结合蛋白,并通过免疫共沉降实验进行了验证。为了进一步确认DRR1与TMOD2 结合的区域,将表达不同长度DRR1 片段的载体分别与TMOD2-HA 载体共转染至HeLa 细胞,3 d 后收集细胞获得细胞裂解液,利用抗Venus 抗体进行免疫共沉降,再利用免疫印迹实验对沉降蛋白进行检测。结果显示各个样本中不同长度的DRR1 蛋白片段均能被沉降下来,其中DRR1(1-90)蛋白片段组、DRR1(1-120)蛋白片段组和全长DRR1(1-144)蛋白组,都可见TMOD2-HA 阳性条带,而DRR1(1-62)蛋白片段组和阴性对照CMV-Venus 组未见TMOD2-HA 阳性条带。见图3。
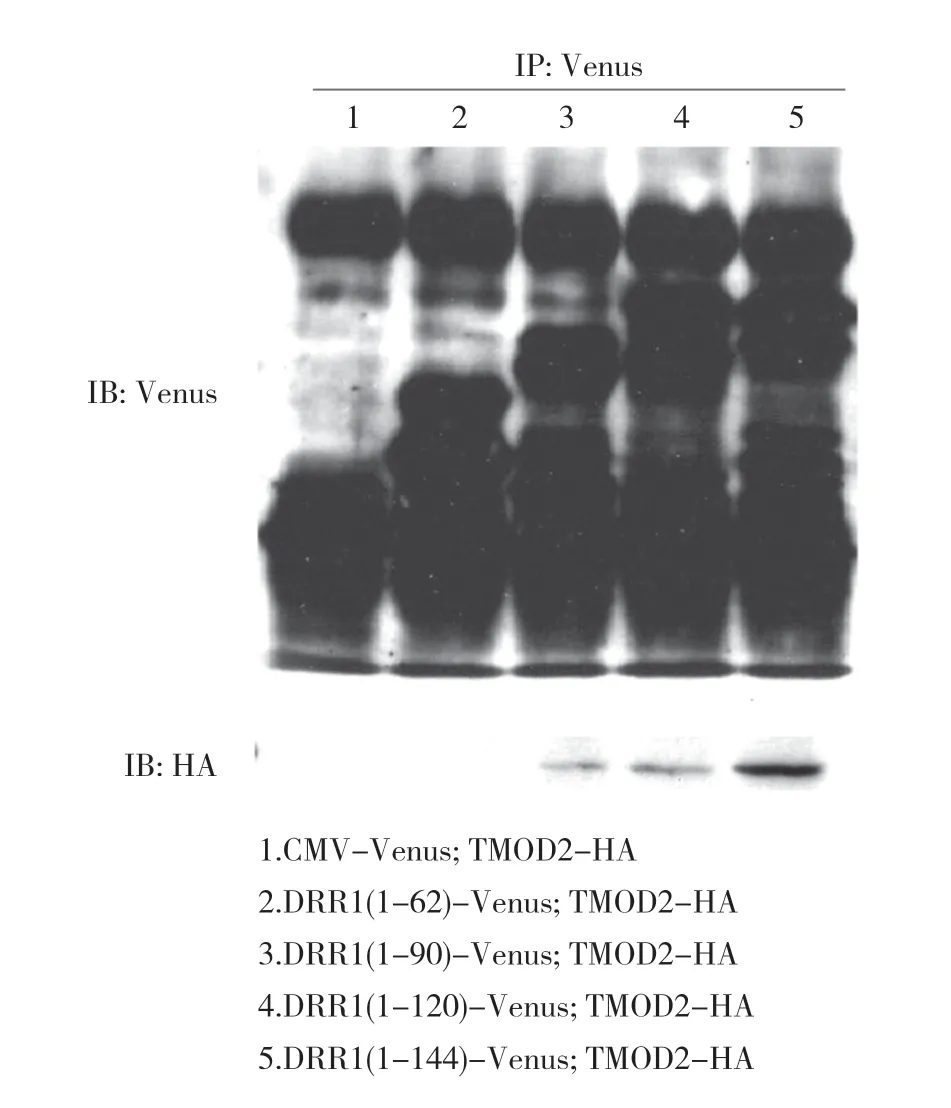
图3 TMOD2 与DRR1 在HeLa 细胞中结合
为了进一步确认上述结果,在载体转染后,利用抗HA 抗体进行免疫共沉降,并利用免疫印迹实验进行分析。结果显示各个样本中的TMOD2-HA 都成功地被沉降下来,其中DRR1(1-90)蛋白片段组、DRR1(1-120)蛋白片段组和全长DRR1(1-144)蛋白组,可见相应的DRR1 蛋白片段的条带,而阴性对照CMV-Venus 组和DRR1(1-62)蛋白片段组未见相应的DRR1 蛋白片段的条带。见图4。

图4 DRR1 与TMOD2 在HeLa 细胞中结合
3 讨论
目前为止,多项研究结果已经证明DRR1 是肌动蛋白的结合蛋白,且已证实DRR1 与F-actin 的正端(barded end)结合[2]。而TOMD2 也是肌动蛋白的一个结合蛋白,与丝状肌动蛋白F-actin 的负端(pointed end)结合[12]。
本研究发现DRR1(1-90)蛋白片段、DRR1(1-120)蛋白片段和全长DRR1(1-144)蛋白可以与TOMD2 结合,而DRR1(1-62)蛋白片段不能与TOMD2 结合。通过分析DRR1 蛋白质的氨基酸序列,发现DRR1(1-90)蛋白片段、DRR1(1-120) 蛋白片段和全长DRR1(1-144)蛋白均含有完整卷曲螺旋结构域,而DRR1(1-62)蛋白片段不含有该结构域,提示TMOD2 可能与DRR1 蛋白的卷曲螺旋结构域结合。
DRR1 和TMOD2 均为肌动蛋白的结合蛋白,都参与F-actin 的形成,但目前的研究发现二者在某些生物学功能上呈现相反的作用。通过过表达DRR1 会导致神经元细胞棘状突起的密度降低[15],然而过表达TMOD2 则会增加神经元细胞棘状突起的密度[14]。研究结果显示,敲除DRR1 和TMOD2 基因对海马神经元细胞早期轴突形成也起到相反的作用,DRR1 基因下调抑制神经元细胞轴突生长,而TMOD2 基因下调促进神经元细胞轴突生长,同时,TMOD2 的表达下调对DRR1 shRNA 诱导的异常轴突形成具有保护作用[11]。
以上结果提示DRR1 和TMOD2 共同参与调节肌动蛋白动力学,并且两者对肌动蛋白动力学的调节存在一定的差异,关于TMOD2 与DRR1 在细胞中结合后如何调节肌动蛋白动力学是值得进一步研究的问题。

