梅毒螺旋体TP15 抗原在梅毒诊断中的应用价值
许志晟 朱伯平 黄思聪
梅毒是由梅毒螺旋体(Treponema pallidum,TP)引起的一种性传播疾病,可通过性接触、输血和垂直传播传播。近年来,梅毒在中国的发病率呈上升趋势。梅毒患者从2005 年的135210 例增加到2014 年的441818 例,增幅超过其他27 例乙类法定传染病,居全国第三位[1]。梅毒可导致神经梅毒、心血管、多系统损伤,甚至死亡。因此,及时诊断和治疗梅毒患者至关重要[2]。梅毒的诊断主要依据临床表现和实验室血清学检查,血清学试验提供了梅毒的推定诊断,它可以分为非密螺旋体试验和密螺旋体试验。非密螺旋体检测主要包括快速血浆反应素环状卡片试验(RPR)、性病研究实验室试验(VDRL)及甲苯胺红血清不加热试验(TRUST),如果结果为阳性,则进行经确认的密螺旋体检测,如TPPA。近年来,越来越多的实验室开始应用密螺旋体免疫分析,如酶免疫分析(EIA)、化学发光免疫分析(CIA)等。这些方法的灵敏度和特异性都很高,但梅毒检测尚无公认的金标准方法[3]。以往研究表明,TP15 蛋白在梅毒螺旋体中含量丰富,是一种具有较高特异性的外膜蛋白成分,在各期梅毒患者的血清中均能够检测到针对该蛋白的特异性免疫球蛋白G(IgG)抗体[4]。因此,本研究通过基因工程技术克隆表达TP15蛋白,并通过建立ELISA 方法评价其作为诊断抗原的应用价值,为开发和优化新一代梅毒诊断试剂盒提供实验依据。
1 材料与方法
1.1 实验材料 TP 模板:梅毒螺旋体Nichols 株基因组DNA 由广州医科大学检验系实验室保存。载体及菌株:原核表达载体pET-28b 及大肠杆菌DH5A、大肠杆菌BL21 (DE3)保存于实验室。血清样本:梅毒TPPA 阴阳性血清由广州医科大学附属第一医院收集。主要试剂:购自TAKARA 的预混Ex Taq DNA 聚合酶;购自New England Biolabs 的核酸内切酶NCOI、SALI和T4 DNA 连接酶。购自Fermentas 的蛋白质分子量标准品;购自Tiagen 公司的质粒提取和PCR 产物回收试剂盒,购自JABES 公司30%丙烯酰胺(1∶29)、TRIS、SDS、IPTG 和TRICINE;镍离子亲和色谱柱(histrapgravity)购自GE;购自Abcam 的酶标羊抗人IgG。
1.2 TP15 基因扩增 以TP 基因组DNA 为模板设计引物forward:5’-CATGCCATGGGCATGGTGAAAAGAG GTGGCGC-3’;reverse:5’-ACGCGTCGACCCTGCTAAT AATGGCTTCCT-3’。TP 模板0.8 ng,上游和下游引物为0.8 μmol/L,2×Premix Ex Taq 为25 μl,蒸馏水为50 μl。反应条件为:95℃预变性5 min,95℃变性15 s,58℃退火30 s,72℃延伸30 s,循环35 次,再72℃延伸5 min。扩增PCR 产物和1%琼脂糖凝胶电泳分析。
1.3 pET28b-TP15 质粒的构建和测序 目的基因片段与经相同双酶切的pET-28b 载体连接过夜。将连接产物转化到敏感大肠杆菌BL21 (DE3)中,使用卡那霉素进行抗性筛选,获得重组体,送公司测序验证。
1.4 重组工程菌的诱导表达和纯化 在含有卡那霉素的LB培养基中接种重组工程菌并振荡培养,次日按1%比例转种于卡那霉素LB 培养基中。当OD600 达到0.8,最终浓度为1.0 mmol/L 时加入IPTG 诱导表达。分别在诱导后0、1、2、3、4 h 收集细菌,用超声波破菌。行SDS -PAGE 分析。提取IPTG 诱导与表达后包涵体沉淀物,用含2 M 尿素和1% Triton X-100 的洗涤液洗涤3 次,再用8 M 尿素沉淀包涵体。用亲和层析对溶解的上清进行纯化,用450 mM 咪唑洗脱。
1.5 Western blot SDS-PAGE 后,在PVDF 膜上TP15重组蛋白进行Western blotting 分析,其中一抗为TPPA阳性梅毒血清,二抗为酶标羊抗人IgG。
1.6 TP15-ELISA 法的建立 使用碳酸盐缓冲液(pH 9.6)将纯化的TP15 蛋白稀释到合适的浓度(由棋盘滴定法确定),将其包被到空白酶标板,4℃孵育过夜。使用1%BSA 在室温条件下封闭2 h 后即可使用。血清经1∶5 稀释后37℃温育1 h,酶标抗体工作浓度为1∶20000。用于检测临床收集的44 例TPPA 阳性和44 例TPPA 阴性血清,以检测获得的44 份TPPA 阴性血清的平均OD+3SD 为阳性临界值。
1.7 统计学方法 采用SPSS17.0 统计学软件处理数据。计数资料以率(%)表示,采用χ2检验分析TPPA法与TP15-ELISA 对梅毒血清的检测结果。P<0.05 表示差异有统计学意义。
2 结果
2.1 TP15 表达载体的测序和鉴定 TP15 基因片段经PCR 扩增后进行AGE 分析,发现特异性DNA 条带约为0.5 KB,与预期一致。电泳分析的原核表达载体pET28b-TP15 NCoI/SAII 酶切后显示两个条带约5.3 KB 和0.5 KB。见图1。表达载体的测序结果显示,pET28b 载体克隆的基因序列与数据库中注册TP15 基因序列是一致的。
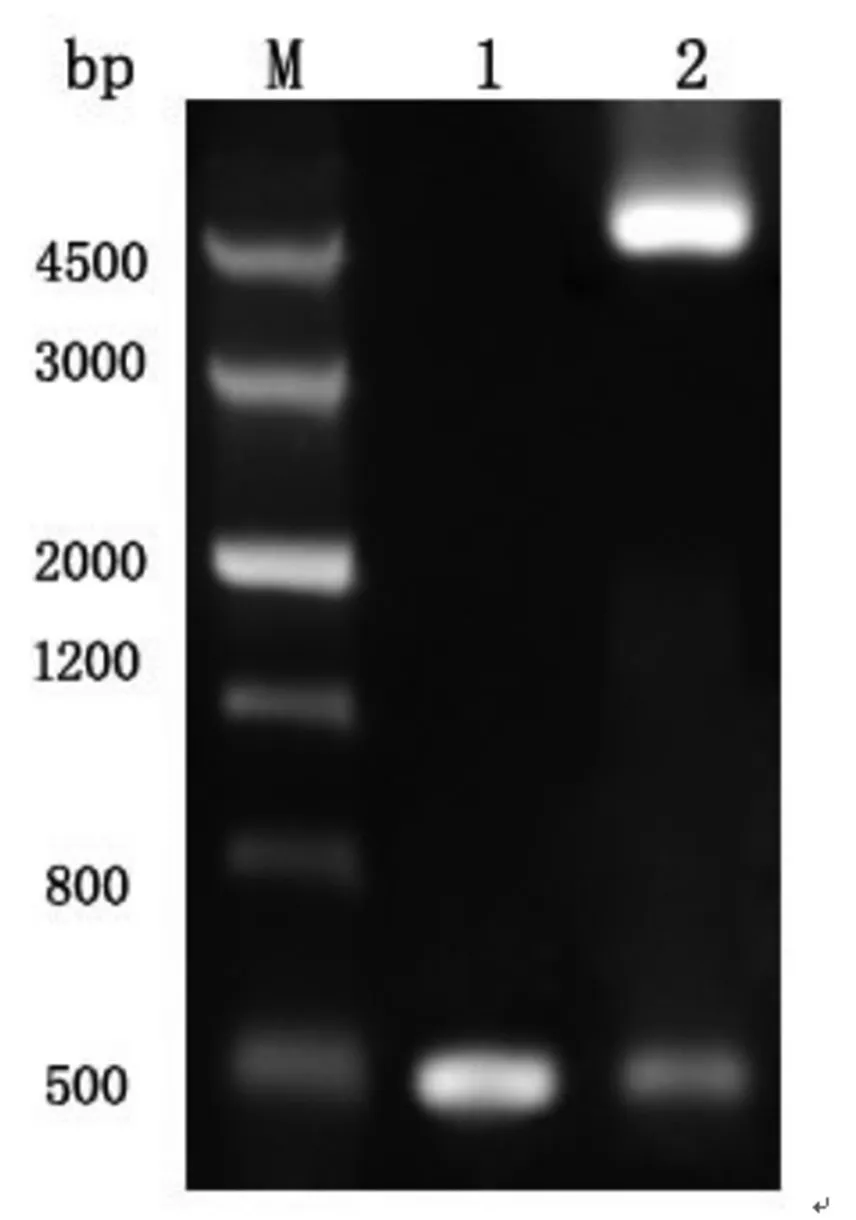
图1 TP15 基因扩增产物和表达载体pET28b-TP15 双酶切鉴定
2.2 TP15 诱导表达、纯化与验证 经IPTG 诱导表达后,重组菌pET-28b-TP15-BL21 的表达产物经SDSPAGE 分析,可见蛋白条带约20 kDa 左右,随诱导时间的延长 其表达量增加,4 h 时达到峰值,以包涵体为主要表达形式。见图2A。UVP 分析显示,约细菌总蛋白含量的30%是本实验的目的蛋白,纯化重组蛋白可得到相对单一的目的蛋白带。见图2B。Western blotting表明TP15 蛋白与TPPA 阳性血清具有良好的免疫反应性,而与TPPA 阴性血清不发生反应。见图2C。
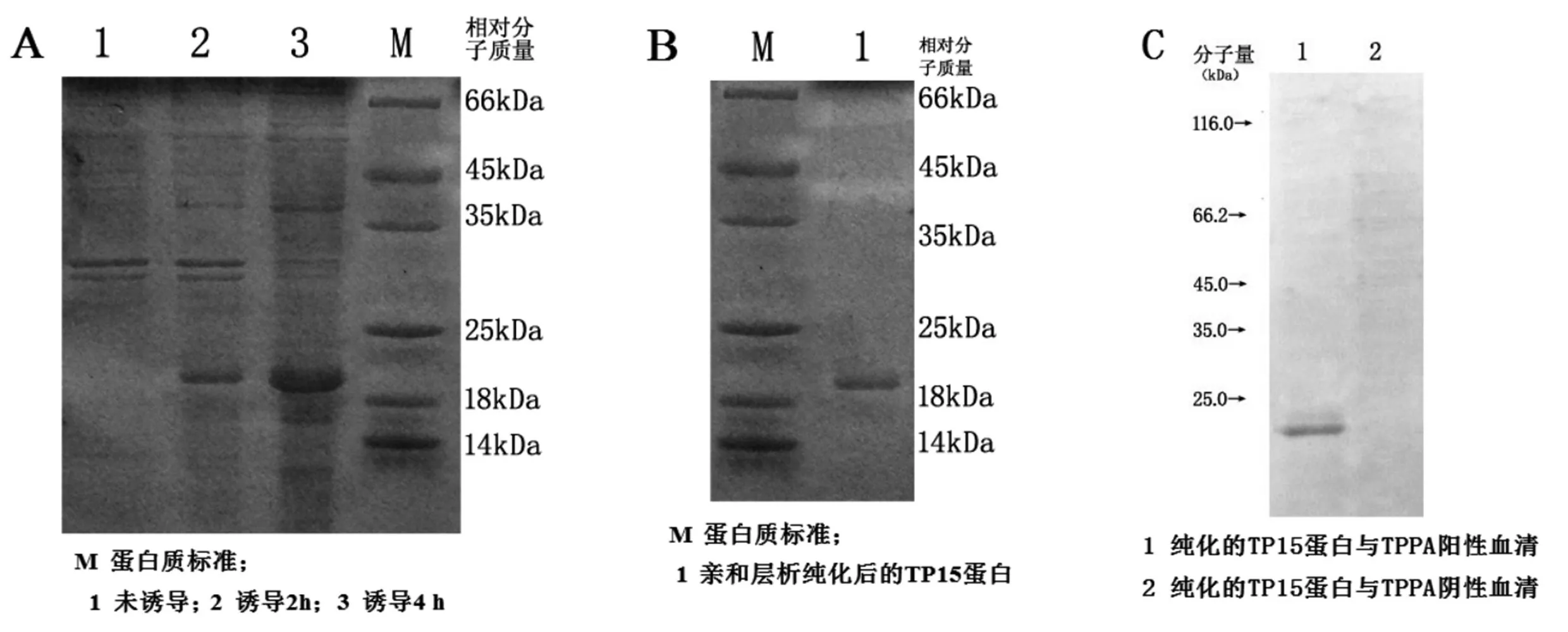
图2 梅毒螺旋体TP15 蛋白的诱导表达、纯化与验证
2.3 ELISA 间接法的检测结果 44 份TPPA 阴性样品的平均OD 值为0.212,标准差为0.04,因此阳性结果判断参考值为0.332。在44 份TPPA 阳性血清中发现2 份结果为阴性的标本,在44 份TPPA 阴性血清中发现2 份结果为阳性的标本,TPPA 与TP15-ELISA 检测梅毒特异性抗体的符合率比较,差异无统计学意义(P>0.05)。见表1。

表1 TPPA 与TP15-ELISA 检测临床血清的结果(n)
3 讨论
梅毒螺旋体是梅毒的病原体。梅毒是一种慢性、多期、全身性疾病,有三种主要传播方式:性接触、接触感染性病变及宫内感染。虽然梅毒使用青霉素治疗治愈率高,但每年仍然约有1100 万新增感染[5]。先天性梅毒可导致自然流产、死胎、产后死亡或新生儿畸形,目前每年估计仍有140 万孕妇感染梅毒[6]。此外,已经证实有症状的梅毒感染会使艾滋病毒传播和获得的风险增加2~5 倍,对全球公共卫生构成的威胁[7]。
目前对梅毒螺旋体感染的诊断主要依靠病原体的直接检测[2]与血清学抗体检查[3]。病原体的检测取样及检测都比较繁琐,因此限制了其在临床上大规模的应用;而在梅毒血清抗体的检测中,RPR 和TPPA是诊断梅毒的经典方法,但不适于大批量标本的筛查。RPR 检测梅毒非特异性抗体,存在一定比例的假阳性反应,且易漏诊三期及治疗后梅毒,仅适用于梅毒感染的初步筛查[8]。TPPA 是目前国内许多医院常用的梅毒确诊试验,但检测时标本需要系列稀释,操作烦琐,检测时间长,难以自动化,同样不适合大批量标本的筛查[9]。
梅毒螺旋体TP15 脂蛋白是梅毒螺旋体含量丰富的外膜蛋白之一,具有较强的免疫原性,在梅毒感染的各个期间均可引起高抗体反应,且与其他螺旋体疾病患者的血清不发生交叉反应,是一种针对梅毒特异性抗体检测的新型位点[4]。而ELISA 灵敏度高,特异性强,稳定性好,可自动化,是梅毒筛查的理想方法[10]。
由于梅毒螺旋体难以在体外培养,本研究中我们采用基因工程技术,构建梅毒螺旋体TP15 基因的原核表达载体,通过诱导表达获得TP15 重组蛋白,经SDSPAGE 验证后显示为单一的蛋白条带,表明所采用的Ni-NTA 亲和层析法可快速获得高纯度的TP15 蛋白,进而我们利用TP15 重组蛋白建立了以TP15 为诊断抗原的间接ELISA 检测方法。在与传统梅毒血清学诊断方法比较中发现,TPPA 与TP15-ELISA 检测梅毒特异性抗体的符合率比较,差异无统计学意义(P>0.05)。
综上所述,通过基因工程获得的TP15 蛋白具有良好的临床应用前景,可以作为研发新一代梅毒诊断试剂重要物质基础。

