上调miR-125a-5p抑制急性髓系白血病细胞系的增殖和侵袭
高秋英,荀利如,李 岚,侯丽敏,周 伟,王 晖*
(陕西省人民医院 1.血液科; 2.肾病血透中心, 陕西 西安 710068)
急性髓系白血病(acute myelocytic leukemia,AML)是造血系统的髓系原始细胞克隆性恶性增殖性疾病,是一种高度异质性疾病群[1]。中国的AML发病率在世界范围内排名第三,而中国年轻AML患者的病死率最高[2]。因此,迫切需要开发抗AML的新疗法。
微小核糖核酸(microRNAs,miRNAs)是一种短的非编码RNA分子,其通过靶向mRNA的3′-非翻译区(3′-UTR)来调节基因表达。miRNA被视为基因表达的天然调节剂。最新研究证明,miRNA可能通过靶向癌基因或肿瘤抑制因子来参与癌细胞的增殖、分化、凋亡、迁移和侵袭的调控,并且对于AML的诊断和治疗具有重要作用[3-4]。例如,miR-125a-5p在尿路上皮癌[5]、胃癌[6]、肺癌[7-8]中被下调并发挥抑癌作用,然而其在结肠癌[8]中被上调并发挥致癌作用。miR-125a-5p的低表达与胃癌的淋巴结转移及预后有关,miR-125a-5p通过靶向肿瘤转移抑制基因BRMS1发挥肿瘤抑制作用[5]。过表达miR-125a-5p可通过沉默参与致癌的KRAS和NF-κB通路的相关基因增强肺癌细胞对药物的敏感性,并减弱细胞的侵袭性[7]。上调miR-125a-5p通过靶向NEDD9抑制肺腺癌的增殖并诱导细胞凋亡[8]。miR-125a-5p在结肠癌组织中的表达水平高于癌旁组织,其表达水平与肿瘤大小、淋巴结转移和临床分期显著相关,减少miR-125a-5p可促进结肠癌细胞凋亡[9]。然而,目前尚不清楚miR-125a-5p在AML中的详细功能和分子机制。
E3泛素蛋白连接酶TRIM71(tripartite motif containing 71,TRIM71)属于TRIM蛋白家族[10],TRIM71在非小细胞肺癌患者中高表达,TRIM71的表达与肿瘤大小、淋巴结转移,TNM分期和不良预后相关。并且TRIM71可通过调节核因子κB(nuclear factor kappa-B,NF-κB)信号通路促进癌细胞的增殖和转移能力[10]。然而,目前尚不清楚TRIM71在AML中的表达模式及功能。另外,已证明NF-κB是一些恶性肿瘤中某些miRNA的靶基因,例如miRNA-223通过激活NF-κB信号通路促进肺癌进展[12],在宫颈癌中,miR-429通过负调节NF-κB的活化发挥抗肿瘤活性[13]。
本研究考察了miR-125a-5p在AML发病机理中的功能,研究miR-125a-5p在此过程中的分子机制,并分析和验证了miR-125a-5p的靶向调控基因,旨在为AML的诊断和治疗提供候选分子靶标。
1 材料与方法
1.1 材料
1.1.1 药品和试剂:胎牛血清(HyClone公司);RPMI-1640培养基(Gibco公司);Lipofectamine 2000(Invitrogen公司);MTT法测定试剂盒(北京索莱宝科技有限公司);Matrigel(BD Biosciences公司);结晶紫、annexin V-FITC/PI凋亡检测试剂盒、BCA蛋白质检测试剂盒和增强化学发光(ECL)试剂(碧云天生物技术研究所);Trizol试剂(Life Technology公司);PrimeScriptTMRT试剂盒和SYBR Premix Ex Taq(TaKaRa公司);RIPA裂解缓冲液(Thermo Fisher Scientific公司);PVDF膜(Millipore公司);Bax、Bcl-2一抗及HRP标记的山羊抗兔或山羊抗小鼠IgG(Santa Cruz Biotechnology公司);TRIM71、NF-κB p65一抗(Cell Signaling Technology公司);lamin-B、β-actin一抗(Abcam公司);pGL3荧光素酶报告载体(Promega公司)。miR-125a-5p mimic及miR-NC、pcDNA3.1-TRIM71及pcDNA3.1-NC(上海吉玛制药技术有限公司)。
1.1.2 AML患者骨髓标本的收集:收集2017年6月至2019年6月间陕西省人民医院收治的性别和年龄匹配的20例AML患者[男女各10例,年龄为24~65岁,平均(41.3±11.4)岁]和20名健康受试者[男女各10例,年龄为27~58岁,平均(42.3±13.1)岁]的骨髓样本。在收集骨髓之前AML患者未接受任何治疗。通过RT-qPCR检测骨髓标本中miR-125a-5p和TRIM71的表达。本研究方案已获得本院伦理委员会批准[审批文号:SYL(No):2017-0636],所有参与者均知情同意。
1.1.3 细胞系:人正常外周血单个核细胞(peri-pheral blood mononuclear cell, PBMC)、人急性髓系白血病(AML)细胞系U937和HL60(美国典型培养物保藏中心)。
1.2 方法
1.2.1 细胞的分组及处理:所有细胞均常规培养在含有10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的RPMI-1640培养基中,培养环境为37 ℃、5% CO2。取处于对数增殖期的细胞用于本实验研究。将U937或HL60细胞接种在24孔板中,孵育24 h。当细胞达到80%汇合时,根据说明书,使用Lipofectamine 2000分别将100 nmol/L的miR-125a-5p模拟物(miR-125a-5p mimic)或阴性对照(miR-NC)转染到U937和HL60细胞中。另外,使用Lipofectamine 2000将过表达TRIM71的质粒(pcDNA3.1-TRIM71)或对照质粒(pcDNA3.1-NC)转染到U937和HL60细胞中。在转染后的指定时间点,收集细胞用于进一步检测。
1.2.2 MTT法测定细胞活力:细胞转染后,收集细胞并接种在96孔板中(每孔1×105个细胞),然后在37 ℃下再孵育48 h。根据说明书进行MTT法测定。
1.2.3 Matrigel体外侵袭实验测定细胞侵袭:将转染的细胞(5×104个细胞/孔)接种到含有无血清RPMI 1640培养基的Transwell上室中,上室底部用Matrigel包被。下室中添加15% FBS的RPMI 1640。孵育36 h后,刮除未侵袭的细胞。用4%多聚甲醛固定侵袭的细胞30 min。然后将细胞在室温下用0.1%结晶紫染色2 h。计数5个随机视野中的侵袭细胞数量。
1.2.4 流式细胞测量术测定细胞凋亡:收集转染后的细胞,用PBS洗涤,并在4 ℃以1 000 r/min离心10 min。然后将细胞与膜联蛋白-V(annexin-V)在黑暗中孵育15 min,在孵育结束前5 min添加碘化丙啶(PI)并孵育5 min。离心后,使用PBS重悬细胞,并在FACS Calibur流式细胞仪上进行分析。
1.2.5 RT-qPCR检测miR-125a-5p和TRIM71 mRNA的表达:用Trizol试剂分离骨髓标本及细胞总RNA。使用PrimeScriptTMRT试剂盒进行反转录。在7900HT荧光定量PCR仪上使用SYBR Premix Ex Taq进行PCR。引物序列为:miR-125a-5p,上游引物:5′-ACACTGCTCGATAGTAGGGCAGAA-3′,下游引物:5′-ATTCGAGTGTGTGAGGCCGTGGA-3′;U6,上游引物:5′-ACTTCGCACAGCATACTATA AAA-3′,下游引物:5′-GCACTTCCGTGACATCGTGTCAATTA-3′;TRIM71,上游引物:5′-CGGAGAAGGT CACCGTATCA-3′,下游引物:5′-TCCGGTCAGAC TCTTGTCTG-3′;β-actin,上游引物:5′-CGGAGAC ACGTGGACTCATA-3′,下游引物:5′-TCCGGTTCT GGGACCTTACT-3′。将miR-125a-5p的表达水平标准化为U6;将TRIM71的表达水平标准化为β-actin。通过2-ΔΔCt方法确定基因相对表达量。
1.2.6 Western blot检测TRIM71、Bax、Bcl-2和NF-κB p65蛋白的表达:收集细胞并在RIPA裂解缓冲液中裂解。使用BCA蛋白质检测试剂盒检测蛋白质浓度。通过12% SDS-PAGE分离等量的蛋白质,并将其转移至PVDF膜。在室温下,用含0.05% Tween 20和2.5%脱脂牛奶的TBST将膜封闭1 h,然后在4 ℃下与一抗孵育过夜。一抗包括TRIM71(1∶1 000)、Bax(1∶3 000)、Bcl-2(1∶1 000)、NF-κB p65(1∶5 000)、lamin-B(1∶2 000)和β-actin(1∶3 000)。用TBST洗涤3次后,将膜与HRP标记的山羊抗兔或山羊抗小鼠IgG在室温下孵育1 h。使用增强化学发光(ECL)试剂进行显影。
1.2.7 荧光素酶报告基因检测:将TRIM713′UTR的野生型或突变型插入pGL3荧光素酶报告载体,构建pGL3-TRIM71-WT和pGL3-TRIM71-MUT质粒。接下来,使用Lipofectamine 2000将pGL3-TRIM71-WT和pGL3-TRIM71-MUT与miR-125a-5p mimic或miR-NC一起共转染到细胞中。48 h后,使用双荧光素酶报告基因测定系统(Promega公司)测量荧光素酶活性。
1.3 统计学分析

2 结果
2.1 miR-125a-5p在AML患者和AML细胞中的表达
与对照相比,AML患者骨髓中miR-125a-5p的表达水平显著降低(P<0.05)。与PBMC相比,AML细胞(U937和HL60)中miR-125a-5p的表达水平也显著降低(P<0.05)(图1)。此外,取AML患者骨髓中miR-125a-5p表达水平的中位数作为截断值,将患者分为高表达组和低表达组,未发现不同(France, American, Britian,FAB)分型患者中miR-125a-5p表达的差异。
2.2 miR-125a-5p抑制AML细胞的增殖
miR-125a-5p mimic转染后U937和HL60细胞中miR-125a-5p的水平显著增加(P<0.05)。与对照组相比,miR-125a-5p mimic组的细胞活力显著降低(P<0.05)(图2)。
2.3 miR-125a-5p抑制AML细胞的侵袭
与对照组相比,miR-125a-5p mimic组的U937和HL60细胞的侵袭率显著降低(P<0.05)(图3)。
2.4 miR-125a-5p诱导AML细胞凋亡
与对照组相比,miR-125a-5p mimic组的U937和HL60细胞的凋亡率显著升高(P<0.05)(图4)。
2.5 miR-125a-5p靶向抑制TRIM71表达
与对照组相比,AML患者骨髓中TRIM71 mRNA的表达水平显著升高(P<0.05);与PBMC相比, AML细胞(U937和HL60)中TRIM71 mRNA的表达水平也显著升高(P<0.05)(图5)。使用生物信息学工具(TargetScan)分析miR-125a-5p的潜在靶mRNA。结果显示,TRIM71是miR-125a-5p的潜在靶标。荧光素酶报告基因检测显示,miR-125a-5p mimic有效抑制了pGL3-TRIM71-WT的荧光素酶活性(P<0.05)(图6)。

A.relative expression level of miR-125a-5p in bone marrow of healthy subjects and AML patients (n=20); *P<0.05 compared with control group; B.relative expression level of miR-125a-5p in PBMC, U937 and HL60 cells (n=3); *P<0.05 compared with PBMC; #P<0.05 compared with U937

A.miR-125a-5p transfection mimic up-regulated the expression of miR-125a-5p in U937 and HL60 cells; B.effect of up-regulation miR-125a-5p on the proliferation of U937 and HL60 cells; *P<0.05 compared with control group

*P<0.05 compared with control group图3 miR-125a-5p对AML细胞系侵袭的影响Fig 3 Effect of miR-125a-5p on the invasion of AML cell lines(scale bar=50 μm) n=3)
2.6 上调TRIM71对AML细胞的增殖、凋亡和侵袭的影响
与对照组相比,pcDNA3.1-TRIM71组的TRIM71的mRNA和蛋白表达水平均上调(P<0.05)(图7)。与对照组相比,pcDNA3.1-TRIM71组的细胞活力和细胞侵袭率(P<0.05)显著升高(图8);对照组和pcDNA3.1-TRIM71组的细胞凋亡率差异无统计学意义(P>0.05)(图9)。
2.7 miR-125a-5p靶向TRIM71调控AML细胞的增殖、凋亡和侵袭
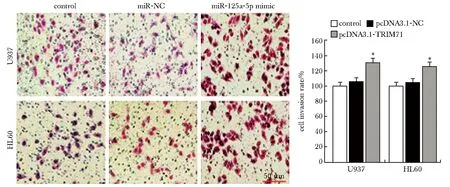
与miR-125a-5p mimic组相比,(miR-125a-5p mimic+pcDNA3.1-TRIM71)组的细胞活力和细胞侵袭率显著增加,而细胞凋亡率显著降低(P<0.05)(图10~11)。
2.8 miR-125a-5p靶向TRIM71调控凋亡基因表达和NF-κB p65的核转位
与对照组相比, miR-125a-5p mimic组的U937和HL60细胞中TRIM71的蛋白表达水平显著降低(P<0.05)。与对照组相比,miR-125a-5p mimic组的促凋亡蛋白Bax的表达水平升高,抗凋亡蛋白Bcl-2的表达水平降低,nucleus NF-κB p65蛋白表达水平降低(P<0.05)。与对照组相比,pcDNA3.1-TRIM71组的Bax表达水平降低,Bcl-2和nucleus NF-κB p65蛋白表达水平升高(P<0.05)。与miR-125a-5p mimic组相比,(miR-125a-5p mimic+pcDNA3.1-TRIM71)组的nucleus NF-κB p65蛋白表达水平显著增加(P<0.05)(图12~14)。

A.U937 cell apoptosis experiment (annexin-V-FITC/PI staining); B.HL60 cell apoptosis experiment (annexin-V-FITC/PI staining); C.statistical analysis of apoptosis rate; *P<0.05 compared with control group

A.relative expression of TRIM71 mRNA in bone marrow of healthy subjects and patients AML cells(n=20); *P<0.05 compared with control group; B.relative expression of TRIM71 mRNA in PBMC, U937 and HL60 cells (n=3); *P<0.05 compared with PBMC; #P<0.05 compared with U937

A.miR-214-5p and TRIM71 3′UTR region binding site; B. cells pGL3-TRIM71-WT and pGL3-TRIM71-MUT relative luciferase activity; C.HL60 cells pGL3-TRIM71-WT and pGL3-TRIM71-MUT relative luciferase activity; *P<0.05 compared with pGL3- TRIM71-MUT

A.expression of TRIM71 in AML cells after transfection; B.effect of up-regulating TRIM71 on the viability of AML cells; *P<0.05 compared with the pcDNA3.1-NC group
3 讨论
miR-125a-5p在尿路上皮癌、胃癌、肺癌中发挥抑癌作用[5-8]。本研究显示,在AML中miR-125a-5p被下调。上调miR-125a-5p明显抑制了AML细胞的增殖和转移。miRNA主要通过下调靶基因的表达在人类癌中发挥功能。本研究显示,TRIM71是miR-125a-5p的潜在靶标。已知TRIM71是miRNA let-7的靶点,TRIM71可通过调节NF-κB信号通路促进癌细胞的增殖和转移能力,充当癌基因的作用[11]。Chen等人研究显示,TRIM71为新型突变体p53结合蛋白。TRIM71可诱导突变体p53的泛素化和蛋白酶体降解,并抑制突变体p53靶基因的广泛表达,并且,抑制TRIM71可以在体外和体内抑制卵巢癌细胞的增殖[14]。然而,目前尚不清楚TRIM71在AML中的表达模式及功能。在本研究中,TRIM71在AML患者骨髓中高表达。上调TRIM71的表达促进了AML细胞的增殖和侵袭,但未影响细胞凋亡。此外,过表达TRIM71抑制了miR-125a-5p对AML细胞增殖、凋亡和侵袭的影响,
*P<0.05 compared with pcDNA3.1-NC group图8 上调TRIM71对AML细胞系侵袭的影响Fig 8 Effect of up-regulation of TRIM71 on invasion of AML cell n=3)

A.effect of transfection of pcDNA3.1-TRIM71 on the apoptosis of U937 cells; B.effect of transfection of pcDNA3.1-TRIM71 on the apoptosis of HL60 cells; C.statistical analysis of apoptosis rate
这些结果说明miR-125a-5p对AML细胞的影响部分归因于其对TRIM71的靶向抑制作用。我们推测,TRIM71被下调后,导致其下游的NF-κB信号通路被抑制,并减少了抑癌基因TP53的泛素化和蛋白酶体降解,从而抑制了肿瘤发生发展。然而,具体的作用机制还需要进一步研究。

A.effect of co-transfection of miR-125a-5p mimic and pcDNA3.1-TRIM71 on the invasion of U937 and HL60 cells; B.effect of co-transfection of miR-125a-5p mimic and pcDNA3.1-TRIM71 on the proliferation of U937 and HL60 cells; *P<0.05 compared with the control group; #P<0.05 compared with the miR-125a-5p mimic group

A.effect of co-transfection of miR-125a-5p mimic and pcDNA3.1-TRIM71 on the apoptosis of U937 cells; B.effect of co-transfection of miR-125a-5p mimic and pcDNA3.1-TRIM71 on the apoptosis of HL60 cells; C.statistical analysis of apoptosis rate; *P<0.05 compared with the control group; #P<0.05 compared with the miR-125a-5p mimic group

A.protein expression in U937 cells; B.protein expression in HL60 cells; *P<0.05 compared with miR-NC group图12 上调miR-125a-5p对AML细胞系中TRIM71、Bax、Bcl-2和nucleus NF-κB p65蛋白表达的影响

A.protein expression in U937 cells; B.protein expression in HL60 cells; *P<0.05 compared with miR-NC group图13 上调TRIM71对AML细胞系中Bax、Bcl-2和nucleus NF-κB p65蛋白表达的影响
NF-κB在许多癌的进展和发展中起重要作用[15-16]。NF-κB是一种转录因子,通过控制相关基因的表达来调节炎性反应、细胞增殖、侵袭和凋亡[13]。

*P<0.05 compared with control; #P<0.05 compared with miR-125a-5p mimic 图14 miR-125a-5p靶向TRIM71调控nucleusNF-κB p65蛋白表达Fig 14 miR-125a-5p targeting TRIM71 regulated nucleus NF-κB p65 protein expression
在正常生理条件下,NF-κB通过与蛋白质亚基IκBs结合而以无活性形式位于细胞质中。激活后,NF-κB从抑制性亚基上释放,导致IκB-α磷酸化和降解,然后NF-κB p65的另一个亚基转移到细胞核并调节靶基因的表达[17]。NF-κB在结直肠癌、胰腺癌等癌组织中显著上调[18]。因此,抑制NF-κB可能是抗癌治疗的一种新方法。另外,已证明NF-κB是一些恶性肿瘤中某些miRNA的靶基因,并且NF-κB信号通路调节多种细胞凋亡相关分子的表达。还有学者报道,TRIM71通过NF-κB通路调节非小细胞肺癌增殖和凋亡[11]。本研究结果表明,在AML细胞系中,miR-125a-5p通过靶向抑制TRIM71的表达来抑制NF-κB p65的核转位,进而抑制了NF-κB信号通路的激活并抑制了细胞增殖。
综上所述,本研究结果表明miR-125a-5p在AML患者的骨髓细胞中低表达,上调miR-125a-5p通过靶向抑制TRIM71来降低AML细胞系的增殖和侵袭并诱导凋亡。此外,miR-125a-5p可通过抑制NF-κB信号通路的活化来抑制AML细胞增殖。这些发现表明miR-125a-5p和TRIM71可能是AML的早期诊断和临床治疗分子靶点。

