上游刺激因子1对脑胶质瘤微血管内皮细胞增殖、迁移及体外血管生成的影响
李宇 刘宇翔 萨丽波
脑胶质瘤是颅内的原发性肿瘤,约占全部颅内肿瘤的40%~50%,临床治疗以手术、放疗及化疗为主,但效果不佳[1]。既往研究表明,血管生成在胶质瘤的发生、发展及转移中起关键作用[2]。据报道MOV10结合circ-DICER1通过miR-103a-3p/miR-382-5p途径介导ZIC4的表达改变进而调控胶质瘤血管生成[3]。在胶质瘤中血管素(Vasorin,VASN)高表达会刺激肿瘤恶性进展及血管生成[4]。 FUS/circ_002136/miR-138-5p/SOX13反馈环在胶质瘤中调节血管生成[5]。因此,抗血管生成被认为是治疗脑胶质瘤的重要方法,需要对脑胶质瘤的血管生成进行深入研究。
脑胶质瘤的进展取决于肿瘤血管的生长。胶质瘤细胞能够分泌血管内皮生长因子和碱性成纤维细胞生长因子等促血管生成因子来促进血管内皮细胞的生长。此外,胶质瘤血管内皮细胞也分泌许多促进肿瘤生长的因子,这些因子的相互作用可以促进脑胶质瘤的生长[6]。上游刺激因子(Upstream stimulating factors,USF)基因主要包括USF1和USF2[7],具有高度保守的bHLH-LZ结构域,能够结合E-box的一致序列CANNTG来调节基因的转录[8~10]。USF1基因 定位于chr1q22-23,能够编码含有310个氨基酸残基的蛋白,共有10个外显子,总长4kb。USF1在脑胶质瘤细胞中能够与组织蛋白酶B启动子区的E-box序列结合,增加其启动子活性,促进其表达,调控肿瘤的侵袭和进展[11]。
在前期工作中发现USF1在脑胶质瘤微血管内皮细胞(Glioma microvascular endothelial cell,GEC)中的表达水平显著高于其在人脑微血管内皮细胞(Human cerebral microvascular endothel cell,EC)中的。而USF1对GEC的增殖、迁移和体外血管生成等方面的影响目前尚不十分清楚,值得深入研究,我们的研究将可能为脑胶质瘤的抗血管生成治疗提供一个新的策略。
1 材料与方法
1.1 材料人脑微血管内皮细胞系hCMEC/D3 和人胶质瘤细胞系U87均购自上海富衡生物科技有限公司;内皮细胞培养基ECM (ScienCell)、DMEM培养基(HyClone)、胎牛血清(Gibco)、USF1过表达和沉默转染质粒均购自苏州吉玛公司;转染试剂Lipofectamine LTX and PLUS Reagents购自Life公司; CCK-8 Kit购自日本同仁公司;吉姆萨染液、胰蛋白酶均购自北京索莱宝公司;基质胶购自BD公司;兔抗人USF1多克隆抗体、鼠抗人GAPDH单克隆抗体、HRP标记的抗兔IgG抗体、HRP标记的抗鼠IgG抗体均购自Proteintech公司; SDS-PAGE配胶试剂盒、一抗稀释液、ECL超敏发光液均购自上海碧云天公司。
1.2 实验方法
1.2.1 建立人GEC模型 用直径100mm的培养皿培养U87细胞,近融合时弃去DMEM高糖培养基(10%胎牛血清),用无血清培养液冲洗两次,然后加入无血清ECM培养液在37℃、5%CO2的恒温培养箱中培养24h后用50ml离心管收集,4℃ 离心10min,收集上清液,加入5%胎牛血清,配成胶质瘤条件培养液,用其培养hCMEC/D3(EC)细胞72h后,人GEC模型建立成功。
1.2.2 建立USF1稳定转染细胞系 sh-USF1质粒(序列 为GCAGATTCAGGAAGGTGCAGT)的载体为pGPU6/GFP/Neo, USF1过表达质粒的载体为pcDNA3.1(+),阴性对照为相应质粒的空载体。GEC细胞生长状态良好时将其接种于24孔板中,转染试剂为Lipofectamine LTX and PLUS,将USF1过表达和表达沉默的质粒及相应的阴性对照质粒分别进行转染,大约4周后经G418筛选培养得到USF1过表达和表达沉默的GEC系,收集细胞,提取细胞中的蛋白质进行样品制备,Western blot检测USF1蛋白的表达,BCA法测定蛋白样品浓度,电泳、转印、封闭、抗体孵育、洗膜、ECL发光,验证转染效率。在后续进行的实验中将其分为5组:①对照(Control)组;②USF1(+)NC组;③USF1(+)组;④USF1(-)NC组;⑤USF1(-)组。
1.2.3 细胞生长抑制实验(CCK-8法) 转染后分组的GEC接种于96孔细胞培养板中,密度为2 000 个/孔,每孔加入200μl胶质瘤条件培养液,培养24h后换液,每孔加100μl培养液及10μl的CCK-8试剂,培养箱中孵育2h后酶标仪检测OD值,波长450nm。细胞活力(%)=(实验组OD值-空白OD值)/(对照组OD值-空白OD值)×100%。独立进行3次实验,每组设置3个重复孔,取平均值计算分析。
1.2.4 细胞迁移实验 24孔细胞培养板中Transwell小室的上室分别加入100μl密度为5×105/ml无血清胶质瘤条件培养液培养的转染后分组的GEC细胞,下室加入600ml含5%胎牛血清的胶质瘤条件培养液,培养箱中孵育24h后取出Transwell小室,上表面的细胞用棉签轻轻擦拭去除,固定液由甲醇和冰醋酸按照3∶1比例配制,细胞固定30min,然后用10%吉姆萨染液染色30min,PBS充分冲洗,每孔至少3次,在高倍镜视野中随机选取5个视野,计数细胞迁移的数目。独立进行3次实验,每组设置3个重复孔,取平均值进行分析。
1.2.5 体外血管生成实验 将96孔板进行预冷处理,每孔加入100μl基质胶,37℃放置30min使其聚合,每孔分别加入100μl胶质瘤条件培养的转染后分组的hCMEC/D3细胞,密度为4×105/ml,培养箱中孵育24h后随机取5个高倍镜视野进行拍照,计数微血管的长度及分支数。
1.3 统计学方法应用GraphPad Prism 5.0统计学软件对采集的数据进行分析,采用均数±标准差表示计量资料,两组间数据的分析采用t检验,多组间数据的分析采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 USF1过表达和表达沉默对GEC增殖能力的影响与对照组比较,USF1(+)NC组和USF1(-)NC组的细胞增殖能力差异无统计学意义(P>0.05);与USF1(+)NC组比较,USF1(+)组细胞增殖能力增强(P<0.05);与USF1(-)NC组比较,USF1(-)组细胞增殖能力降低(P<0.05)。见图1。
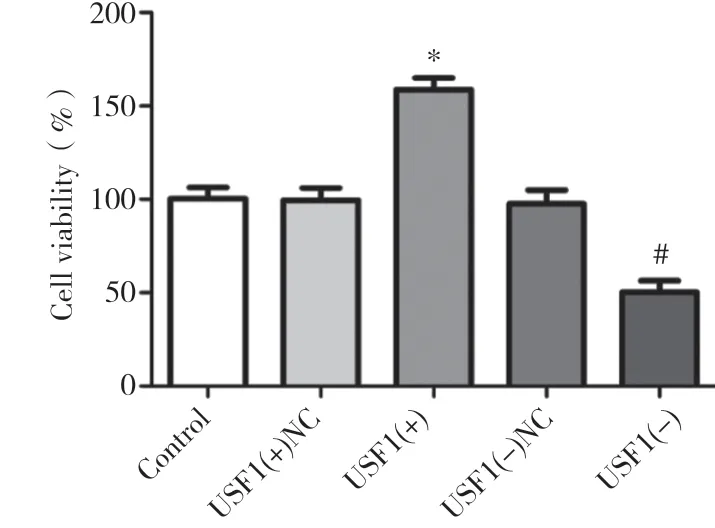
图1 USF1过表达和表达沉默对GEC增殖能力的影响
2.2 USF1过表达和表达沉默对GEC迁移能力的影响与对照组比较,USF1(+)NC组和USF1(-)NC组的细胞迁移能力差异无统计学意义(P>0.05);与USF1(+)NC组比较,USF1(+)组细胞的迁移能力增强(P<0.05);与USF1(-)NC组比较,USF1(-)组细胞的迁移能力降低(P<0.05)。见图2。

图2 USF1过表达和表达沉默对GEC迁移能力的影响
2.3 USF1过表达和表达沉默对GEC血管生成能力的影响与对照组比较,USF1(+)NC组和USF1(-)NC组的细胞体外血管生成能力差异无统计学意义(P>0.05);与USF1(+)NC组比较,USF1(+)组内皮细胞的体外血管生成能力增强(P<0.05);与USF1(-)NC组比较,USF1(-)组内皮细胞的体外血管生成能力降低(P<0.05)。见图3。

图3 USF1过表达和表达沉默对GEC血管生成能力的影响
3 讨论
上调GEC中USF1的表达后,GEC的增殖、迁移和血管生成能力均增强;下调GEC中USF1的表达后,GEC的增殖、迁移和血管生成能力均减弱。上述结果说明了USF1过表达能够增强GEC的增殖、迁移和血管生成能力,抑制USF1的表达能够降低GEC增殖、迁移和血管生成能力。
在各种组织细胞中,USF基因表达广泛,是一种重要的调节因子,各种蛋白的转录过程都有其参加调节[12]。在人血管平滑肌细胞中,USF1与cGMP依赖蛋白激酶1的启动子区的E-box序列结合,增加其启动子活性,调控其表达进而调节血管平滑肌细胞的生长和分化[13]。USF1参与调控40余种心血管相关基因的转录[14]。
在脑胶质瘤的相关研究中发现,恶性胶质瘤细胞的抗血管生成治疗是治疗高级别胶质瘤的有效方法。然而,由于血管生成拟态(Vasculogenic mimicry,VM)的存在,神经胶质瘤的抗血管生成治疗在改善患者总体中位生存率方面没有显著效果。研究发现USF1在胶质瘤组织和细胞中的表达上调。敲除USF1通过刺激 SNHG16和linc00667 抑制胶质瘤细胞中VM相关蛋白的表达。通过SNHG16/miR-212-3p和linc00667/miR-429轴抑制脑胶质瘤细胞血管生成拟态[15]。还有学者研究发现HAS2-AS1在胶质瘤组织和细胞中高表达,与预后不良显著相关。沉默 HAS2-AS1 表达能够抑制胶质瘤细胞迁移和侵袭。USF1在胶质瘤中高表达,与HAS2-AS1水平呈正相关。USF1通过结合HAS2-AS1启动子区域激活HAS2-AS1的转录,从而增强胶质瘤细胞的侵袭和迁移能力[16]。胶质母细胞瘤是最具侵袭性和致命性的肿瘤之一。MUC13 是一种膜结合粘蛋白,在胶质母细胞瘤干细胞 (Glioblastoma stem cell,GSC)中的表达显著增强。MUC13的过表达显著增强了GSC的侵袭和迁移能力。研究发现USF1可以结合 MUC13 的启动子区域,从而增强 MUC13的激活。研究证明USF1 主要通过激活 MUC13来增强GSC的增殖和自我更新进而促进胶质母细胞瘤的进展[17]。研究发现USF1不仅在脑胶质瘤中在其他癌症中对癌细胞的增殖、转移、凋亡、侵袭等方面也有调控作用。据报道在胆管癌中ZFAS1的上调提示胆管癌预后不佳,ZFAS1通过miR-296-5p调控USF1的表达促进癌细胞的增殖和转移[18]。在皮肤鳞状细胞癌中USF1通过诱导LINC01048上调促进癌细胞增殖,并且通过结合TAF15转录激活YAP1诱导癌细胞的凋亡[19]。在肺癌中USF1通过诱导长链非编码RNA WDFY3-AS2过表达并通过靶向调节miR-491-5p/ZNF-703轴促进肺癌的发展[20]。USF1还能通过上调TGF-β信号通路进而促进黑色素瘤的发生[21]。USF1在胃癌的发生和发展中也发挥重要作用,通过LncRNA LOXL1-AS1/ miR-708-5p/USF1通路来进行调节[22]。 USF1还能通过介导的lncRNA GAS6-AS2上调并通过miR-934/BCAT1轴促进骨肉瘤的进展[23]。在宫颈癌中USF1主要通过转录激活p65的表达促进宫颈癌细胞的恶性发展[24]。
综上所述,USF1可能在调控GEC的生物学行为方面发挥重要作用。具体的调控机制还有待进一步深入研究,以为脑胶质瘤的综合治疗提供新靶点和新策略。

